无锡地区无偿献血者ABO亚型血型血清学及分子生物学特征研究
张震 洪俊 徐钰茜 钱惠忠 许友山
ABO亚型的鉴定常以血型血清学方法为主,由于不同ABO亚型的抗原抗体强度不同[1],可能还有不规则抗体、自身抗体等因素的干扰,使ABO亚型不能准确地定型。除血型血清学方法外,还常采用分子生物学方法来检测ABO亚型:应用序列特异性引物引导的PCR反应(sequence specific primer,PCR-SSP)进行初步基因分型以及经DNA测序后参照标准序列进行突变位点分析[2-3]。由于分子生物学技术从基因的角度对血型进行鉴定,可以弥补血型血清学方法的缺陷,使ABO亚型的分型结果更为准确,临床输血更为安全[4]。
材料与方法
1 研究对象:选择2016年5月~2019年6月,符合《献血者健康检查要求》的献血者共120 118名,经检验科检测为ABO血型正反定型不符或疑为亚型的标本送至血液研究室进一步鉴定ABO血型,最终经血型血清学方法初步判定为ABO亚型19例。
2 试剂与仪器:抗-A、抗-B(单克隆抗体)血型试剂,ABO反定型红细胞试剂盒,抗-A1试剂,抗-H(单克隆抗体)试剂,以上试剂均由上海血液生物医药有限公司生产;抗-A、抗-B血型定型试剂(人血清)由中国医学科学院输血研究所生产;抗-AB试剂由DIAGAST公司生产;核酸(DNA)提取试剂盒(高盐法)由江苏中济万泰生物公司生产;人类红细胞ABO基因分型试剂盒由天津秀鹏生物技术公司提供。KA-2200低速离心机、KA-3500高速离心机(日本久保田公司);水浴箱(德国MEMMERT公司);PCR扩增仪(美国Bio-Rad公司);电泳仪和凝胶成像分析仪(上海复日公司)。所用检测试剂均在有效期内使用。
3 方法
3.1 血型血清学方法:采用盐水试管法对标本进行ABO正反定型及吸收放散等试验,操作均按照文献[5]进行。ABO亚型的结果判断参考文献[6]。ABO亚型用血型血清学鉴定时,除了进行常规的正反定型之外,还进行了以下几种特殊试验:①采用增强法(加大血清/血浆量;反定结果较弱时在4 ℃放置10~30分钟后处理[6];多次离心)②被检者红细胞与抗-A1、抗-AB及抗-H血清的凝集试验。③抗体筛查试验。④吸收放散试验。
3.2 DNA提取:按照商品化试剂盒说明书进行操作。
3.3 PCR-SSP:检测及ABO基因第1-7外显子DNA测序:由于经血清学鉴定后标本量有限,故仅对14例疑为亚型标本进行分子生物学检测。14例标本中的11例同时进行PCR-SSP检测及DNA测序,另3例标本仅做了DNA测序。PCR-SSP检测按照商品化试剂盒说明书进行操作,DNA测序送至天津秀鹏生物技术公司完成。
结 果
1 ABO亚型血型血清学结果 本次研究经血型血清学方法初步判定ABO亚型19例,其中A亚型6例(Ael 1例、A21例、A2B 1例、AxB 3例),B亚型10例(Bend/B32例、Bel 3例、Bx 3例、ABend/AB31例、ABx 1例),CisAB型1例,B(A)型1例,AB类孟买型1例。无锡地区献血者ABO亚型检出率约为1.6/万,且B亚型多于A亚型(10/6)。血型血清学鉴定结果见表1。
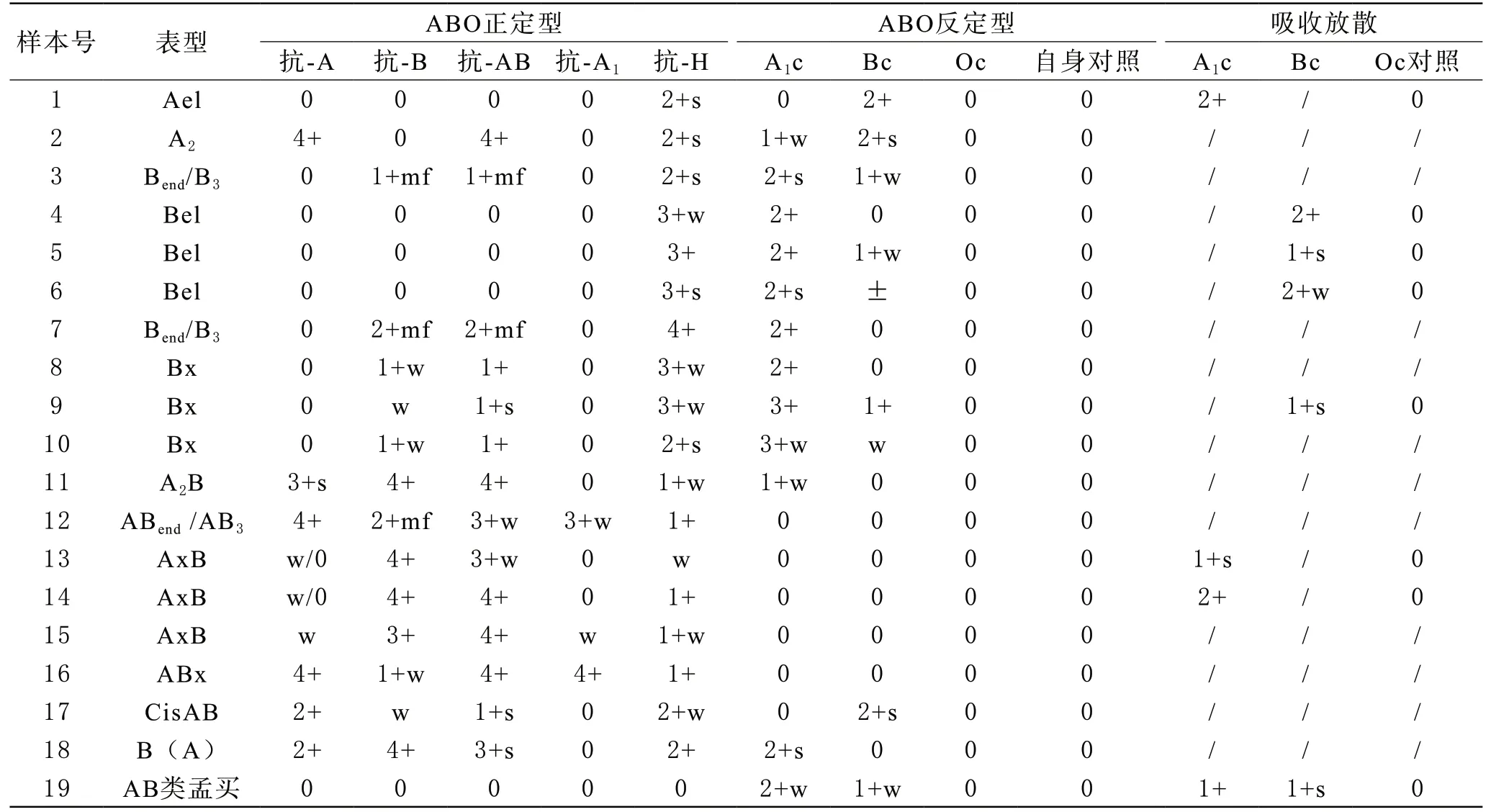
表1 19例样本ABO血型血清学反应格局图
2 PCR-SSP 检测结果 11例标本中A/O1、A201/O1、B/B基因型各1例,B/O1、B/O2基因型各2例,A/B基因型3例,另7号标本基因型不明确。PCR-SSP方法与血清学方法鉴定结果符合率约为90.9%(10/11),但分型结果较为粗略,尤其是ABO基因的特殊突变无法检测,需用DNA测序方法进一步分析。
3 DNA基因测序结果 在14例标本进行DNA基因测序结果中,获取了本地ABO亚型的多态性数据,有Ael02、A201、Bw27、Bel03、Bw22、B310、A217、CisAB01、B(A)02共计九种突变等位基因,国内均已有报道。DNA测序方法与血清学方法鉴定结果符合率约为78.6%(11/14)。4、12和13号标本的血型表型为Bel、ABend/AB3、AxB,但在PCR-SSP及第1-7号外显子DNA测序结果中均未见突变,结果见表2。16号标本的第1外显子发生了c.26_27delC的突变,发现为新等位基因,并已获GenBank注册号(MT281528),电泳图和测序图见图1。
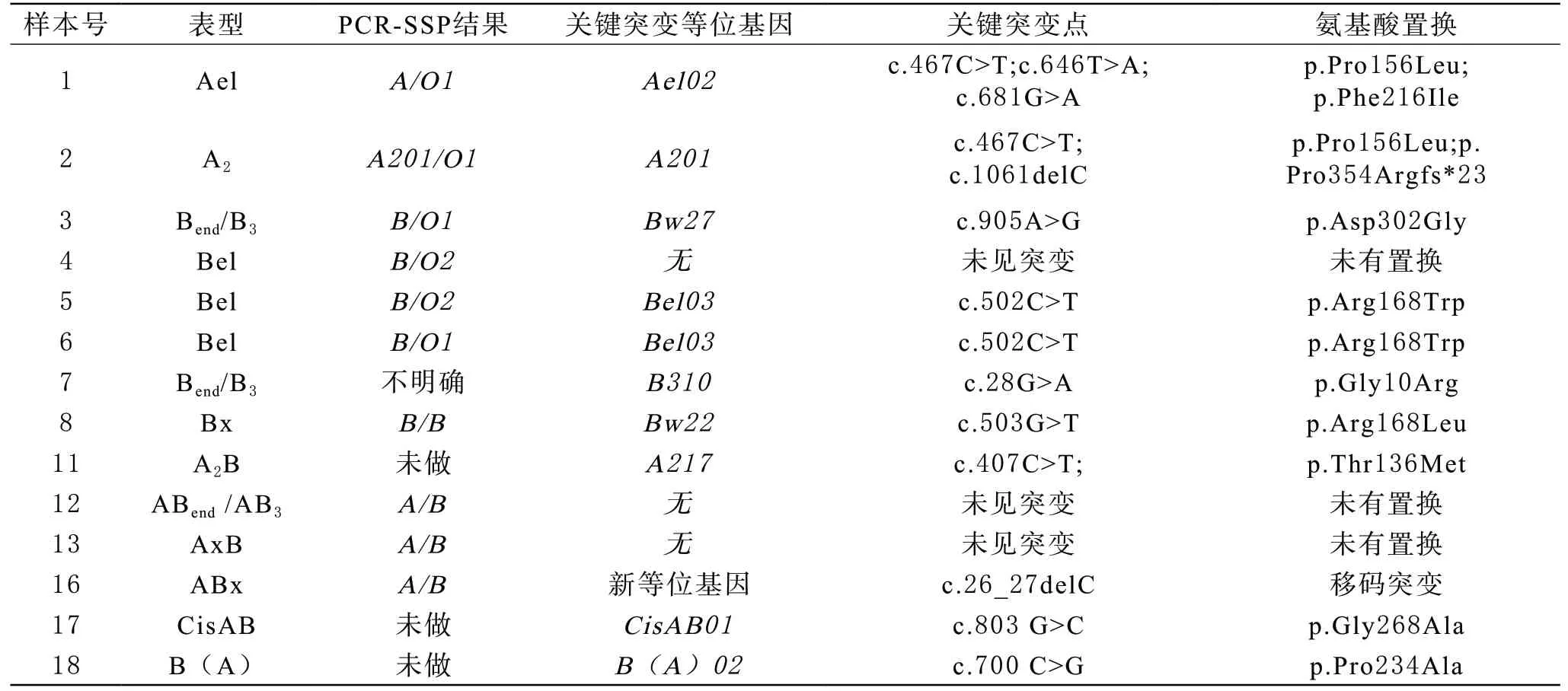
表2 本研究中发现的ABO亚型送检样本的PCR-SSP结果及测序结果
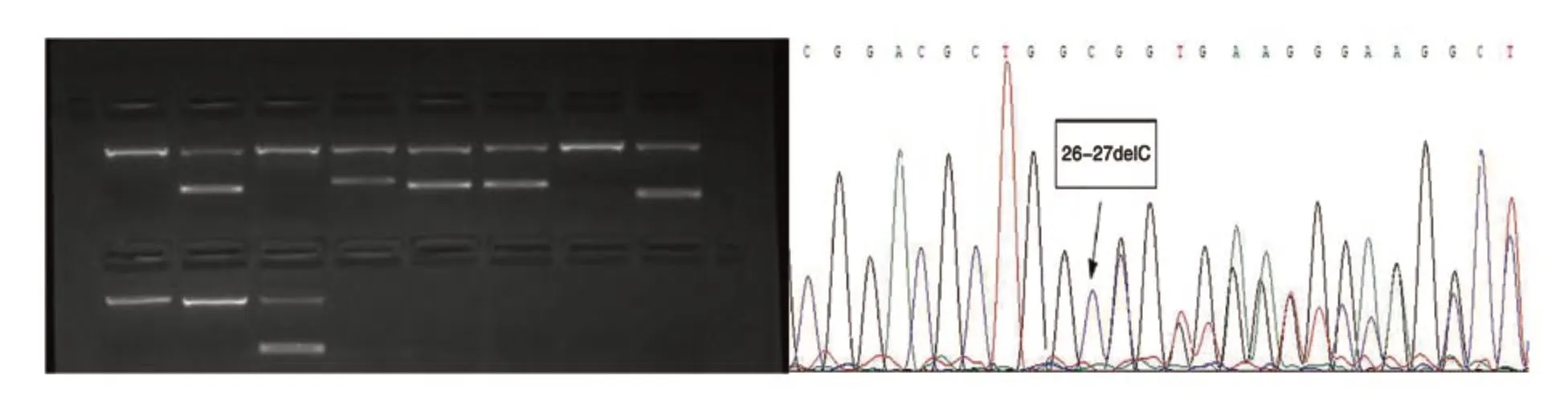
图1 16号样本新突变位点的电泳图及测序图
讨 论
ABO亚型的A、B抗原的数量和性质常发生改变,血浆中也常存在不规则抗-A或抗-B抗体。因此,ABO亚型常在正反定型不一致时被发现。ABO亚型较为少见,据报道:滨州地区献血者ABO亚型检出率约为1.4/万[7];邢台和上海地区献血者ABO亚型检出率均约为2.8/万[8-9],且B亚型多于A亚型[7-8]。本次研究ABO亚型检出率与滨州地区较接近,约为1.6/万,且B亚型也多于A亚型。较邢台和上海地区献血者ABO亚型检出率略低的原因可能有以下三点:①人群因素:由于地区人群不同而导致差异;②试剂原因:目前广泛使用单克隆试剂,能与Ax和Bx等一些亚型产生较强凝集,从而造成漏检;③方法学原因:由于本单位使用的血型仪检测需30 ℃孵育1 h后才出结果,对具有IgM型不规则抗体的亚型可能会造成漏检。
本次研究中的4、12和13号标本在血型血清学鉴定时表现出亚型特征,但在第1-7号外显子DNA测序中却未见突变。近年来,ABO等位基因的启动子、增强子、内含子等非编码调控区域的异常而导致A或B抗原弱表达的报道较多[10-13],因此上述3个标本还需对其非编码区进行分子生物学检测,观察有无异常。其余经DNA测序标本的ABO表型均与分子生物学结果相符。ABO等位基因的第6、7号外显子占编码区序列长度的77%,大多数亚型的变异发生于此,且变异类型以碱基替换为主。碱基替换后导致氨基酸的置换,常改变抗原表达量,有些还会影响其催化特性,甚至使糖基转移酶同时具有结合两种底物的能力[9,14-15],如17和18号的CisAB和B(A)标本。本次研究发现7号标本B310在第1外显子处发生c.28G>A突变,造成了p.Gly10Arg的置换。Cai X等人证实[16],B310抗原表达弱化的主要原因并非是氨基酸置换导致,而是由于c.28G>A处突变导致的剪接缺陷下调了ABO基因mRNA的水平,最终导致B抗原弱表达。16号标本血清学表现为ABx,DNA测序时发现第1外显子存在26位与27位之间的胞嘧啶缺失,其异常剪接处紧邻1号外显子的28位碱基,推测其B抗原弱表达发生机制类似B310基因,由于该标本的等位基因未做单倍体分析,所以未能确定突变位于A还是B等位基因上,后期将完善相关实验来证实以上推测。另外,2号标本A201除了一处碱基替换外,还存在c.1061处胞嘧啶单核苷酸的缺失,从而导致终止密码子失效,最终造成A2转移酶活性显著下降。据报道,在PH 5.5的条件下转化低分子量的底物,来源于A1血清的A转移酶的活性比A2转移酶高5~10倍[17]。
现有PCR-SSP方法试剂盒只能针对ABO基因中数个常见的重要位点做分析,而不能检测之外的点突变及缺失等情况[18],因此本次研究用PCR-SSP方法只鉴定了A201/O1亚型,PCR-SSP方法与血清学方法鉴定结果的符合率虽然较高,但根据表2的数据,大部分标本用PCR-SSP方法检测的结果比较粗略。因此,当血型血清学和PCR-SSP方法结论不一致时,需要进行DNA测序才能发现更多的突变情况。而PCR-SSP方法简单易操作,且在当天可以出结果,对于紧急且血清学结果不明确的标本可先用此方法分型。
笔者使用3种方法检测了ABO亚型标本,积累了鉴定ABO亚型的实验经验,对本地区ABO亚型发生频率及分子生物学特征有了初步了解。此次研究的例数较少,且未能对19例标本全部进行PCR-SSP检测及ABO等位基因全序列的测序,今后还需进一步收集标本来弥补以上不足。
利益冲突所有作者均声明不存在利益冲突

