中国晚发型阿尔茨海默病的遗传分析研究进展*
赵 璐 李 霞
阿尔茨海默病(Alzheimer’s Disease, AD)是一种不可逆的神经退行性疾病和最普遍类型的老年痴呆,占所有痴呆患者的60%~80%[1]。它的特点是细胞外的β-淀粉样蛋白斑块和细胞内神经纤维缠结在大脑中,导致神经元死亡、脑萎缩和记忆损害[2]。在全球范围内,AD在60岁以上人群中的流行率为4.6%~8.7%,并且其流行率随着人群年龄增加也迅速增加(在90岁以上人群中高达69.4%)。根据2018年世界阿尔茨海默病报告,到2050年,全球新诊断的AD患者预计将从2009年的3 500万人增加到1.35亿人[3,4]。据统计,我国已有超600万的老年人群罹患AD,预计到2050年患病人数将超过2 000万,成为全世界AD患病人数最多、增长速度最快的国家,这将会导致严重的公共卫生问题和非常沉重的社会经济负担[5,6]。
1 AD的遗传学假说
AD作为一种复杂疾病,约60%~80%的风险被认为是遗传性的,是一种多基因疾病[7~9],其他风险因素包括头部受伤、抑郁和高血压病史[10]。AD的遗传学假说认为家族性AD约占所有病例的5%,大多数常染色体显性家族性AD可归因于三种基因之一的突变:淀粉样蛋白前体蛋白(APP)、早老素1(PS1)以及早老素2(PS2)基因[8,9]。对于占据患者总数90%以上的晚发型AD,载脂蛋白ε4(Apolipoprotein ε4,APOEε4)是迄今为止唯一确定的风险基因[11],APOEε4等位基因在杂合子中将该疾病的风险增加3倍,在纯合子中增加8~12倍[12]。但它也只能解释20%~29%的发病因素,因此尚有许多新的易感基因有待探索和深入研究。
在过去的20年里,大量的基因分析,从连锁分析、候选基因研究到全基因组关联研究(Genome-Wide Association Studies,GWAS)、下一代测序研究(Next Generation Sequencing,NGS),已经确定了几十个AD易感性基因[13~15]。这些研究为遗传假说提供了有力证据,更有助于了解疾病的病理和分子机制。然而,大多数公认的AD遗传危险因素都是基于对欧洲人群的研究,有关其他人群的AD遗传相关数据非常有限。但是东西方人群之间存在显著的遗传差异,以及遗传危险因素的易感性差异,即使对于APOEε4这个晚发型AD最一致的危险因素,风险水平在不同种族群体中也有所不同[16]。因此,探索中国AD患者的遗传基础和分子机制可能成为破译AD全面遗传表征的关键。
2 中国人群AD候选基因研究:风险基因的验证和新突变的发现
首先,验证不同人群中主要风险基因位点与AD风险的关联是在AD遗传研究中必不可少的工作。Tan L等[17]和Yu JT等[18]对中国北方汉族人群中GWAS连锁基因位点与晚发型AD的关系进行研究,验证了APOE、凝集素(CLU)、髓系细胞分化抗原分子(CD33)和四跨膜蛋白亚家族A成员(6AMS4A6A)4个基因的常见突变体与AD之间的关联,但未能验证ATP结合盒亚家族A成员7(ABCA7)、白细胞分化抗原2相关蛋白(CD2AP)和产促红素肝癌细胞受体A1(EPHA1)与中国北方AD的关联。还有研究小组对中国西南和华东地区的人群进行调查,验证了汉族人群中磷脂酰肌醇结合网格蛋白组装蛋白(PICALM)、CLU、四跨膜蛋白亚家族A成员4E(MS4A4E)和桥接集成分子1(BIN1)与AD之间的关联,而其余的GWAS基因(如CD33和ABCA7)可能在该人群中没有发挥主要作用[19]。尽管大多数GWAS易感基因在中国得到了验证,但也有例外。例如,Zhang DF等[20]分析了中国西南和华东地区汉族人群与AD相关的主要免疫基因补体3b/4b受体1(CR1)、补体3b/4b受体2(CR2)、CLU、CD33和髓样细胞2性的触发受体(TREM2)的单核苷酸多态性(SNPs),发现与欧洲人强相关的CR1、CLU和CD33在中国人中表现为弱效应,而在中国人中,补体因子H(CFH)基因表现为强效应。
除了对其进行基因分型外,研究者还使用一代测序方法(Sanger测序)筛选了一些GWAS主要位点,以试图找出其潜在的功能变异,发现BIN1中rs67327804和rs1060743单核苷酸多态性中的“GA”单倍型使晚发型AD的患病风险提高了1.4倍[21]。在中国北方地区,研究观察到CR1中的错义变异会影响AD的患病风险[22]。最近的研究还对欧洲人的二代测序与AD的关联基因在中国人群中的突变模式进行了探讨,其中TREM2最受关注。对TREM2全序列进行完全Sanger测序发现,影响中国人AD患病风险的是一个罕见的编码突变体p.H157Y,而不是欧洲人群常见的关联基因[23,24]。表1总结了中国人群中AD常见候选基因的验证结果。
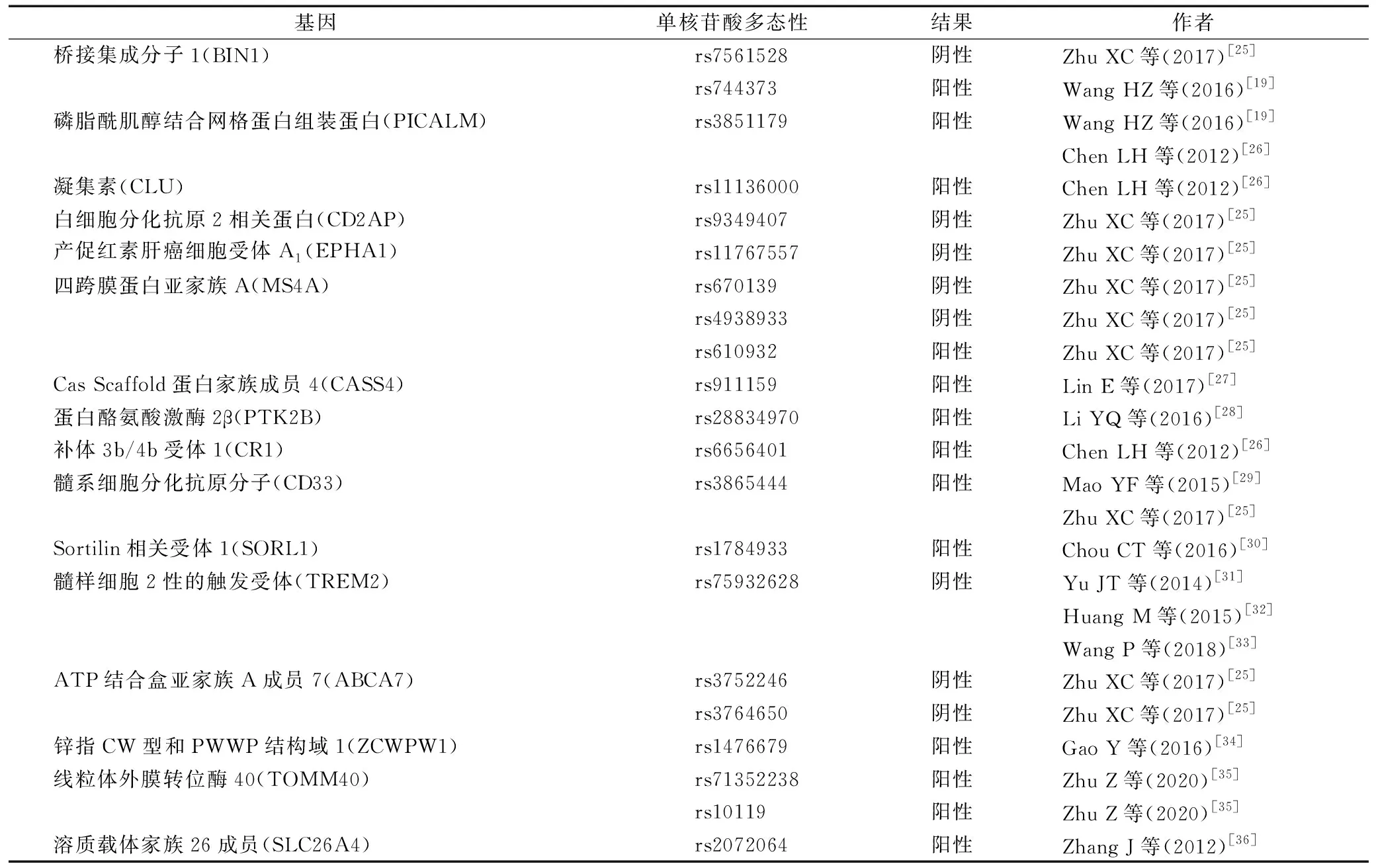
表1 中国人群AD候选基因验证
3 中国人群AD全基因组关联分析
尽管有上述候选基因研究,中国人群在AD全基因组研究中的代表性依然非常低。在2018年之前,没有关于中国人群的GWAS文章发表。终于在2018年出现了对中国人群AD的首次全基因组分析。在Zhou X等[37]进行的一项研究中,对来自华东地区的477例AD患者进行了低覆盖率全基因组测序,并发现了两个新的常见突变基因,分别是三磷酸鸟苷环水解酶抗体(GCH1)中的rs72713460和钾内整流通道亚家族J成员15(KCNJ15)中的rs92877。在另一项研究中,Wang B等[38]对来自香港的246例APOEε4阴性AD患者进行了全外显子测序,并发现伪激酶类的混合谱系激酶结构域(MLKL)基因中与AD相关的稀有变异体(p.Q48X)。2019年,Zhang DF等[39]在补体C7基因上发现了一个罕见错义变异rs3792646(p.K420Q),该突变的过度表达影响了细胞活性、免疫活化和β-淀粉样蛋白加工等方面。2020年11月,北京宣武医院的Jia L等[40]完成了首个较大样本(包括3 913例AD患者和7 593名认知正常者)的GWAS,发现了4个与AD相关的新风险基因位点(rs3777215、rs6859823、rs234434和rs2255835),利用风险位点建立了AD预测模型,在队列研究中进行了验证,能够有效地对AD的发病进行预测,在APOEε4阴性人群中,可以用4个位点对AD预测的曲线下面积达到0.73。这不仅揭示了中国人独特的AD风险位点,还为中国人AD的预防提供了重要数据。
4 小结与展望
但是,在未来的研究中,需要更大的样本才能获得足够的统计效力。在欧洲人群中有精神病基因组学联盟(Psychiatric Genomics Consortium,PGC)、英国生物数据库(UK Biobank,UKB)等数万或数十万计样本规模的数据库,由于在不同族群间的等位基因频率和连锁不平衡也有差异,且AD的发病年龄、进展速度、认知功能下降速度,以及AD相关的差异(如代谢综合征、心血管疾病),需要在大样本和不同族群中进行检测和验证,因此对于汉族人群的大规模研究尚需要我国科学家继续为之努力。
目前全基因组测序和NGS已经确定了基因对应的特定共同通路,特别是炎症和免疫反应、脂质代谢和突触功能。而正在进行的全外显子测序(Whole Exome Sequencing, WES)及其功能性实验有望确定更多尚未发现的AD易感位点和功能变异,有望揭示功能性变异体的本质(功能的获得或丧失)和在特定功能域、剪接位点或调控区的位置。这种基因位点和通路分析会形成更完整的定位,不仅有助于阐明机制,更有助于制定更有针对性的AD治疗措施。
虽然我国的研究目前仍处于初级阶段,但可以预见随着基础研究、政府支持和公众意识的增强,未来几年我国将会在该方面取得长足的进展。

