硫化物生物抑制剂体系筛选及应用*
邓舒元,王 博,孙珊珊,白拉贝,佘跃惠,张 凡
(1.中国地质大学(北京)能源学院,北京 100083;2.长江大学石油工程学院,湖北武汉 430100)
0 前言
在油田生产过程中,伴随着大量硫化物的产生。然而硫化物的危害极大,不仅可以腐蚀金属设备,还可以对油田生产和现场施工人员的安全造成很大的影响,油田中硫化物含量增加的主要原因是硫酸盐还原菌(SRB)利用水中的硫酸根离子还原成了H2S。SRB是一类形态各异、营养类型多样、在厌氧或微氧环境中以硫酸盐或者其他氧化态硫化物作为电子受体来氧化有机物质,并产生硫化氢(H2S)的革兰氏阳性或阴性细菌或古菌[1]。在1926年,SRB首次从油藏中分离出来[2],硫酸盐还原被广泛认为是油藏本源微生物进行的主要代谢过程之一[3]。在原油开发开采过程中发生的厌氧腐蚀中,SRB是最具破坏性的微生物,造成石油行业巨大的经济损失[4-5]。在二次采油过程中,注入水中所含的硫酸盐会增加储层或地面设施中SRB的活性,SRB产H2S现象变得更加普遍和严重[5]。
生物竞争法是通过激活硝酸盐还原菌(NRB)来抑制SRB 的活性,从而控制H2S 的产生[6-7],相比其他方法,这种方法更具优势,因而越来越受到人们的关注。一方面,硝酸盐成本低,毒性小且可以迅速扩散到储层中[5,8-9];另一方面,激活的NRB 菌群有利于提高原油采收率[10]。NRB 通过竞争SRB的电子供体[11],使硫化物被化学自养型细菌如硫杆菌(Thiobacillus)或硫微螺菌(Thiomicrospira)氧化,这些微生物将硝酸盐作为电子受体[12-13],因而SRB的活性被硝酸盐还原的中间产物亚硝酸盐和三价氮抑制[14]。NRB 和SRB 之间争夺电子供体的竞争机制是通过硝酸盐来控制H2S产生,因为NRB在基质利用和能量消耗上优先于SRB。大多数NRB 为兼性厌氧细菌,在无氧条件下将硝酸盐作为电子受体并还原为N2。NRB 的激活能从减少数量和降低活性两个方面同时对SRB进行抑制,减少硫化物的产生15]。
在实验室中模拟地层中的温度和厌氧环境,以吐哈油田丘陵站污水为研究对象富集培养,分别加入不同浓度的生物抑制剂体系,根据SO42-消耗量优选最优体系。将最优的生物剂体系用于矿场试验,监测不同阶段的SRB、NRB、硫化物和悬浮物含量。通过分析加生物抑制剂前后微生物菌群的变化,得出生物抑制剂抑制油田污水中硫化物的机理。
1 实验部分
1.1 材料与仪器
氯化钠、氯化镁、氯化钙、氯化铵、磷酸氢二钾、氯化钾、硫酸钠、乳酸钠、硝酸钠、胺类化学药剂、咪唑类化学药剂、次氮基三乙酸、六水合氯化铁、四水合氯化锰、六水合氯化钴、二水合氯化钙、氯化锌、二水合氯化铜、硼酸、二水合钼酸钠、六水合氯化镍、生物素、叶酸、盐酸吡哆醇、二水盐酸硫胺、核黄素、烟酸、D-泛酸钙、维生素B12、对氨基苯甲酸、硫辛酸,分析纯,国药集团化学试剂有限公司;刃天青,上海如吉生物科技发展有限公司;酵母粉,武汉生物科技有限公司;土壤DNA 提取试剂盒,Qbiogen Carlsbad CA,USA。
厌氧培养瓶,海门市华凯实验器材有限公司;SRB-HX-7 细菌测试瓶,北京华兴化学试剂厂;LS-B50L 型立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司;pHs-2F型pH计,上海仪电科学仪器股份有限公司;VS-840K-U 型洁净工作台,苏净集团安泰公司;DYY-bc 型电泳仪,北京市六一仪器厂;EDC-810型PCR扩增仪,示胜创新生物科技有限公司;凝胶成像分析仪,美国新英格兰生物技术公司。
1.2 实验方法
1.2.1 生物抑制剂优选实验
配制SRB、NRB,SRB 和NRB 混合培养基各1 L,在SRB 和混合培养基组中加入铁钉作除氧灭菌处理,分装到250 mL 厌氧瓶中,接入100 mL 培养基,接入5%的丘陵水样在37 ℃下进行硫酸盐还原菌、硝酸盐还原菌以及混合菌培养,培养4 d后观察培养基颜色的变化及有无沉淀的产生,在SRB 和NRB 混合培养基中加入0.3%的硝酸钠再培养4 d,观察培养基的颜色变化,并测定SRB、NRB 和硫化物的数量,每个样做两组平行实验。
优选最佳的生物抑制剂浓度:首先在实验室中评价只加JHB对油田污水中硫化物抑制的效果,配制1 号富集培养基,接入5%的丘陵污水,向培养基中分别加入0、50、100、150和200 mg/L JHB,根据不同时间段硫酸盐的转化率优选最佳JHB浓度。
优选最优的生物抑制剂体系:配制1 号富集培养基,接入5%的丘陵污水,加入最优浓度的JHB,再分别加入40、80、160 和240 mg/L 硝酸钠,根据硫酸盐浓度确定最优的硝酸钠浓度。最优生物抑制剂体系为最佳的JHB 浓度和硝酸钠浓度时的复配体系。
SRB富集培养基:在1 L的去离子水中加入5 g氯化钠、1.8 g 氯化镁、0.02 g 氯化钙、0.3 g 氯化铵、0.2 g磷酸氢二钾、0.5 g氯化钾、4 g硫酸钠、1 g乳酸钠、1 g酵母粉、1 mL微量元素、1mL 0.1%刃天青和2 mL复合维生素溶液而得。
NRB富集培养基:在1 L的去离子水中加入5 g氯化钠、1.8 g 氯化镁、0.02 g 氯化钙、0.3 g 氯化铵、0.2 g磷酸氢二钾、0.5 g氯化钾、3 g硝酸钠、1 g乳酸钠、1 g酵母粉,1 mL微量元素、1 mL 0.1%刃天青和2 mL复合维生素溶液而得。
NRB、SRB混合培养基:在1 L的去离子水中加入5 g氯化钠、1.8 g氯化镁、0.02 g氯化钙、0.3 g氯化铵、0.2 g 磷酸氢二钾、0.5 g 氯化钾、4 g 硫酸铵、3 g硝酸钠、1 g 乳酸钠、1 g 酵母提取物、1 mL 微量元素、1 mL 0.1%刃天青和2 mL复合维生素溶液而得。
1 号富集培养基:在1 L 的去离子水中加入5 g氯化钠、1.8 g 氯化镁、0.02 g 氯化钙、0.3 g 氯化铵、0.2 g 磷酸氢二钾、0.5 g 氯化钾、1.5 g 硫酸钠、1 g 乳酸钠、1 g酵母粉、1 mL微量元素、1 mL 0.1%刃天青和2 mL复合维生素溶液而得。
微量元素溶液:在1 L去离子水中加入3 g次氮基三乙酸、1.35 g 六水合氯化铁、0.1 g 四水合氯化锰、0.024 g六水合氯化钴、0.1 g二水合氯化钙、0.1 g氯化锌、0.025 g 二水合氯化铜、0.01 g 硼酸、0.024 g二水合钼酸钠、0.12 g六水合氯化镍而得。
维生素溶液:在1 L 去离子水中加入2 mg 生物素、2 mg 叶酸、10 mg 盐酸吡哆醇、5 g 二水盐酸硫胺、5 mg 核黄素、5 mg 烟酸、5 mg D-泛酸钙、0.1 mg 维生素B12、5 mg 对氨基苯甲酸、5 mg 硫辛酸而得。
1.2.2 NRB、SRB菌数和硫化物和悬浮物含量的测定
采用SRB-HX-7 细菌测试瓶(北京华兴化学试剂厂),使用绝迹稀释法(MPN法)测定水样中SRB、NRB 菌数。计数培养基由在1 L 去离子水中加入5 g氯化钠、1.8 g氯化镁、0.02 g氯化钙、0.3 g氯化铵、0.2 g K2HPO4、0.5 g氯化钾、3 g硝酸钠、1 g乳酸钠和1 g 酵母粉所得。采用GC-SSD 方法测定水样中的硫化物含量。根据中国石油天然气行业标准SY/T 5329—94《碎屑岩油藏注水水质推荐指标及分析方法》,测定水样中悬浮物含量。
1.2.3 生物抑制剂现场应用评价
将最优的生物抑制剂体系注入现场水中,并连续取样7 d,测定NRB 菌数、SRB 菌数、pH 值、硫化物含量和悬浮物含量,根据水质排放指标评价生物抑制剂的效果。
1.2.4 微生物菌群变化分析
DNA提取和PCR扩增:将加入生物抑制剂前后的污水样品以12000 r/min 的转速离心8 min 后收集样品中的细胞,通过土壤DNA 提取试剂盒提取样品中的DNA,PCR 扩增选用引物对27F(5'-AGAGTTTGATCCTGGCTCAG-3')和 533R(05'TTACCGCGGCTGCTGGCAC-3')扩增细菌16S rRNA基因V1-V3区。
克隆验证PCR 扩增:将扩增产物PCR 用1.0%的琼脂糖凝胶电泳进行电泳分离,通过天根DNA凝胶回收试剂盒进行纯化。根据载体说明书将割胶回收后的16Sr DNA 片段与T-easy-T3 vector(全式金,北京)进行连接。挑取少量菌体作为模板,进行克隆验证PCR 扩增,所用的引物为T7(5'-ggCCgCgggAATTCgATT-3')和 SP6(5'-gCgAATTCACTAgTgATT-3')。
微生物菌群的鉴定:根据克隆文库中的OTU种类和每个OTU 的克隆数目,计算克隆文库的库容值,通过Analytic Rarefaction 1.3(http://www.uga.edu/strata/software/Software.htmL)软件作Rarefaction 曲线。从每个OUT 种类中挑一个代表克隆进行测序(由北京美吉测序公司测序)。通过DNAMAN version 5.2.2.0 软件对序列进行处理,处理后的序列在GenBank(http://www.ncbi.nlm.nih.gov/BLAST/)数据库中进行BLAST比对分析,寻找最相似的已知序列及最相似的已知分类地位的序列从而鉴定微生物群落的组成。
2 结果与讨论
2.1 丘陵站污水本源菌群的鉴定
根据分子克隆建库方法的测序结果分析吐哈油田丘陵站污水本源菌群如表1 所示,其中优势菌为嗜热脱硫微球菌(Desulfomicrobium thermophi⁃lum,占比43.34%)、硝基还原钙二铁弧菌(Calditerri⁃vibrio nitroreducens,占比21.11%)、未培养拟杆菌(Uncultured Bacteroidetes bacterium,占比8.89%)和产琥珀酸油杆菌(Petrobacter succinatimandens占比为7.78%)。
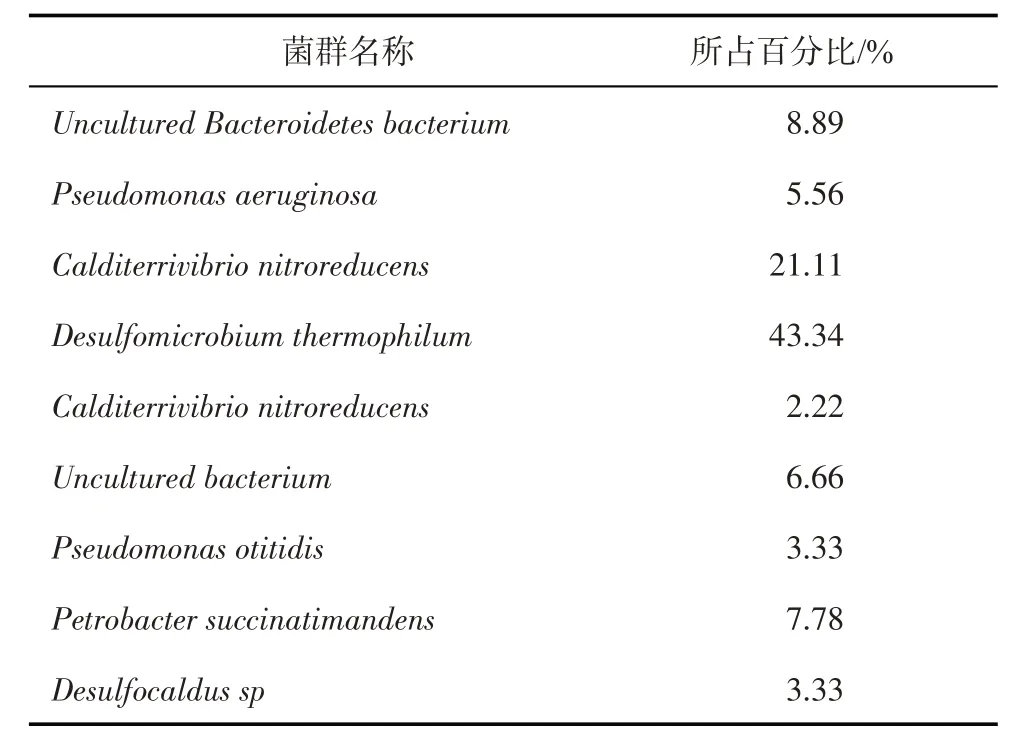
表1 吐哈油田丘陵站污水本源微生物群落组成
丘陵污水站污水中SRB菌群占绝对优势,主要为嗜热脱硫微球菌(Desulfomicrobium thermophi⁃lum),该菌为中等嗜热SRB,能利用广泛的电子供体,如H2、乳酸、丙酮酸、乙醇、苹果酸、富马酸酯、正丙醇等,在硫酸盐存在的环境下进行硫酸盐还原的代谢活动[16]。另一方面,丘陵污水站污水中有一定量的NRB菌群,其中硝基还原钙二铁弧菌(Calditer⁃rivibrio nitroreducens)为中等嗜热NRB,能利用乙酸盐、丙酮酸、乳酸、富马酸、琥珀酸、苹果酸、酵母提取物和酪蛋白氨基酸作为电子供体,硝酸盐是唯一的电子受体[17]。产琥珀酸油杆菌(Petrobacter succi⁃natimandens)也为中等嗜热NRB,在氧气存在下可以富马酸盐、丙酮酸盐、琥珀酸盐、甲酸盐、乙醇和酵母提取物或硝酸盐为末端电子受体,将硝酸盐还原为一氧化二氮[18]。丘陵站污水中表现高的SRB菌群数量以及活性,是造成该油田硫化氢含量高的主要因素。同时丘陵站污水中存在一定数量的NRB,使得丘陵站污水运用生物竞争法抑制SRB可行。
2.2 硫化物生物抑制剂体系的筛选
丘陵站污水呈棕黑色,SRB 数量为104个/mL,NRB 数量为102个/mL,硫酸根离子浓度为150 mg/L,硝酸根离子浓度为3~18 mg/L,碳酸根离子浓度为2~30 mg/L,低分子有机酸总浓度为12 mg/L,丘陵站污水能为NRB 和SRB 的生长提供基本的营养供应。
SRB、NRB、NRB 和SRB 混合培养基培养4 d后,SRB组出现黑色沉淀,且SRB细菌数达到104个/mL 以上。混合培养组的培养液中也有黑色沉淀,且硫化物浓度达到150 mg/L。在混合培养组中再添加0.3%NaNO3,培养4 d后黑色沉淀无明显变化,说明SRB占绝对优势,硫化物浓度为65 mg/L,因此还需要加入一定的抑制剂来抑制SRB。目前有报道指出将硝酸盐与其它抑制剂复配能快速有效抑制硫化物的产生[19]。Hitzman 等已经报道了硝酸盐、亚硝酸盐和钼酸盐在SRB 中的协同抑制作用[20]。Reinsel 等在装有油田污水的填砂模拟柱中连续添加亚硝酸盐,使亚硝酸盐浓度保持在0.71~0.86mmol/L之间,完全抑制了H2S的产生[14]。Nemati等通过研究发现,初期时添加0.1 mmol/L亚硝酸盐或0.024 mmol/L 钼酸盐可以阻止SRB(Lac6)菌株产生H2S,随着SRB的快速增长,为了抑制H2S的产生,需要使用0.25 mmol/L的亚硝酸盐或0.095 mmol/L的钼酸盐抑制[19]。
JHB 为胺类和咪唑类化学药剂的复配体系,可以和硝酸盐协同抑制油藏中的硫化物。本文主要为了探究生物抑制剂JHB 和硝酸盐对SRB 的协同生物竞争抑制效果,通过测定浓度变化,确定具有最佳抑制效果的JHB/硝酸钠体系。基于经济、环保、抑制机理的综合因素考虑,虽然JHB 有一定的抑制效果,但是在实际应用中单独使用JHB会使腐蚀微生物的耐药性增强,要不定期加大JHB注入浓度。SRB主要是利用硫酸根离子还原H2S引起油田腐蚀的,加入JHB后,前12 h每隔4 h测一次溶液中硫酸根离子的含量,12 h 后每隔12 h 测一次硫酸根离子的含量。根据各个时间段硫酸根离子的含量算出转化率,即(150 mg/L-不同时间段硫酸根离子浓度)/150 mg/L,硫酸根离子转化率越低,JHB抑制效果越好。在不同浓度JHB抑制作用下,硫酸盐的转化率随培养时间的变化见表2。与空白实验相比,加入抑制剂JHB后,SRB的活性得到明显抑制,考虑经济因素,JHB 和硝酸钠协同抑制时的最佳JHB加量确定为80 mg/L。

表2 不同JHB浓度下硫酸盐转化率随培养时间的变化
JHB和硝酸盐对SRB活性具有协同抑制作用,尽管抑制机理尚不清楚,但同时加入JHB和硝酸钠要比单独加入JHB或者硝酸盐的抑制效果好[6]。固定JHB 浓度为80 mg/L,不同NaNO3浓度(分别为40、80、160 和240 mg/L)下浓度随培养时间的变化见图1。
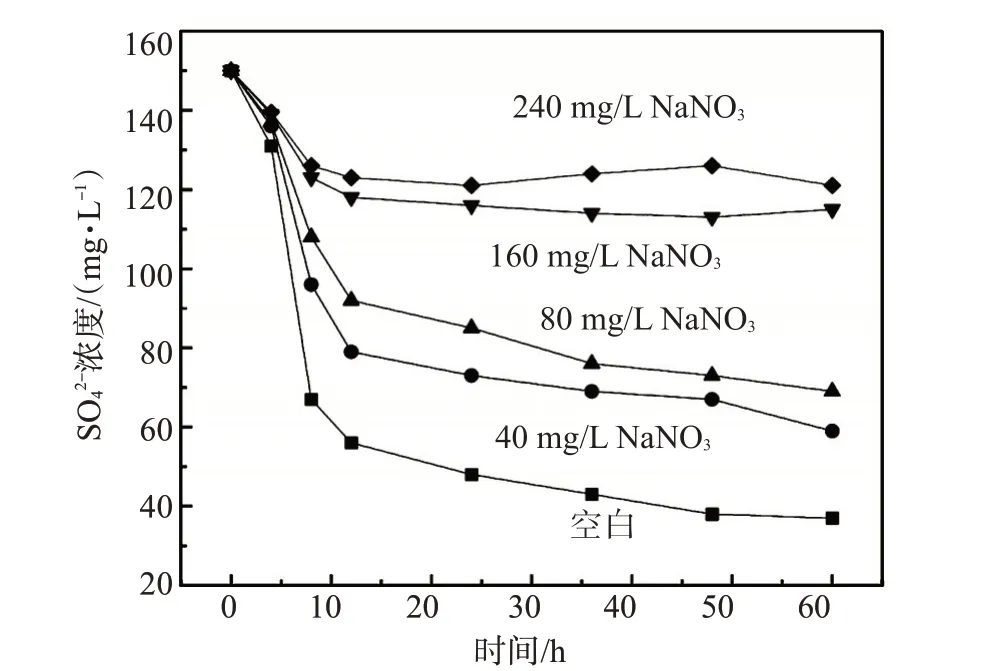
图1 固定JHB浓度80 mg/L,不同硝酸钠浓度下浓度随培养时间的变化
2.3 现场应用效果
在现场应用最优的生物抑制剂体系(JHB 60 mg/L+硝酸钠200 mg/L),并连续取样7 d 测定处理前后悬浮物含量、NRB 菌数、SRB 菌数、pH 值和硫化物含量,结果见表3。结果表明,矿场试验过程中NRB 被有效激活,菌数最高达到106个/mL 以上,SRB菌数低于102个/mL,硫化物含量抑制在1 mg/L以下,满足水质排放指标要求(SRB低于102个/mL,硫化物含量低于3 mg/L)。本次试验证实在矿场条件下硫化物生物抑制剂体系能有效抑制油田污水中硫化物的产生。

表3 矿场试验阶段水质主要指标检测结果
2.4 现场应用微生物抑制剂后的微生物菌群变化
将生物抑制剂用于丘陵占污水抑制硫化物现场试验后,污水中微生物群落组成见表4。其中,优势菌为假单胞菌(Pseudomonas balearica,占比46.68%)和施氏假单胞菌(Pseudomonas stutzeri,占比38.89%)。假单胞菌(Pseudomonas balearica)和施氏假单胞菌(Pseudomonas stutzeri)均为反硝化菌[19-22],他们主要以废水中的易生化有机物为电子供体和能量来源,在无氧或低氧条件下进行反硝化作用,将废水中的含氮污染物(NO3-和NO2—)还原成气态氮(主要为N2,并伴有少量的NO 和N2O)[22]。现场应用生物抑制剂后的微生物优势菌群由嗜热脱硫微球菌(Desulfomicrobium thermophilum)转变为假单胞菌(Pseudomonas balearica)和施氏假单胞菌(Pseudo⁃monas stutzeri)。

表4 现场应用微生物抑制剂后的微生物群落组成
3 结论
经过实验室富集培养筛选出最优的生物抑制剂体系为:40~80 mg/L JHB+160~240 mg/L 硝酸钠。在现场试验中运用60 mg/L JHB+200 mg/L 硝酸钠的生物抑制剂体系处理污水后,SRB菌数低于102个/mL,硫化物含量低于1 mg/L,悬浮物含量降至30 mg/L 以下,达到水质排放的要求。加生物抑制体系后微生物优势菌群由SRB-嗜热脱硫微球菌(Desulfomicrobium thermophilum,占比43.34%)转变为假单胞菌(Pseudomonas balearica,占比46.68%)和施氏假单胞菌(Pseudomonas stutzeri,占比38.89%)。硫化物生物抑制剂体系通过抑制SRB 的活性来抑制丘陵站污水中硫化物产生,为抑制油田中硫化物的产生提供了一种可行性的方法。。

