重组人脑钠肽对高糖诱导下内皮细胞的作用*
金启辉, 夏江柳, 鲁闻燕, 有传刚, 韩春茂△
(浙江大学医学院附属第二医院1老年病科,2烧伤与创面修复科,浙江杭州 310009)
高血糖引起的血管内皮细胞受损是糖尿病血管病变主要发病机制之一。内皮细胞凋亡是内皮细胞功能障碍的重要表现形式,同时也是动脉粥样硬化形成的始动因素[1]。自噬对于维持细胞稳态具有重要生理意义,通常情况下细胞在遭受损伤时,通过自噬,降解受损的蛋白质和(或)细胞器,促进细胞存活[2]。糖尿病导致血管内皮细胞损伤以及动脉粥样硬化形成涉及分子机制众多,治疗困难,使得研究糖尿病机体内环境的变化对血管病变的作用显得更有意义。有临床研究发现,脑钠肽(brain natriuretic peptide,BNP)与糖尿病密切相关,BNP 在糖尿病患者中明显升高,甚至在糖尿病前期就有升高[3]。Pauriah 等[4]的研究发现BNP 与血管内皮舒张功能密切相关,是内皮功能的独立预测因子。BNP 是心肌细胞合成的具有生物学活性的激素。以往研究均把BNP 与心力衰竭联系在一起,临床也把BNP 静脉输注改善心力衰竭写进指南。BNP 对心肌细胞保护作用已得到广泛研究和认可,实验证明BNP 预处理能保护心肌细胞缺血再灌注损伤[5],能减少缺氧心肌细胞凋亡[6],内源性或外源性BNP 能通过与特异性利尿钠肽受体A(natriuretic peptide receptor-A,NPRA)结合,该受体与鸟苷酸环化酶偶联,引起细胞内cGMP 浓度升高,作为第二信使活化cGMP 依赖的蛋白激酶,发挥心肌保护作用。笔者前期临床研究也发现,糖尿病合并下肢血管病变患者的BNP 水平明显升高[7]。但BNP 对高糖环境下血管内皮细胞的效应及作用机制究竟如何,糖尿病患者代偿性升高的BNP 对血管是否有保护作用,未见基础研究报道。本研究以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为实验对象,建立高糖诱导的HUVECs 模型,观察高糖对HUVECs 凋亡和自噬的影响;接着使用重组人BNP(recombinant human BNP,rhBNP)干预高糖诱导的HUVECs,观察rhBNP对HUVECs 凋亡和自噬功能的影响,并探讨其可能的机制。
材 料 和 方 法
1 细胞株和主要试剂
原代HUVECs 购自Clonetics。胎牛血清(fetal bovine serum,FBS)和低糖DMEM 培养基(杭州吉诺生物医药);葡萄糖粉(G7021-110G)和Western blot实验相关试剂(Sigma);抗beclin-1 抗体(Abacm);抗Bax、Bcl-2、cleaved caspase-3、AKT、p-AKT、ERK、p-ERK、微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)-I 和LC3-II 抗体,ERK 通路抑制剂U-0126,以及3-甲基腺嘌呤(3-methyladenine,3-MA)均购自CST;冻干rhBNP(商品名新活素,中国成都诺迪康生物制药有限公司)。
2 方法
2.1 HUVECs的培养及处理 将含有HUVECs的冻存管从液氮罐中取出,置于37 ℃水浴锅中,使得冻存液快速融化。将细胞悬液转移至细胞培养瓶中,用含5%胎牛血清的DMEM 培养基在37.0 ℃、饱和湿度、5% CO2的培养箱中常规培养。以无菌PBS 洗涤细胞后,加入0.25%的胰酶(含EDTA)消化传代,用ECM 培养基重悬,调整细胞密度至5×107L-1,接种于培养板中,充分贴壁后,去血清预处理12 h 后,用于实验。处理稳定后加入不同浓度葡萄糖处理细胞24 h,分为4 组:培养液含葡萄糖分别为11.1、33.3和50 mmol/L 的高糖处理组;不做任何处理的细胞(培养液含葡萄糖5.5 mmol/L)作为对照组。
2.2 rhBNP 浓度的确定 用不同浓度(0.1、1 和10 mg/L)rhBNP 和33.3 mmol/L 葡萄糖孵育HUVECs 24 h,以5.5 mmol/L 葡萄糖作为对照组,评估自噬蛋白表达的改变,确定后续实验中rhBNP的浓度。
2.3 实验分组 按给予不同干预因素分为以下实验组:(1)对照组:5.5 mmol/L 葡萄糖;(2)高糖组:33.3 mmol/L 葡 萄 糖;(3)高 糖+rhBNP 组:1 mg/L rhBNP+33.3 mmol/L 葡萄糖共孵育24 h;(4)高糖+rhBNP+3-MA 组:1 mg/L rhBNP 和3-MA 共同预处理6 h 后,与33.3 mmol/L 葡萄糖共孵育24 h;(5)高糖+rhBNP+U-0126组:1 mg/L rhBNP 和10 μmol/L U-0126共同预处理6 h 后,与33.3 mmol/L 葡萄糖共孵育24 h。
2.4 CCK-8 法检测细胞活力 将HUVECs 按照每孔1×104的密度接种于96孔板,按照细胞分组进行干预后,每孔加入10 μL 的CCK-8 试剂,培养箱继续孵育2 h,酶标仪检测450 nm波长处各孔的吸光度(A),按公式换算为细胞相对活力。细胞相对活力(%)=处理组A值/正常对照组A值×100%。
2.5 流式细胞术检测细胞凋亡 用不含EDTA的胰酶消化各组细胞,收集各组细胞至离心管中,2 000 r/min 离心5 min 后弃上清,然后用预冷的PBS洗涤,2 000 r/min 离心5 min 各2 次。加入500 μL 的结合缓冲液悬浮细胞,每组细胞中加入5 μL 的annexin V-FITC 混匀,再加入5 μL 的PI 混匀,室温下避光反应10~15 min,上样流式细胞仪检测。
2.6 细胞划痕试验 细胞种于48孔板,24 h后细胞培养至80%融合度时,以200 μL 移液器吸头在培养皿中央垂直划线,用PBS 清洗2 次,加入无血清的DMEM 培养液,处理稳定后加入不同浓度葡萄糖,在划痕处拍照作为初始对照。其中高糖处理组加入不同浓度rhBNP,继续孵育24 h,于显微镜下拍照,采用Image-Pro Plus 6.0 软件测量划痕的距离,细胞迁移率(%)=(原划痕宽度-现划痕宽度)/原划痕宽度×100%。
2.7 Western blot检测蛋白表达 收集各组细胞,分别加入120 μL细胞裂解液,置于冰上裂解10 min,收集细胞悬液于4 ℃、12 000 r/min 离心30 min,取上清。BCA 工作法进行蛋白定量,以40 μg总蛋白上样然后进行SDS-PAGE,电泳完成后将蛋白转移至PVDF 膜上,以含5%脱脂奶粉的TBST 封闭90 min。分别将各种不同抗体用Ⅰ抗稀释液按照说明书上的比例稀释后与PVDF 膜置于4 ℃摇床孵育过夜,次日用TBST 洗膜3 遍后再与Ⅱ抗(1∶4 000)室温孵育60 min,TBST 洗膜3 遍,ECL 发光成像,β-actin 作为内参照,用Image Lab 图像分析软件对样本每一个条带的灰度值进行半定量分析。
3 统计学处理
采用GraphPad Prism 8 软件进行统计分析。满足正态分布的计量资料以均数±标准差(mean±SD)表示。各组间比较采用单因素方差分析(one-way ANOVA),并行Bonferroni 事后检验对多组数据进行组间两两比较。以P<0.05为差异有统计学意义。
结 果
1 高糖对脐静脉内皮细胞活力、凋亡和自噬的影响
HUVECs 予不同浓度(11.1、33.3 和50 mmol/L)的高糖干预24 h,以5.5 mmol/L 葡萄糖做为正常对照组(细胞活力100%),则高糖3 组的细胞活力依次为81.17%、59.61%和46.13%,表明随着葡萄糖浓度的升高,细胞活力下降;11.1 mmol/L 组与正常对照组比较,差异无统计学显著性,葡萄糖浓度在33.3和50.0 mmol/L 时HUEVCs 的细胞活力显著下降(P<0.01),见图1。
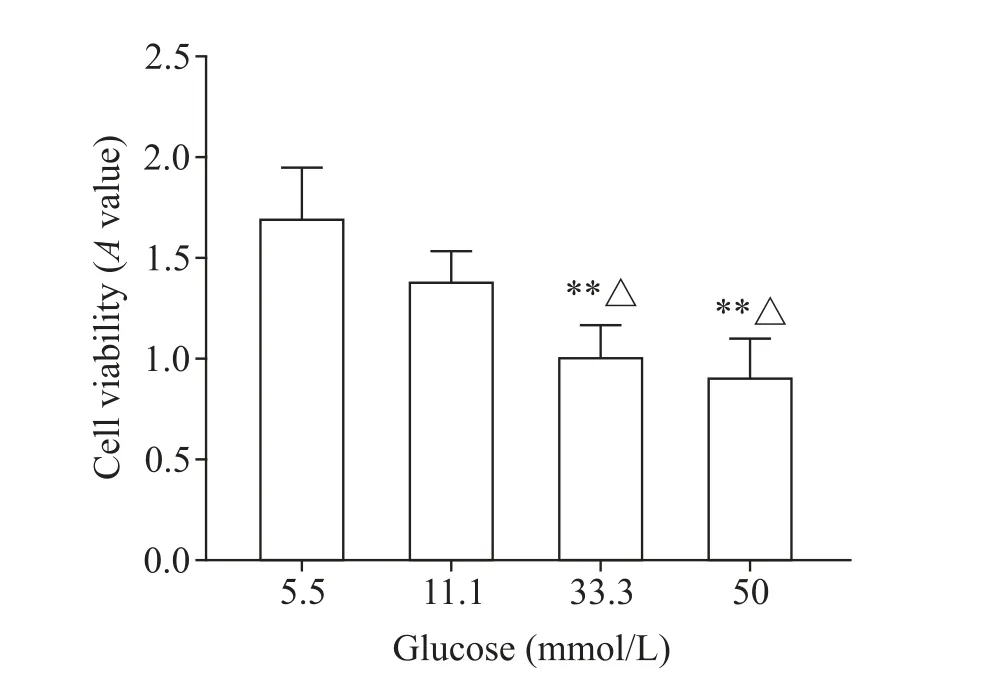
Figure 1. The effects of glucose at different concentrations on the viability of HUVECs. Mean±SD. n=3. **P<0.01 vs 5.5 mmol/L glucose group;△P<0.05 vs 11.1 mmol/L glucose group.图1 不同浓度葡萄糖对HUVECs活力的影响
以annexin V-FITC/PI 双染法及流式细胞术检测细胞凋亡,结果显示,5.5 mmol/L 葡萄糖组HUVECs的凋亡率为8.6%,11.1 mmol/L 组为17.4%,33.3 mmol/L 组为37.6%,50 mmol/L 组为42.1%,随着葡萄糖浓度升高,HUVECs 凋亡率亦逐渐升高(P<0.05或P<0.01),见图2。
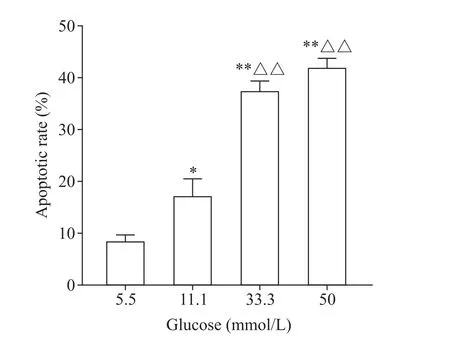
Figure 2. The effects of glucose at different concentrations on the apoptosis of HUVECs. Mean±SD. n=3.*P<0.05,**P<0.01 vs 5.5 mmol/L glucose group;△△P<0.01 vs 11.1 mmol/L glucose group.图2 不同浓度葡萄糖对HUVECs凋亡的影响
随着葡萄糖浓度的升高,凋亡相关蛋白Bax/Bcl-2 比值和cleaved caspase-3 蛋白水平显著升高(P<0.05或P<0.01),见图3。
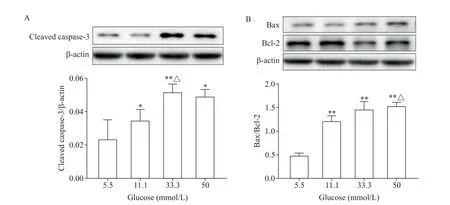
Figure 3. The effects of glucose at different concentrations on the protein levels of apoptosis-related molecules in HUVECs. The protein levels of cleaved caspase-3(A),Bax and Bcl-2(B)in the HUVECs exposed to different concentrations of glucose were measured by Western blot. Mean±SD. n=3. *P<0.05,**P<0.01 vs 5.5 mmol/L glucose group;△P<0.05 vs 11.1 mmol/L glucose group.图3 不同浓度葡萄糖对HUVECs凋亡相关蛋白表达的影响
随着葡萄糖浓度的升高,自噬蛋白beclin-1 水平和LC3-II/LC3-I比值均呈下降趋势,在葡糖糖浓度为11.1 mmol/L 时自噬蛋白下降不明显(P>0.05),而在33.3 和50 mmol/L 时 下 降 最 明 显(P<0.05 或P<0.01);在葡糖糖浓度为33.3 mmol/L 时,与11.1 mmol/L相比,beclin-1和LC3-II/LC3-I也显著下降(P<0.05),见图4。
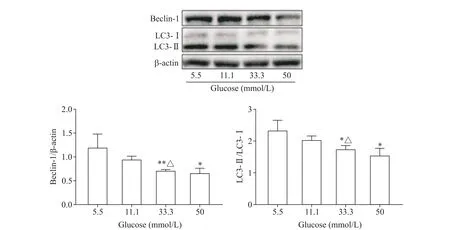
Figure 4. The effects of glucose at different concentrations on the protein levels of autophagy-related molecules in HUVECs. Mean±SD. n=3. *P<0.05,**P<0.01 vs 5.5 mmol/L glucose group;△P<0.05 vs 11.1 mmol/L glucose group.图4 不同浓度葡萄糖对HUVECs自噬相关蛋白表达的影响
2 不同浓度葡萄糖的干预对HUVECs 自噬相关信号通路的影响
不同浓度的葡萄糖与HUVECs 共孵育24 h,结果显示,ERK 磷酸化水平在葡萄糖浓度为33.3 和50 mmol/L 时 与5.5 mmol/L 组相比均显著下降(P<0.01),与11.1 mmol/L 组相比的差异亦有统计学意义(P<0.05 或P<0.01),见图5A;而AKT 磷酸化水平在不同浓度葡萄糖作用下的变化均不显著(P>0.05),见图5B。
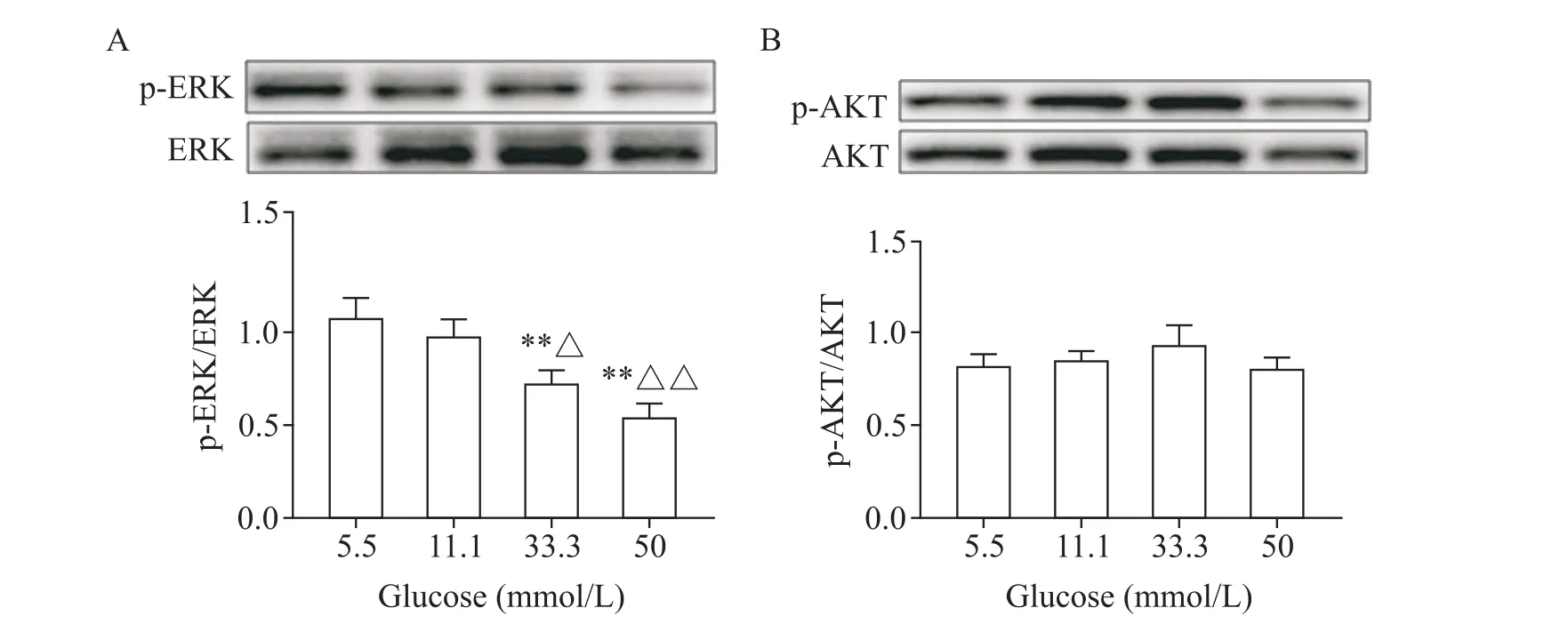
Figure 5. The effects of glucose at different concentrations on the protein levels of ERK(A)and AKT(B)were measured by Western blot. Mean±SD. n=3. **P<0.01 vs 5.5 mmol/L glucose group;△P<0.05,△△P<0.01 vs 11.1 mmol/L glucose group.图5 不同浓度葡萄糖对HUVECs的ERK和AKT蛋白水平的影响
3 不同浓度rhBNP 对高糖诱导下HUVECs 活力和迁移能力的影响
为确定rhBNP 对高糖诱导下HUVECs 生长的影响,我们用33.3 mmol/L 的葡萄糖联合不同浓度的rhBNP 处理HUVECs。结果显示,与高糖组相比,0.1和10 mg/L 的rhBNP 对HUVECs 活力影响的差异无统计学显著性(P>0.05),而1 mg/L 的rhBNP 可显著提高HUVECs 活力(P<0.01),说明rhBNP 在1 mg/L时具有一定的促进高糖诱导HUVECs 生长能力的作用,见图6。
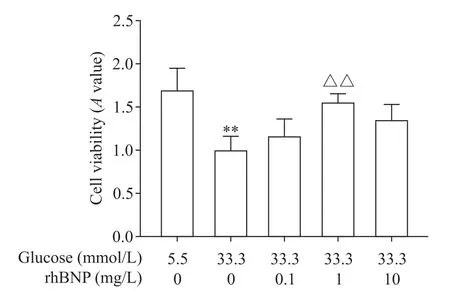
Figure 6. The effects of rhBNP at different concentrations on the viability of HUVECs induced by high glucose. Mean±SD. n=3.**P<0.01 vs 5.5 mmol/L glucose group;##P<0.01 vs 33.3 mmol/L glucose group.图6 不同浓度rhBNP对高糖诱导下HUVECs活力的影响
体外迁移实验结果显示,与高糖(33.3 mmol/L葡萄糖)组和高糖+0.1 mg/L rhBNP 组比较,1 和10 mg/L 的rhBNP 均能显著改善高糖诱导下HUVECs 的迁移能力(P<0.05或P<0.01),见图7。

Figure 7. The effects of rhBNP at different concentrations on the migration ability of HUVECs induced by high glucose. Mean±SD. n=3.*P<0.05 vs 5.5 mmol/L glucose group;##P<0.01 vs 33.3 mmol/L glucose group;△P<0.05 vs 33.3 mmol/L glucose+0.1 mg/L rhBNP group.图7 不同浓度rhBNP对高糖诱导下HUVECs迁移能力的影响
4 不同浓度rhBNP 对高糖诱导下HUVECs 凋亡蛋白水平的影响
以不同浓度的rhBNP 干预高糖(33.3 mmol/L 葡萄糖)诱导下的HUVECs,发现1 和10 mg/L 的rhBNP处理可显著降低高糖条件下cleaved caspase-3 蛋白水平(P<0.05),但0.1 mg/L rhBNP的作用不显著(P>0.05);不同浓度的rhBNP 处理后Bax/Bcl-2的比值均显著下降(P<0.05),但与正常5.5 mmol/L 葡萄糖组比较仍有一定的差异(P<0.05),而不同浓度rhBNP组间Bax/Bcl-2 比值的差异无统计学显著性(P>0.05),见图8。这提示rhBNP 具有抑制高糖环境下内皮细胞凋亡的作用,但不能使高糖浓度下的凋亡蛋白水平完全恢复正常。
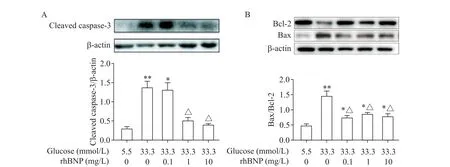
Figure 8. The effects of rhBNP at different concentrations on the protein levels of apoptosis-related molecules in HUVECs induced by high glucose. The protein levels of cleaved caspase-3(A),Bax and Bcl-2(B)in the HUVECs were measured by Western blot. Mean±SD. n=3. *P<0.05,**P<0.01 vs 5.5 mmol/L glucose group;△P<0.05 vs 33.3 mmol/L glucose group.图8 不同浓度rhBNP对高糖诱导下HUVECs凋亡蛋白水平的影响
5 rhBNP提高高糖诱导下HUVECs的自噬水平
以1 mg/L rhBNP干预高糖(33.3 mmol/L葡萄糖)诱导下的HUVECs,与33.3 mmol/L 葡萄糖组相比,LC3-II/LC3-I 比值和beclin-1 水平显著升高(P<0.05或P<0.01);加入自噬抑制剂3-MA 后自噬蛋白表达被抑制,用U-0126 抑制ERK 后,自噬蛋白略有提高,但差异无统计学显著性(P>0.05),说明抑制自噬和ERK 通路后rhBNP 无法发挥促进LC3-II/LC3-I 和beclin-1自噬蛋白表达的作用,见图9。这提示rhBNP能促进高糖诱导下HUVECs自噬蛋白的表达。
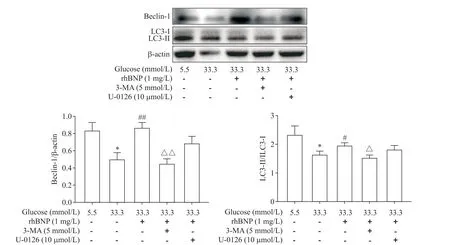
Figure 9. The effect of rhBNP on the expression of autophagy-related proteins beclin-1 and LC3 in the HUVECs induced by high glucose. Mean±SD. n=3.*P<0.05 vs 5.5 mmol/L glucose group;#P<0.05,##P<0.01 vs 33.3 mmol/L glucose group;△P<0.05,△△P<0.01 vs 33.3 mmol/L gulcose+1 mg/L rhBNP group.图9 rhBNP对高糖诱导下HUVECs自噬蛋白beclin-1和LC3表达的影响
6 rhBNP 对高糖诱导下HUVECs 中ERK 信号通路蛋白的影响
为进一步证实rhBNP 通过激活ERK 信号发挥作用,我们以1 mg/L 的rhBNP 干预高糖(33.3 mmol/L葡萄糖)诱导下的HUVECs,结果发现ERK 的磷酸化水平与高糖组相比显著升高(P<0.05),见图10。这说明rhBNP具有促进ERK磷酸化的作用。
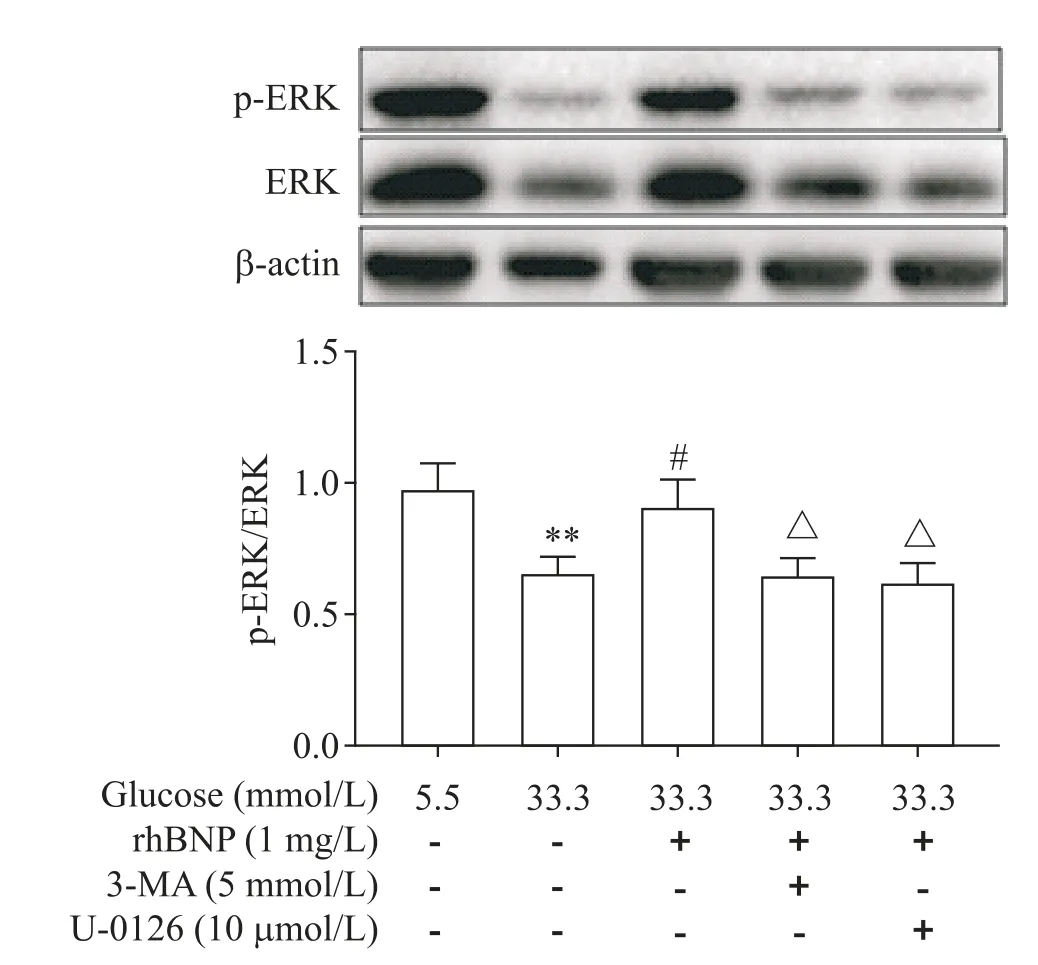
Figure 10. The effect of rhBNP on the protein levels of p-ERK in the HUVECs induced by high glucose. Mean±SD. n=3.**P<0.01 vs 5.5 mmol/L glucose group;#P<0.05 vs 33.3 mmol/L glucose group;△P<0.05 vs 33.3 mmol/L glucose+1 mg/L rhBNP group.图10 rhBNP 对高糖诱导下HUVECs 中p-ERK 蛋白水平的影响
讨 论
血管内皮损伤是血管病变的基础,糖尿病有多种因素可直接或间接导致内皮细胞受损。内皮细胞受损是动脉粥样硬化起始过程。血管内皮细胞凋亡会减弱血管内皮预防血脂沉积的屏障作用,局部的抗凝和纤溶机制也会改变,产生促凝作用,加速动脉粥样硬化的发生和血栓形成,这就是血管病变最危险和致命的改变[8]。葡萄糖可以促进内皮细胞凋亡和自噬来改变细胞功能状态。长期的高糖诱导血管内皮细胞凋亡、抑制自噬,造成内皮受损,在糖尿病血管并发症中发挥关键性作用[9]。本研究发现,随着葡萄糖浓度的升高,HUVECs 活力下降,33.3 mmol/L 葡萄糖孵育24 h即可使内皮细胞活力下降近一半,是正常血糖的59.55%,细胞凋亡率迅速从正常的2.3%增加到31.9%,50 mmol/L 时更明显,凋亡率为46.6%。Bax/Bcl-2 比值升高,并最终导致caspase-3也升高,说明高糖诱导对内皮细胞的损伤十分严重。与以往研究报道结果类似[10]。
自噬是一种细胞内的应激反应,在细胞的稳态、生长、发育和疾病发生中起着重要的作用,很多证据表明自噬通路是很多疾病潜在的靶向治疗通路,其中就包括糖尿病[11]。自噬作为细胞的保护性机制,调节内皮细胞的增殖和凋亡,在动脉硬化病变中具有重要作用[12]。研究表明,血管内皮细胞自噬具有抗凋亡及恢复内皮细胞功能的作用[13]。我们发现随着葡萄糖浓度的升高,HUVECs 自噬蛋白beclin-1 和LC3-II/LC3-I逐步下降,葡萄糖浓度越高越明显,说明高糖抑制内皮细胞自噬越明显,与以往研究结果一致[14]。持续应激促使血管内皮细胞的自噬作用被抑制,使得细胞走向死亡[15]。自噬作为一种保护机制被削弱,清除损伤细胞器和代谢产物能力下降,促进细胞凋亡。
BNP 是利尿钠肽家族中的一员。利尿钠肽家族主要包括心房钠尿肽(atrial natriuretic peptide,ANP)、BNP、C 型利尿钠肽(C-type natriuretic peptide,CNP)、肾利尿钠肽(renal natriuretic peptide,RNP)及树眼镜蛇属利尿钠肽(Dendroaspisnatriuretic peptide,DNP)。利尿钠肽系统在心肾调节中起重要作用,可抑制水钠潴留及血管收缩肽的产生和作用,还能促进血管舒张和抑制交感神经过度反应。BNP主要由心室肌细胞分泌,当心脏处于负荷状态时,心室肌细胞分泌BNP的量增加。外源性BNP能够通过提高内皮祖细胞的数量和功能而促进血管再生[16]。本研究以33.3 mmol/L 葡萄糖诱导的HUVECs 为研究对象,不同浓度的rhBNP 均可显著促进HUVECs活力,1 mg/L rhBNP 最明显。BNP 具有抗心肌细胞凋亡的作用:BNP 通过降低活性氧簇水平、改变线粒体渗透性而减少心肌细胞凋亡[17];BNP 预处理可以提高Bcl-2/Bax 比值,降低caspase-3 水平,减少心肌缺血再灌注坏死和凋亡[18]。此外,rhBNP 可以通过抑制氧化应激和改变线粒体膜电位,阻止ox-LDL 诱导的巨噬细胞凋亡[19];通过抑制MAPK 和NF-κB 通路活性,减轻脂多糖诱导人胎儿肺成纤维细胞损伤[20];还能通过抑制氧化应激、提高抗氧化酶、抑制NF-κB/MMP-9通路而缓解创伤失血性休克引起的急性肺损伤[21]。本研究发现,外源性rhBNP 能显著降低Bax/Bcl-2 比值和cleaved caspase-3 蛋白水平,说明外源性rhBNP具有显著的抗凋亡作用;rhBNP还能促进LC3-II/LC3-I 和beclin-1 蛋白表达,给予自噬抑制剂3-MA 后,rhBNP 促使自噬蛋白表达的作用明显被削弱。
自噬调控相关的信号通路中PI3K/Akt/mTOR 和MAPK/ERK/mTOR 信号通路被证明在自噬形成过程中扮演着最重要的角色。这2 条信号通路均参与细胞的增殖与分化、细胞形态维持、细胞骨架的构建、细胞凋亡等多种生物学反应,被认为是内皮细胞促生存的关键信号通路[22]。在高糖诱导的HUVECs 中我们发现随着葡萄糖浓度的升高,ERK 活性明显被抑制,而AKT 活性改变不明显,说明高糖抑制ERK 的磷酸化,降低其活性。进一步验证发现rhBNP干预后ERK通路被激活,予ERK抑制剂U-0126后,自噬蛋白LC3-II/LC3-I比值和beclin-1表达也下降,说明rhBNP促进自噬是通过ERK信号通路发生作用的。
综上所述,rhBNP 可减少高糖诱导下内皮细胞凋亡,促进内皮细胞增殖和迁移,其机制可能与激活ERK信号通路,促进自噬蛋白表达,减少caspase-3和Bax 凋亡蛋白表达有关。但rhBNP 具体的分子机制还有待进一步的研究。

