法尼醇受体通过下调miR-21水平抑制非小细胞肺癌细胞增殖及侵袭能力
王振华陈金亮邢媛媛郭喜喜李东飞
(1.新乡市中心医院胸瘤二科,河南 新乡 453000;2.南通市第一医院呼吸科,江苏 南通 226006)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要类型,死亡率高[1]。目前,NSCLC根治性切除术后5年的总生存率仍低于15%[2]。因此,有必要探索NSCLC的分子机制,寻找新的治疗靶点。法尼醇受体(Farnesoid X receptor,FXR)是核受体超家族的成员,能对管腔胆汁酸水平进行严格调控[3]。由于大约70%的胆汁酸被人体重新吸收,FXR可以在血浆中达到微摩尔浓度,这可能是许多其他组织中表达FXR的基础[4]。先前的研究显示,与癌周非肿瘤组织相比,人类结直肠癌组织中的FXR表达较低,并且FXR低表达与不良预后之间存在关联[5]。最近的研究报告了FXR可作为肿瘤抑制因子,在体内、体外激活可抑制多种细胞生长[4-5]。然而,其潜在机制并不完全清楚。MicroRNAs(miRNAs)是一种单链非编码RNA分子,其通过调节癌基因或抑癌基因在抑制或促进肿瘤生长中发挥关键作用[6]。研究发现,miR-21在几种恶性肿瘤中加速癌症进展,包括胃癌和结直肠癌[7]。此外,miR-21在肺癌中被观察到上调,并与肺癌侵袭能力增加有关[8]。先前的研究发现,FXR激动剂可以通过抑制miR-21改善非酒精性脂肪性肝炎小鼠的脂肪变性、炎症、氧化应激和胆固醇积累[9]。然而,关于FXR激动剂能否通过下调miR-21水平抑制NSCLC细胞增殖及侵袭能力尚不清楚。因此,本研究旨在观察FXR在NSCLC组织和细胞系中的表达水平,探讨FXR在NSCLC细胞增殖和侵袭中的作用是否与调控miR-21水平相关。
1 材料和方法
1.1 实验组织与细胞系
在2010年至2012年间,取本院手术切除的80例NSCLC组织及配对的正常组织。所用患者经病理证实为NSCLC。术前无局部或全身治疗。所有组织样本在液氮中新鲜冷冻,然后转移到-80℃保存,直到使用。所有患者至少持续随访60个月,并收集相关临床病理特征和生存统计数据。
人NSCLC系(A549、NCI-H1299、H460)和正常细胞系(16HBE)购自美国ATCC。细胞培养在含10%FBS、100 U/mL青霉素和100μg/mL链霉素的RPMI-1640培养基中(美国Invitrogen公司)。
1.2 主要试剂与仪器
抗人FXR的初级抗体购自武汉Proteintech公司;TRIpure试剂、Super M-MLV逆转录酶、2×Power Taq PCR MasterMix购自北京BioTeke公司;SYBR green、RIPA缓冲液购自北京Solarbio公司;GW3965(FXR激动剂)购自美国Sigma公司(批号:NP1524),细胞计数试剂盒-8购自日本Dojindo公司;PVDF膜购自美国Invitrogen公司;PVDF膜、lipofectamine 2000转染试剂购自美国Invitrogen公司;β-actin一抗购自英国Abcam公司;双荧光素酶报告系统购自美国Promega公司;miR-21过表达物或对照质粒pcDNA3.1和miR-21抑制剂或阴性对照siRNA均购自上海吉玛制药技术有限公司。
ExicyclerTM96荧光定量分析仪购自韩国Bioneer公司;BX51显微镜购自日本Olympus公司。
1.3 实验方法
1.3.1 肿瘤组织中FXR表达的免疫组化分析
手术标本(NSCLC组织及配对的正常组织)用10%福尔马林固定,石蜡包埋。将载玻片与抗人FXR的初级抗体在4℃下孵育过夜,后在25℃下与二级抗体孵育1 h。根据染色强度和阳性细胞百分率对每个切片进行评分。染色强度评分如下:0(阴性)、1(弱染色)、2(中度染色)、3(强染色)。阳性细胞百分率评分如下:0(0%)、1(0%~10%)、2(10%~50%)、3(50%~80%)、4(>80%)。IHC评分通过强度和百分率相乘得到。取FXR组织评分中位数作为低表达和高表达判断:<6,低表达;≥6,高表达。
1.3.2 qRT-PCR分析
使用TRIpure试剂从组织或培养的细胞中提取总RNA。使用Super M-MLV逆转录酶将总RNA逆转录为cDNA。使用2×Power Taq PCR MasterMix和SYBR green在ExicyclerTM96荧光定量分析仪上进行Quantitative Real-time PCR(qRT-PCR)。使用U6小核RNA(U6 snRNA)作为内源性对照。依据NCBI上登录的靶基因序列并通过primer 5.0引物设计软件设计特异性引物序列如下:miR-21,正向5’-GCGGCAGGGGGAAAGTTCTA-3’,反向5’-GTG CAGGGTCCGAGGTATTC-3’;U6,正向5’-TGGAGT TGATCCTAGTCTGG-3’,反向5’-GTGCAGGGTCCG AGGTATTC-3’。经过qRT-PCR后,使用2-△△CT方法计算目的基因的表达变化。
1.3.3 CCK-8法
将A549细胞(5×103)接种到96孔板中,分为:对照组和不同浓度的GW3965处理组。不同浓度的GW3965组加入不同浓度的GW3965(1~5μmol/L)或对照组加入相同体积的二甲基亚砜处理48 h。然后,使用细胞计数试剂盒-8检测细胞增殖情况。
1.3.4 细胞侵袭试验
使用Transwell方法进行细胞侵袭分析。将1.3.3项下经不同分组处理的A549细胞以每孔4×105的密度接种到24孔Transwell小室中,并在上室中加入200μL无FBS的培养基。使用500μL含30%胎牛血清培养基填充底部孔。培养24 h后,用70%乙醇处理和0.5%结晶紫染色。在BX51显微镜下量化侵袭细胞的数量。随机选择五个区域,并在每个区域中统计细胞数。
1.3.5 Western blot分析
用RIPA缓冲液裂解细胞提取总蛋白。通过BCA试剂盒评估蛋白质含量。采用10%SDS-PAGE电泳将蛋白质转移到PVDF膜上。将膜用5%脱脂牛奶封闭1 h,然后在4℃下用以下一抗封闭过夜:FXR(1∶1000)和β-actin(1∶1000)。将PVDF膜与二抗在室温下孵育1 h。使用蛋白质印迹检测化学发光试剂盒观察目标条带。
1.3.6 细胞转染
取A549细胞,以每孔5×104个细胞接种于24孔板。然后用lipofectamine 2000转染试剂,分别将miR-21过表达物(pcDNA-miR-21,50 nmol/L)或对照质粒pcDNA3.1(pcDNA)和miR-21抑制剂(si-miR-21,100 nmol/L)或阴性对照siRNA(si-NC)转染入细胞。转染24 h后,收集细胞并分为8组:pcDNA+DMSO组、pcDNA+GW3965组、pcDNA-miR-21+DMSO组、pcDNA-miR-21+GW3965组、si-NC+DMSO组、si-NC+GW3965组、si-miR-21+DMSO组、si-miR-21+GW3965组。将细胞用 5 μmol/L GW3965或DMSO处理0、24、48和72 h,收集细胞进行CCK-8法、Transwell法分析。
1.3.7 双荧光素酶报告分析
合成含有miR-21靶点的FXR野生型(WT)或突变型(MUT),然后克隆到pmir-GLO载体中。将1.5μg pmirGLO-FXR-WT或pmirGLO-FXR-MUT分别与pcDNA-miR-21和/或si-miR-21共转染A549细胞,孵育24 h后,用双荧光素酶报告系统测定荧光素酶活性。
1.4 统计学方法
使用SPSS软件17.0进行统计分析。结果表示为平均数±标准差(±s)。使用t检验或Mann-Whitney U检验评估组之间的差异。使用卡方检验、Fisher’s精确检验和Kaplan-Meier方法(对数秩检验)进行相关分析和生存数据分析。NSCLC组织中FXR与miR-21表达之间相关性采用Spearman相关分析。P<0.05具有统计学意义。
2 结果
2.1 FXR低表达与NSCLC患者预后不良相关
FXR蛋白位于细胞膜上(图1A)。与邻近的非肿瘤正常组织相比,FXR在NSCLC组织中的表达显著降低(P<0.001,图1B)。80例患者中,有27例FXR高表达,53例FXR低表达。Kaplan-Meier分析显示FXR低表达预示NSCLC患者预后较差(χ2=4.496,P=0.033,图1C),提示FXR可能作为一种致癌因子参与NSCLC的发生和发展。研究进一步分析了FXR的表达与NSCLC患者临床病理特征的相关性。结果显示,FXR高、低表达的NSCLC在临床分期、肿瘤大小、T分期和淋巴结转移(N分期)上有显著性差异(P<0.05)(表1)。
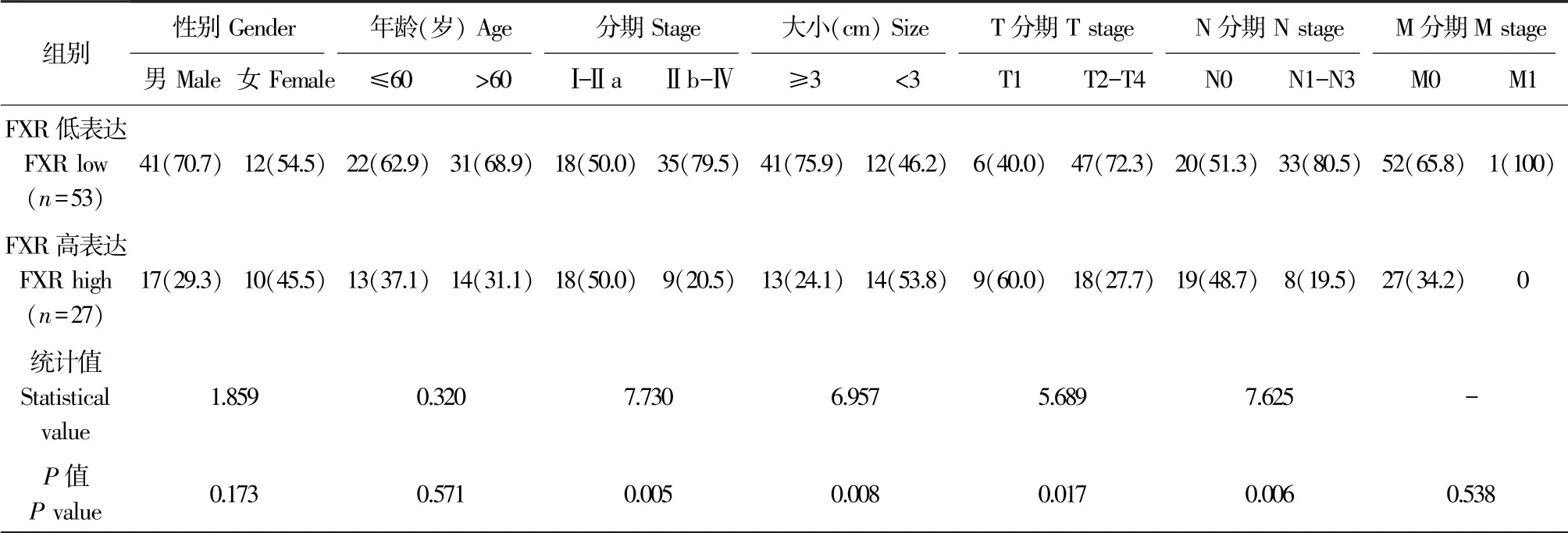
表1 根据NSCLC中FXR蛋白表达的临床病理特征Table 1 Clinicopathologic characteristics according to FXR protein expression in NSCLC
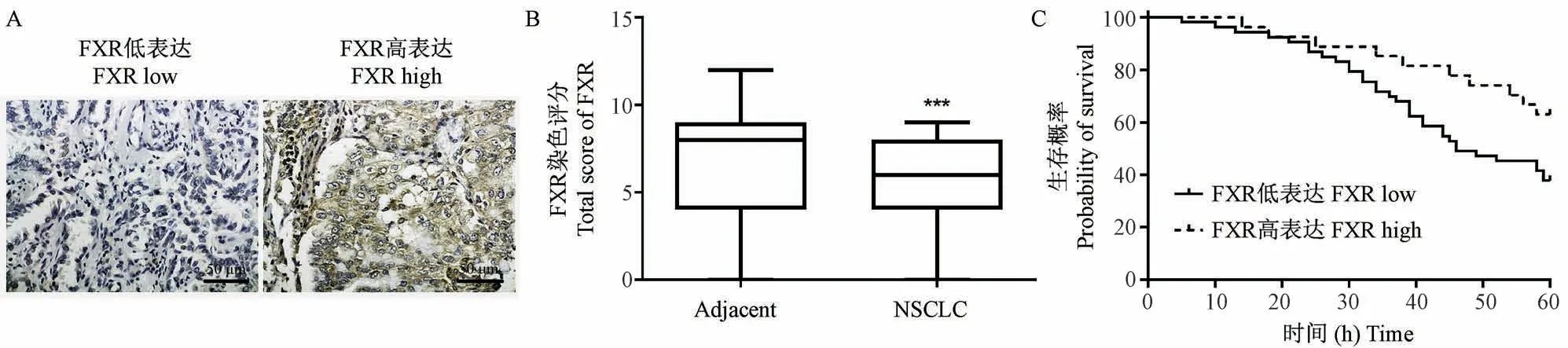
图1 FXR低表达与NSCLC患者预后不良相关Figure 1 Low FXR expression is associated with poor prognosis in NSCLC patients
2.2 FXR抑制NSCLC细胞增殖和侵袭
使用Western blot方法检测了3种NSCLC细胞系中的FXR蛋白,发现FXR在A549细胞中的表达最低(图2A),因此,研究选择A549细胞用于以下实验。Western blot显示,GW3965以剂量依赖方式促进了A549细胞中FXR的表达(图2B)。功能实验表明,GW3965以剂量依赖方式显著抑制了A549细胞的增殖和侵袭(图2C、D)。所有这些结果表明FXR受体对细胞增殖和侵袭具有很强的抑制作用。
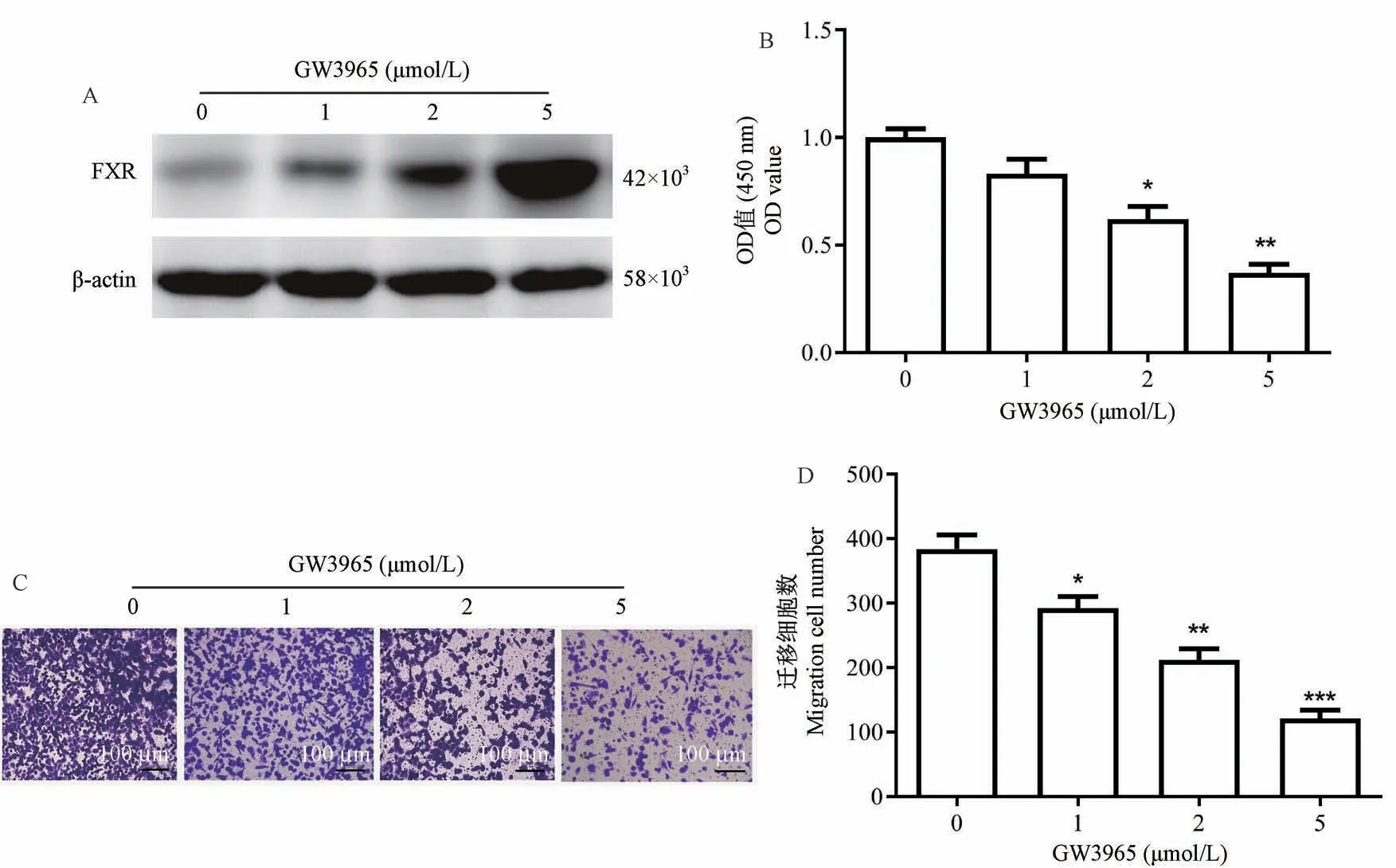
图2 FXR抑制NSCLC细胞体外增殖Figure 2 FXR inhibited the proliferation of NSCLCcells in vitro
2.3 FXR的激活通过下调miR-21抑制NSCLC细胞增殖和侵袭
使用PCR方法检测了3种NSCLC细胞系中的miR-21,发现miR-21在A549细胞中的表达最高(图3A)。利用GW3965激活FXR可剂量依赖性地降低miR-21(图3B)。功能实验表明,miR-21过表达显著逆转了FXR对NSCLC细胞生长和侵袭的抑制作用(P<0.05),并且miR-21沉默显著增强FXR对NSCLC细胞生长和侵袭的抑制作用(P<0.05)(图3C~H)。为了证实FXR与miR-21之间的关系,研究进行了双重荧光素酶报告基因检测。图4A显示了分别包含预测的miR-21野生型和突变体结合位点的FXR mRNA的3’-UTR(FXR 3’-UTR WT和FXR 3’-UTR MUT)(带突变的碱基标有下划线)。在FXR 3’UTR WT组中,与阴性对照转染细胞相比,pcDNA-miR-21显著抑制FXR 3’UTR WT的荧光素酶活性(P<0.001),si-miR-21可显著减轻该抑制作用(P<0.01)(图4B)。这些结果表明,FXR通过靶向miR-21来抑制NSCLC细胞增殖和侵袭。
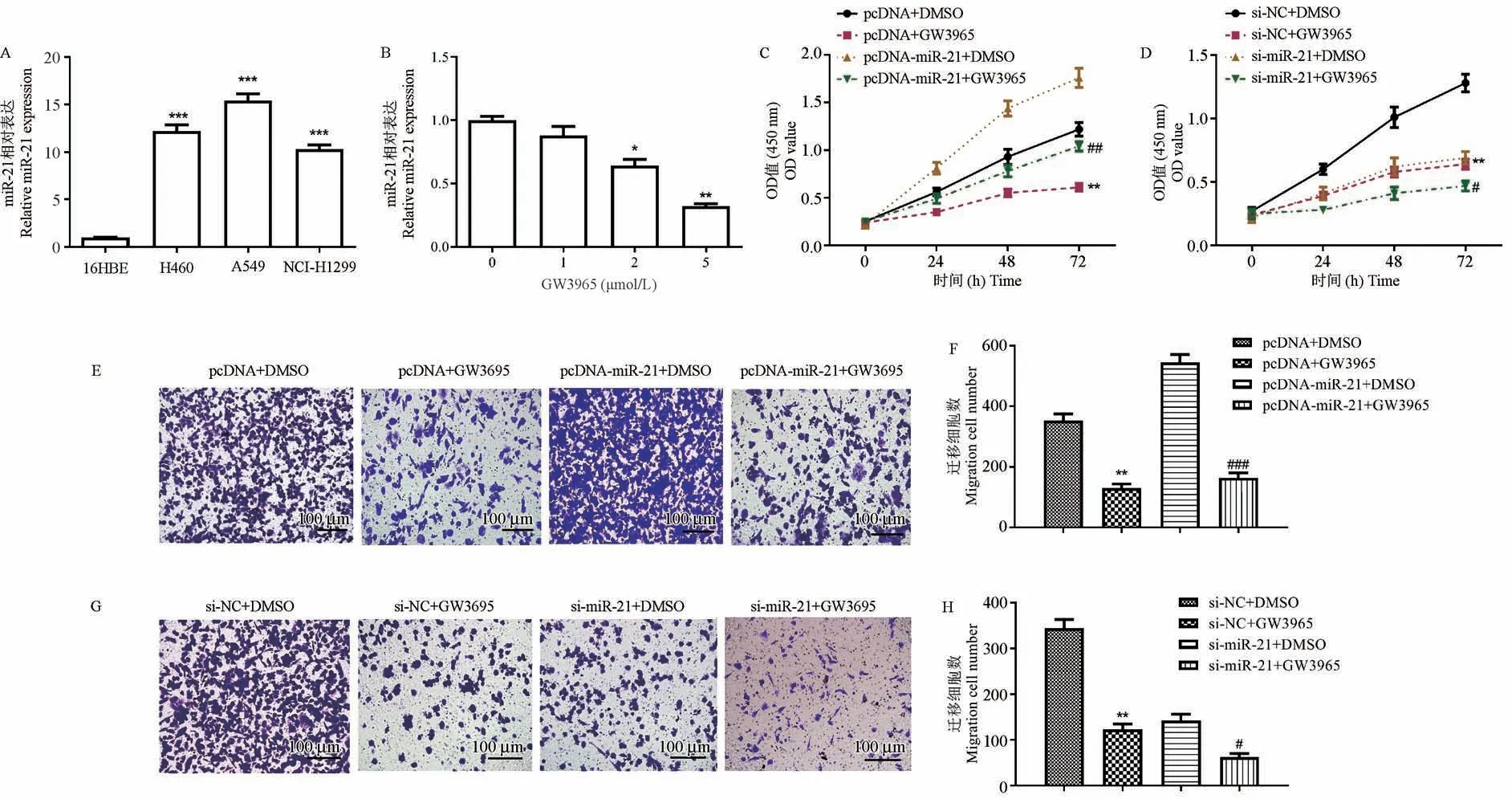
图3 FXR通过下调miR-21抑制NSCLC细胞的增殖和侵袭Figure 3 FXR inhibits the proliferation and invasion of NSCLC cells by down-regulating miR-21
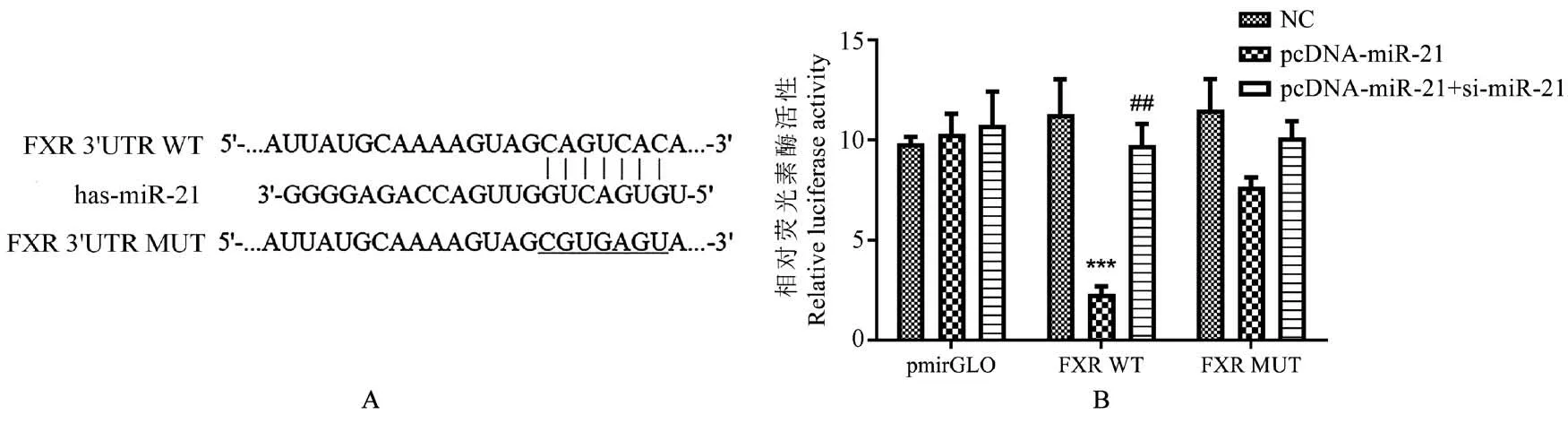
图4 FXR直接与miR-21相互作用Figure 4 FXR directly interacted with miR-21
2.4 FXR过表达与NSCLC中miR-21呈反相关
研究进一步利用qRFPCR分析了miR-21在同一标本中的表达,以阐明FXR和miR-21在NSCLC中的关系。结果显示,NSCLC组织中miR-21的水平显著高于邻近组织(P<0.01,图5)。将80例NSCLC组织分为两组:miR-21高表达组(高于miR-21表达中位数,n=40)和低表达组(低于miR-21表达中位数,n=40)。Spearman分析显示,NSCLC标本中FXR与miR-21的表达呈强负相关(P<0.001,表2)。Kaplan-Meier分析显示,“FXR低表达”和“miR-21”高表达共存模式预测了NSCLC患者最差的预后(χ2=8.201,P=0.004,图6)。
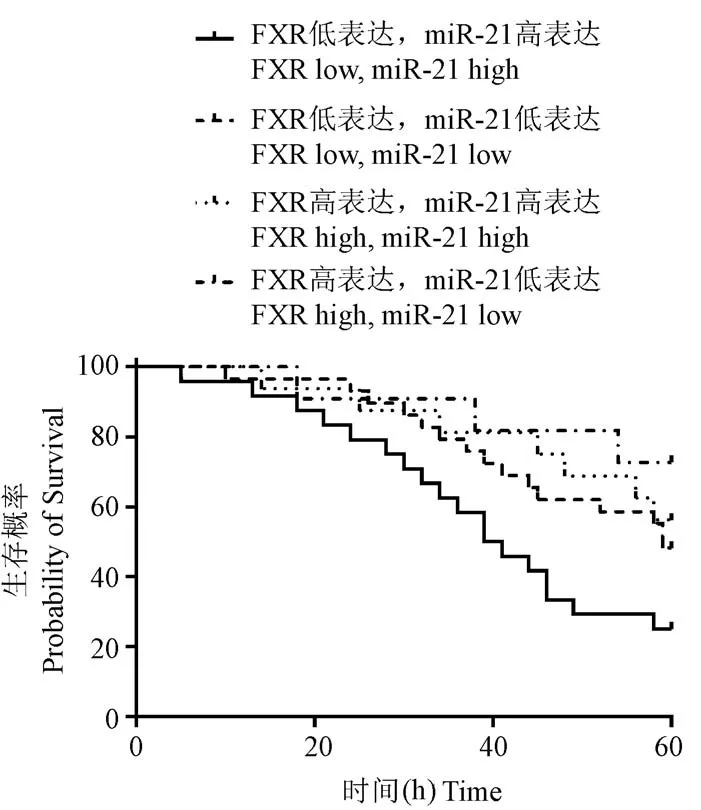
图6 Kaplan-Meier分析显示FXR低表达和miR-21高表达患者的预后最差Figure 6 Kaplan Meier analysis showed that patients with low FXR expression and high miR-21 expression had the worst prognosis

表2 NSCLC中FXR与miR-21表达的相关性分析Table 2 Correlation analysis of FXR and miR-21 expression in NSCLC
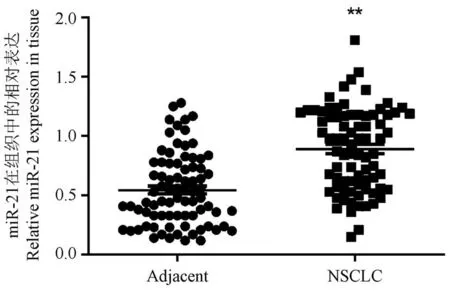
图5 80例患者NSCLC组织中miR-21表达与配对相邻组织的比较Figure 5 Comparison of miR-21 expression in NSCLC tissues of 80 patients with paired adjacent tissues
3 讨论
NSCLC约占肺癌的85%,预后差,5年总生存率低[1]。因此,迫切需要提高NSCLC的早期诊断水平。FXR是核受体超家族的成员,在胆汁酸、胆固醇、脂质和葡萄糖代谢中起着关键作用[10]。最近,人们发现FXR的功能超出了新陈代谢,包括炎症和致癌作用[11];如Hotta等[5]发现FXR在体外和体内对包括结直肠癌在内的多种癌症具有重要的抗癌作用;Alasmael等[4]发现FXR的激活会导致四种不同表型乳腺癌细胞系的细胞死亡:MCF-10A(正常)、MCF-7(受体阳性)、MDA-MB-231和MDA-MB-468(三重阴性)。本研究发现FXR在多个NSCLC细胞系中的表达低于16HBE正常细胞,在NSCLC组织中的表达较邻近组织下调,并且FXR低表达与NSCLC临床分期、肿瘤大小、T分期和淋巴结转移(N分期)显著相关。先前研究报道,FXR激动剂GW3965治疗通过激活不同荷瘤小鼠MDSCs表面的ApoE-LRP8受体引起MDSCs凋亡,从而降低MDSCs对T细胞的抑制作用,发挥抗肿瘤作用[12]。本研究功能分析表明,利用GW3965上调NSCLC细胞中FXR的表达抑制了A549细胞的增殖和侵袭,提示FXR可能参与了NSCLC的发生发展,并可作为治疗NSCLC的一种新的临床分子标记物。
接下来,本研究试图揭示FXR在NSCLC发生发展中的调控机制。大量研究表明,miRNA在癌症发展中起着关键作用[2]。miRNA作为小的非编码RNA,可以通过靶向mRNAs来调节基因的表达[13]。因此,miRNAs通过参与多种与癌症相关的生物学过程,如细胞增殖和凋亡,被证明是肿瘤的癌基因和抑制因子[14]。先前在NSCLC的miRNA研究表明,miRNA具有独特的致癌作用,如miRNA-615-3p通过抑制IGF2抑制NSCLC的肿瘤生长和转移[15];miR-129通过靶向SOX4抑制A549细胞的迁移和侵袭[16]。最近,FXR被报道通过与3’UTR结合来调节miR-21的表达[9]。miR-21在调节癌细胞行为和恶性肿瘤中起着重要作用,并且还可以促进肝癌细胞生长,诱导胶质母细胞瘤细胞抗凋亡特性[17]。此外,miR-21在NSCLC细胞的生长、侵袭和凋亡中起重要作用[2]。为了解释FXR的异常表达,预测miR-21可能是FXR的候选调控因子。结果表明,miR-21在人NSCLC中过度表达,而利用GW3965激活FXR可降低miR-21,并且miR-21过表达逆转了FXR对NSCLC细胞生长和侵袭的抑制作用。进一步通过荧光素酶报告显示miR-21与FXR的3’UTR结合位点相结合,证实了本研究发现。以上证据表明,miR-21是一种致癌的miRNA,FXR通过靶向miR-21来抑制NSCLC细胞增殖和侵袭。本研究还发现NSCLC标本中FXR和miR-21的表达呈强负相关,并且“FXR低表达”和“miR-21高表达”共存模式预测了NSCLC患者最差的预后。基于这些研究结果,FXR激动剂GW3965在miR-21过度表达的NSCLC患者中具有潜在的临床应用价值,以减轻miR-21的有害影响。需要进一步的临床前和临床研究证实这一观点。
综上所述,本研究揭示了FXR通过下调miR-21抑制NSCLC细胞的生长,提示调控FXR/miR-21可能是治疗NSCLC的潜在策略。本研究为FXR参与NSCLC的发生发展提供了一个新的视角。

