急性脑卒中患者血清氧化应激水平与睡眠障碍相关性研究
李 丹,迟丽屹
(空军第九八六医院神经内科,陕西 西安 710054)
当机体遭受有害刺激时体内高活性分子如氧、氮自由基产生过多,超过机体自身对氧化物的清除能力,导致抗氧化系统失衡,机体进入氧化应激状态[1]。睡眠障碍是脑卒中常见继发症状,且多数在脑卒中急性期就会出现,有研究显示,无意识障碍者脑卒中发病后3~5 d即可出现睡眠障碍,有意识障碍者3 d内即可出现,睡眠障碍往往会持续4~14 d,长时间睡眠障碍会持续影响患者身体健康和精神状态[2-4]。目前临床上关于急性脑卒中患者血清氧化应激水平与睡眠障碍的关系仍未阐明,本研究通过分析急性脑卒中患者不同程度睡眠障碍下氧化应激水平的高低,探讨机体氧化应激反应与睡眠障碍的相关性。现报告如下。
1 资料与方法
1.1 一般资料 选取我院2016年6月至2019年6月60例急性脑卒中患者作为研究对象,根据匹兹堡睡眠质量指数(PSQI)[5]评分分为三组,分别为睡眠正常组(PSQI评分<7分,18例)、轻度睡眠障碍组(PSQI评分为7~14分,23例)和严重睡眠障碍组(PSQI评分>14分,19例)。本研究获我院医学伦理委员会批准。病例纳入标准:①参照《中国急性缺血性脑卒中诊治指南(2014年)》[5]诊断为急性脑卒中;②年龄≥18岁;③签署知情同意书。排除标准:①合并严重心、肝、肺、肾及免疫功能障碍者;②严重感染者;③恶性肿瘤者;④精神疾病者;⑤有交流障碍无法配合研究者。三组一般资料比较无统计学差异(均P>0.05),具有可比性,见表1。

表1 三组患者一般资料比较
1.2 研究方法
1.2.1 睡眠障碍程度评估:参照PSQI量表[6],从睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物、日间功能障碍7个维度评估患者睡眠障碍程度。其中睡眠质量:较好为1分,较差为2分,很差为3分;入睡时间:0~15 min为0分,16~30 min为1分,30~60 min为2分;睡眠时间:≥7 h为0分,>6 h且<7 h为1分,>5 h且≤6 h为2分,≤5 h为3分;睡眠效率=睡眠时间/床上时间×100%,睡眠效率85%~100%为0分,75%~84%为1分,66%~74%为2分,0~64%为3分;睡眠障碍:无为0分,1次/晚为1分,2次/晚为2分,≥3次/晚3分;催眠药物无为0分,1次/晚为1分,2次/晚为2分,≥3次/晚3分;日间功能障碍:无为0分,偶尔为1分,有时为2分,经常为3分。总分为21分,PSQI评分<7分为睡眠正常,PSQI评分7~14分为轻度睡眠障碍,PSQI评分>14分为严重睡眠障碍。
1.2.2 睡眠参数监测:采用美国飞利浦伟康公司Alice 5睡眠监测仪连续同步记录7 h以上,指标包括口鼻气流、鼾声、体位、胸腹呼吸、脑电图、心电图、下颌肌电图、眼电图、外周血氧饱和度、脉搏等参数,经电脑自动分析后统计数据,记录三组总睡眠时间、入睡潜伏期、快速动眼期(REM)潜伏期、睡眠效率。
1.2.3 氧化应激水平检测:患者于入院时取患者外周静脉血5 ml,采用硫代巴比妥酸缩合法检测血清丙二醛(MDA)水平,采用硝酸还原法测定一氧化氮(NO)水平,采用黄嘌呤酶法测定超氧化物歧化酶(SOD)水平。
1.3 观察指标 ①对比三组睡眠参数监测结果和氧化应激指标检测结果;②通过Pearman分析患者睡眠障碍与血清氧化应激水平的相关性。
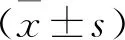
2 结 果
2.1 不同睡眠障碍患者睡眠参数比较 睡眠正常组总睡眠时间、睡眠效率显著高于轻度睡眠障碍组和严重睡眠障碍组(均P<0.05),轻度睡眠障碍组总睡眠时间、睡眠效率显著高于严重睡眠障碍组(均P<0.05),睡眠正常组入睡潜伏期、REM潜伏期显著低于轻度睡眠障碍组和严重睡眠障碍组(均P<0.05),轻度睡眠障碍组入睡潜伏期、REM潜伏期显著低于严重睡眠障碍组(均P<0.05)。见表2。

表2 不同睡眠障碍患者睡眠参数比较
2.2 不同睡眠障碍程度患者血清氧化应激水平比较 睡眠正常组血清MDA水平显著低于轻度睡眠障碍组和严重睡眠障碍组(均P<0.05),轻度睡眠障碍组血清MDA水平显著低于严重睡眠障碍组(P<0.05),睡眠正常组血清NO、SOD水平显著高于轻度睡眠障碍组和严重睡眠障碍组(均P<0.05),轻度睡眠障碍组血清NO、SOD水平显著高于严重睡眠障碍组(均P<0.05)。见表3。

表3 不同睡眠障碍程度患者血清氧化应激水平比较
2.3 睡眠障碍与血清氧化应激水平相关性 经相关性分析,血清MDA水平与总睡眠时间、睡眠效率呈负相关,与入睡潜伏期、REM潜伏期呈正相关(均P<0.05),血清NO水平与总睡眠时间、睡眠效率呈正相关,与入睡潜伏期、REM潜伏期呈负相关(均P<0.05),血清SOD水平与总睡眠时间、睡眠效率呈正相关,与入睡潜伏期、REM潜伏期呈负相关(均P<0.05)。见表4。

表4 睡眠障碍与血清氧化应激水平相关性
3 讨 论
氧化应激是神经元可塑性改变、神经元凋亡、神经退行性改变的重要原因,氧化应激会导致细胞多方面变化,修饰碱基,诱导其氧化损伤,导致其自我修复及复制时出现错配,同时,脂质氧化产物过多会产生毒性损伤细胞,诱发中枢神经系统疾病,因此,了解氧化应激反应可能发生条件,对临床及时处理患者氧化应激反应具有重要意义[7-10]。有研究显示,持续失眠患者体内会出现明显的氧化应激反应[11],但临床上关于急性脑卒中患者血清氧化应激水平与睡眠障碍的相关性目前仍不明确,基于此,本研究通过对比急性脑卒中患者不同睡眠障碍下氧化应激反应高低,了解二者的相关性。
本研究中,睡眠正常组总睡眠时间、睡眠效率显著高于轻度睡眠障碍组和严重睡眠障碍组,轻度睡眠障碍组总睡眠时间、睡眠效率显著高于严重睡眠障碍组,睡眠正常组入睡潜伏期、REM潜伏期显著低于轻度睡眠障碍组和严重睡眠障碍组,轻度睡眠障碍组总睡眠时间、睡眠效率显著低于严重睡眠障碍组。提示随着睡眠障碍越严重,患者总睡眠时间越短,睡眠效率越低,入睡潜伏期和REM潜伏期越长,其原因分析如下:与觉醒相关的神经递质功能失调是患者脑卒中后睡眠障碍主要原因,抑制性神经递质如多巴胺(DA)、5-羟色胺(5-HT)、去甲肾上腺素(NE)由下丘脑睡眠后枢和中枢分泌,作用于睡眠-觉醒调节神经中枢,抑制其兴奋,使患者进入睡眠状态,以此调节人体睡眠[12-13]。急性脑卒中后患者体内抑制性神经递质水平降低,机体接受兴奋性神经递质过度,睡眠-觉醒调节系统长时间处于觉醒状态,致使睡眠障碍发生[14-15]。当睡眠障碍越严重,睡眠-觉醒调节神经中枢兴奋时间越长,患者总睡眠时间缩短,睡眠效率降低,入睡潜伏期和REM潜伏期增长[15-16]。
本研究中,睡眠正常组血清MDA水平显著低于轻度睡眠障碍组和严重睡眠障碍组,轻度睡眠障碍组血清MDA水平显著低于严重睡眠障碍组,睡眠正常组血清NO、SOD水平显著高于轻度睡眠障碍组和严重睡眠障碍组,轻度睡眠障碍组血清NO、SOD水平显著高于严重睡眠障碍组,提示当急性脑卒中患者睡眠障碍越严重时,体内氧化应激反应越高。其原因分析如下:大脑的自由基多在觉醒状态下进行积累,于睡眠期间进行清除,睡眠期间可通过增加内源性抗氧化机制和减少自由基生成清除过多自由基[17-18]。睡眠剥夺可引起大脑氧化损伤出现,细胞膜不饱和脂肪酸容量提高,抗氧化能力降低[19]。大脑对氧化应激反应所导致的刺激极为敏感,短期睡眠剥夺不会出现脂质过氧化和蛋白氧化,大脑可以做出有效反应以避免氧化损伤,但患者长时间处于睡眠障碍状态时,患者体内自由基增多,而大脑抗氧化能力却在降低,机体对自由基的清除能力不足,导致机体氧化应激反应发生[20-21]。
经相关性分析发现,血清MDA水平与总睡眠时间、睡眠效率呈负相关,与入睡潜伏期、REM潜伏期呈正相关,血清NO水平与总睡眠时间、睡眠效率呈正相关,与入睡潜伏期、REM潜伏期呈负相关,血清SOD水平与总睡眠时间、睡眠效率呈正相关,与入睡潜伏期、REM潜伏期呈负相关,提示睡眠障碍与血清氧化应激水平具有明显的相关性。
综上所述,睡眠障碍与血清氧化应激水平具有明显的相关性,其睡眠时间越短,睡眠效率越低,当患者睡眠障碍越严重,血清氧化应激水平越高。

