维持性血液透析患者骨硬化蛋白、Klotho蛋白水平变化及与冠状动脉钙化相关性分析
张 媛,朱小静
(西安市人民医院 西安市第四医院肾内科血液净化中心,陕西 西安 710004)
维持性血液透析(Maintenance hemodialysis,MHD)为终末期肾病患者的常用治疗方法,虽然能够明显延长患者生存时间,但是大多数MHD患者由于肾功能损害等因素导致冠状动脉钙化,使患者心血管不良事件发生风险明显增加,严重威胁患者预后[1]。临床中对冠状动脉钙化的诊断主要通过CT等影像学方法进行,但是在早期诊断中的效果不佳。研究发现,部分血清学标志物在冠状动脉钙化的诊断中可优先于影像学改变[2]。其中骨硬化蛋白(Sclerostin,SCL)属于分泌型糖蛋白,研究发现,其可通过对Wnt/β通路的抑制作用参与至冠状动脉钙化的进展过程中[3]。Klotho蛋白主要由肾脏表达,研究发现,Klotho蛋白能够通过减轻机体炎症和氧化应激反应,达到对心血管系统的保护功能[4]。但是目前关于SCL和Klotho蛋白在MHD中的研究多集中于钙磷代谢、骨异常等方面,与冠状动脉钙化的相关性研究较少[5]。因此,本研究纳入西安市第四医院血透中心收治的MHD180例,对此进行了分析,报告如下。
1 资料与方法
1.1 一般资料 纳入2017年6月至2020年5月西安市第四医院血透中心收治的MHD患者180例,其中男104例,女76例,年龄28~76岁,平均(54.32±13.41)岁,原发病中,糖尿病肾病49例,肾小球肾炎76例,高血压肾病39例,其他16例,透析时间6个月至6年,平均(3.37±1.12)年。MHD患者的透析方案为使用聚砜膜透析器、碳酸氢盐透析液进行,使用动静脉内瘘作为血管通路,透析参数:透析血流量240 ml/min,透析流量为500 ml/min,透析面积1.5~1.8 m2,4 h/次,3次/周。所有患者均知情同意,本研究经审查符合赫尔辛基宣言。病例纳入标准:在我院规律透析,透析时间≥6个月;病情稳定;资料完整。排除标准:合并心肌梗死等心脏疾病;自身免疫性疾病;冠脉支架植入术史;左心室射血分数(LVEF)<50%;合并感染者;低蛋白血症;近期使用免疫抑制剂;近期骨折者;合并恶性肿瘤;严重营养不良;合并腹膜透析者。
1.2 冠脉动脉钙化检测方法 所有患者均使用德国西门子16排螺旋CT,由同一位经验丰富的医师进行冠状动脉钙化检查。层厚3.0 mm,扫描电流为80 mA,扫描部位包括右冠状动脉、左回旋、前降支以及左主干。记录三组患者的冠状动脉钙化积分(CACs),其中无钙化为≤10分,11~400分为轻中度钙化,≥400分为重度钙化[6]。
1.3 观察指标 ①不同冠状动脉钙化程度患者的临床资料:根据患者CACs情况进行分组,分为无钙化组、轻中度钙化组和重度钙化组。收集三组患者的一般资料,包括年龄、性别、体重指数(BMI)、原发病、糖尿病、高血压、透析时间等。采集患者空腹静脉血5 ml,离心后取血清,使用酶联免疫吸附法(ELISA)对三组患者血清SCL、Klotho蛋白以及骨源性碱性磷酸酶(BALP)水平进行测定,试剂盒均购买自上海双赢生物科技有限公司,使用日本日立7600-020全自动生化分析仪对三组钙、磷、甲状旁腺激素(PTH)、白蛋白(Alb)、25羟维生素D3水平进行测定,使用美国贝克曼库尔特DxH800全自动血液分析仪对血红蛋白(Hb)水平进行测定。比较三组的SCL、Klotho蛋白、BALP、钙、磷、PTH、Alb、25羟维生素D3水平。②MHD患者发生冠状动脉钙化的危险因素分析:以冠状动脉钙化为因变量,使用二元Logistic回归对影响MHD患者发生冠状动脉钙化的危险因素进行分析。③SCL、Klotho蛋白对MHD患者冠状动脉钙化的诊断价值:使用受试者工作曲线(ROC)分析SCL、Klotho蛋白在MHD患者冠状动脉钙化诊断中的应用价值,记录曲线下面积(AUC)、截断值、灵敏度和特异度。
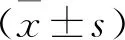
2 结 果
2.1 不同冠状动脉钙化程度患者的临床资料和血清学指标比较 三组之间性别、BMI、原发病、透析时间、高血压、BALP、钙、磷、Hb、PTH和Alb水平比较,差异无统计学意义(均P>0.05)。三组之间年龄、糖尿病、SCL、Klotho蛋白以及25羟维生素D3水平比较,差异具有统计学意义(均P<0.05)。见表1。

表1 不同冠状动脉钙化程度患者的临床资料和血清学指标比较
2.2 MHD患者发生冠状动脉钙化的危险因素分析 以冠状动脉钙化为因变量,将可能影响冠状动脉钙化的单因素纳入二元Logistic回归分析中,赋值方法如下:年龄≥60岁(是=1,否=0)、糖尿病(是=1,否=0),SCL、Klotho蛋白以及25羟维生素D3均以实际检测值纳入分析。结果发现,年龄≥60岁、SCL为MHD患者发生冠状动脉钙化的危险因素,Klotho蛋白为MHD患者发生冠状动脉钙化的保护性因素。见表2。

表2 MHD患者发生冠状动脉钙化的危险因素分析
2.3 SCL、Klotho蛋白对MHD患者冠状动脉钙化的诊断价值分析 ROC曲线结果表明,SCL对MHD患者冠状动脉钙化诊断下,AUC为0.711,截断值为42.19 ng/L,诊断敏感度为61.50%,特异度为75.56%。Klotho蛋白对MHD患者冠状动脉钙化诊断下,AUC为0.802,截断值为416.95 ng/L,诊断敏感度为82.20%,特异度为62.96%。见表3。

表3 SCL、Klotho蛋白对MHD患者冠状动脉钙化的诊断价值分析
3 讨 论
心血管疾病为MHD患者预后不良的主要危险因素,其中冠状动脉钙化可明显促进心血管疾病的进展[7]。研究发现,MHD患者长期肾功能损害、炎症反应、机体钙磷和骨代谢紊乱等情况,均可促使血管平滑肌细胞的骨样转化,进而明显提高冠状动脉钙化的发生风险[8]。调查显示,MHD患者中约70%合并发生冠状动脉钙化[9]。通过寻找新型血清学标志物,有利于对MHD患者的早期干预,以降低冠脉血管钙化的发生率,并为患者预后的改善提供有效依据[10]。
SCL是经SOST基因表达后产生的蛋白,一般认为其主要通过抑制Wnt-β通路,进而达到对骨形成、骨细胞增殖等生理过程的负性调控[11]。然而近年来的研究发现,SCL不仅可在骨骼中表达,还可在钙化的冠状动脉平滑肌细胞中表达,提示其可能参与冠状动脉钙化进展[12]。有研究认为,SCL和慢性肾脏病患者不良心血管事件发生率明显相关[13]。本研究发现,随着SCL水平的提高,MHD患者发生冠状动脉钙化的风险明显提高,为MHD患者冠状动脉钙化发生的独立危险因素,且SCL可应用于MHD患者冠状动脉钙化的诊断中。然而不同研究中关于SCL与MHD患者冠状动脉钙化的影响机制研究结果并不一致,有研究认为高水平SCL为MHD患者冠状动脉钙化发生的保护性因素,其认为冠状动脉钙化严重程度的提高,SCL的表达随之增加,可对血管平滑肌细胞的骨样转化产生抑制效果,进而减缓了血管钙化的进展[14]。关于SCL和MHD患者冠状动脉钙化的相关性及发生机制仍需扩大样本,进行更为深入的研究。
目前认为,MHD患者中,Klotho蛋白可参与成纤维细胞生长因子(FGF)受体的激活,通过对离子通道及信号调节激酶1/2等的调控,达到改善血磷代谢和骨代谢的目的,进而参与至冠状动脉钙化的进展中[15-16]。本研究发现,随着Klotho蛋白水平的下降,MHD患者发生冠状动脉钙化的风险越高,且Klotho蛋白可应用于MHD患者冠状动脉钙化的诊断中,这可能是由于低水平的Klotho蛋白可导致血管内皮细胞功能障碍,以及一氧化氮(NO)水平的降低,进而促使血管平滑肌细胞增殖以及血管内皮损伤,增加冠状动脉钙化的风险[17]。目前关于Klotho蛋白与MHD患者冠状动脉钙化发生机理之间的关系尚未完全明确。研究发现,Klotho蛋白可通过血红素加氧酶、特异性转录因子等机制,降低活性氧簇,减少机体氧化应激反应,进而达到对血管平滑肌的保护效果[18]。有研究发现,Klotho蛋白能够通过降低核苷三磷酸酶的活性,使细胞对磷的吸收减少,进而使血管钙化得到有效改善[19]。也有研究认为,Klotho可通过拮抗TRPC6、TRPV5路径,调节细胞内钙的水平,进而对心肌产生保护效果,减少心室肥厚的发生风险[20]。关于Klotho蛋白在MHD患者冠状动脉钙化中的作用机制仍需进一步研究。
综上所述, SCL、Klotho蛋白水平均与MHD患者冠状动脉钙化密切相关,且SCL、Klotho蛋白水平对MHD患者冠状动脉钙化具有较好的诊断价值。临床中可据此为MHD患者冠状动脉钙化的早期诊断及干预制定相关措施,以降低MHD患者心血管不良事件的发生风险。

