电针对创伤性颅脑损伤大鼠炎症因子表达及神经功能的影响
李 娜,王瑞辉,郭 婕,李 华,郭新荣,张容超,吴 涛
(陕西中医药大学针灸推拿学院,陕西 咸阳 712046)
创伤性颅脑损伤(Traumatic brain injury,TBI)是目前神经外科临床最常见的疾病之一,随着社会的发展变化,其发病率呈现逐年升高的特点;又因其致死率高、致残率高、患病人群多为中青年,给家庭和社会带来很大的心理和经济负担。TBI 后脑神经细胞的生理病理变化过程十分复杂,主要包括神经细胞死亡[1]、脑水肿[2]、氧化应激[3]、兴奋性神经递质毒性释放[4]、神经炎症[5]、血脑屏障障碍[6]等。其中TBI后血脑屏障破坏、凝血功能障碍、氧化应激等因素可引起的炎症反应是引起TBI后脑水肿的主要原因[7],有效的控制脑神经细胞的炎症反应和脑水肿对TBI患者的预后及康复起着重要的作用[8]。本研究主要探讨电针对创伤性颅脑损伤大鼠血清及大脑组织中肿瘤坏死因子(TNF-α)和白细胞介素(IL-1β、IL-6)等表达及神经功能的影响。
1 材料与方法
1.1 实验动物及分组 SPF级SD大鼠66 只(雄性,6~8周龄),体重180~220 g,购买于西安交通大学医学部实验动物中心[生产许可证号:SCXK(陕)2018-001]。将实验大鼠适应性喂养7 d,在陕西中医药大学针药结合动物饲养中心进行分笼喂养,湿度(54±2)%,温度(23±3)℃,昼夜节律12 h/12 h,自由饮水摄食。适应性喂养结束后,随机分为正常对照组12只、假手术组12只、模型组21 只及电针组21只,正常对照组和假手术组每组6只用于脑含水量测定,其余6只用于Elisa和Western blot检测,电针组、模型组再需根据干预和取材时间的不同,又分为1、3、7 d 3个亚组(每亚组7 只)。
1.2 造模方法 在大鼠左侧顶叶采用改良 Feeney’s自由落体打击法[9]进行TBI 模型制备。假手术组、电针组及模型组大鼠三组均进行术前麻醉,麻醉剂量为:10%水合氯醛(3.8 ml/kg),腹腔注射,麻醉起效后,剔除施术部位毛发后,将大鼠固定于脑立体定位仪上,以头部正中线中点左侧 0.5 cm 处为中心,纵行切开头部皮肤 1.5 cm。使施术部位颅骨充分暴露后,用电磨钻钻一直径 5 mm 的小孔,坐标位置:冠状缝后0.6 cm、矢状缝左侧旁开0.5 cm,将20 g砝码从50 cm高的透明玻璃管孔上端垂直下落击打小孔,制备大鼠左侧大脑顶叶TBI中度颅脑损伤模型。待大鼠苏醒后,对造模大鼠神经功能进行评分,量表使用改良神经功能缺损量表(Modified neurological severity scale,mNSS),以评定大鼠即时神经功能,评分为 7~12 分,则认定为造模成功。造模后连续3 d,腹腔注射庆大霉素(0.2 ml/kg)以抗感染。假手术组大鼠只开颅钻孔,不打击。造模过程中和造模后,大鼠共死亡6只(电针组3只,模型组3只)。
1.3 干预方法 本实验采用电针进行干预,穴位选取参照《大鼠穴位图谱的研制》[10],选取“水沟”“百会”,双侧“内关”“足三里”穴,于造模后 24 h对电针组进行电针干预。选用一次性针灸针(规格:0.30 mm×25 mm),“百会”穴:斜刺,深度为2 mm,“水沟”穴:点刺 30 s,深度为1 mm;“内关”穴,直刺,深度为 1 mm, “足三里”穴:直刺,深度为 7 mm;针刺得气后,“足三里”和“内关”穴接连电针,波形为:断续波,频率为:2 Hz,留针15 min;1次/d,不同亚组分别干预1、3、7 d。模型组和假手术组,两组大鼠每天模拟针刺前的操作:抓取、固定 15 min,正常对照组不进行干预。
1.4 主要试剂与仪器 大鼠TNF-α抗体、 IL-6抗体、IL-1β抗体购自博士德生物工程公司,批号分别为:PB0082、PB0061、PB0055);羊抗兔 IgG(H+L)购自上海碧云天生物技术有限公司,批号为:A0208;大鼠TNF-α、IL-1β、IL-6酶联免疫吸附检测(ELISA)试剂盒购于博士德生物工程有限公司,批号分别为:EK0421、EK0526、EK0393);水合氯醛购于上海山浦化工有限公司;SDZ-Ⅱ电子针疗仪(苏州医疗用品厂有限公司),脑立体定位仪(成都泰萌软件有限公司),SpectraMax5 酶标仪(美国 Molecular Devices 公司)。
1.5 行为学检测 采用改良神经功能缺损量表(mNSS )[11]进行大鼠的神经功能的评估。每组大鼠均根据神经功能缺损量表进行运动、感觉和平衡训练,并于术后 1、3 、5、7 d 记录其mNSS 评分,分别从4 个方面:运动、感觉、平衡、反射进行神经功能综合评估。总分 共18 分,评分越高(低)代表神经功能损伤程度越重(轻),0 分为完全正常。
1.6 大鼠脑组织含水量检测 采用干湿重法测定脑组织含水量[12],每组于第3天随机选取6只大鼠断头处死,取左侧脑组织,电子天平(精确度 0.1 mg)测得湿重,然后置于70 ℃的烤箱内烘干48 h,恢复室温后,测得干重。脑组织水含量=(湿重-干重) /湿重×100%[12]。
1.7 炎症因子表达检测 大鼠10%水合氯醛(3.8 ml/kg)腹腔注射麻醉后腹主动脉取血,室温凝固2 h,离心15 min (3000 r/min),收集血清待测。严格按照武汉博士德生物有限公司炎症因子TNF-α、IL-1β、IL-6 试剂盒的说明书操作步骤进行操作。
1.8 蛋白免疫印迹法(Western blot)检测损伤脑组织中IL-1β、TNF-α、IL-6蛋白表达 取损伤脑组织样本100 mg,加 500 μl含蛋白酶抑制剂的 RIPA 裂解液后进行匀浆,提取总蛋白,金属浴 95 ℃变性5 min。SDS-PAGE(12%) 凝胶电泳后,将蛋白转移到PVDF膜,用脱脂奶粉(5%)封闭 2 h后,一抗孵育(4 ℃过夜),抗体稀释比例为:TNF-α 1∶2000,IL-6 1∶1000,IL-1β 1∶1000,β-actin 1∶1000;孵育二抗。滴加发光液,ECL 发光成像系统曝光拍照,计算并分析各目标蛋白相对表达量。

2 结 果
2.1 各组大鼠的一般情况比较 见表1~3。正常对照组、假手术组大鼠在实验期间精神状态良好、毛色光滑、反应灵活、自主饮水饮食、食量无减少,体重明显增加;模型组大鼠手术后1~3 d,可见精神懒惰,饮食量明显减少,体重减轻;电针组大鼠术后1~3 d在食量和体重方面有所减少;3~7 d模型组、电针组大鼠在饮食、饮水、体重增加均有所好转,电针组较模型组明显好转,有统计学差异(P<0.05)。
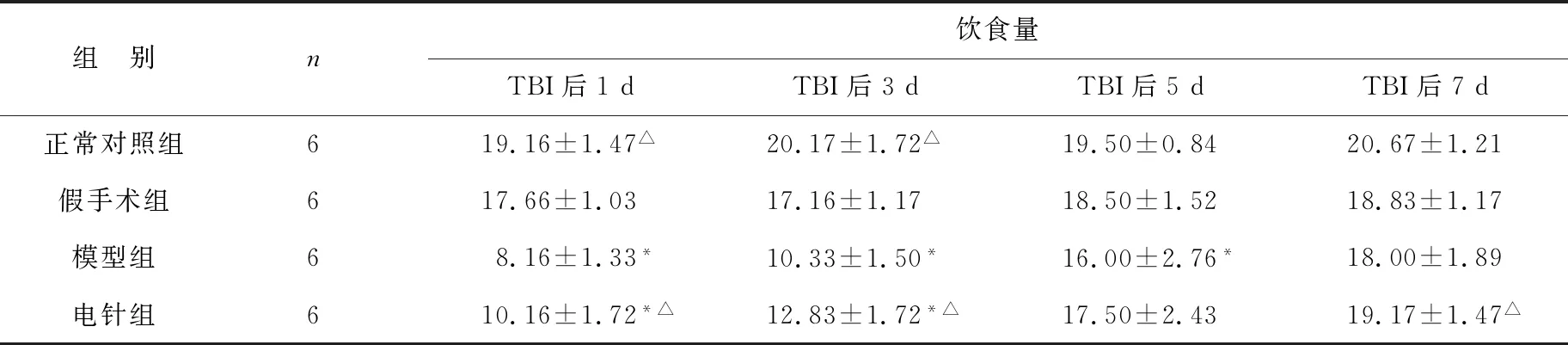
表1 四组大鼠饮食量比较(g/d)
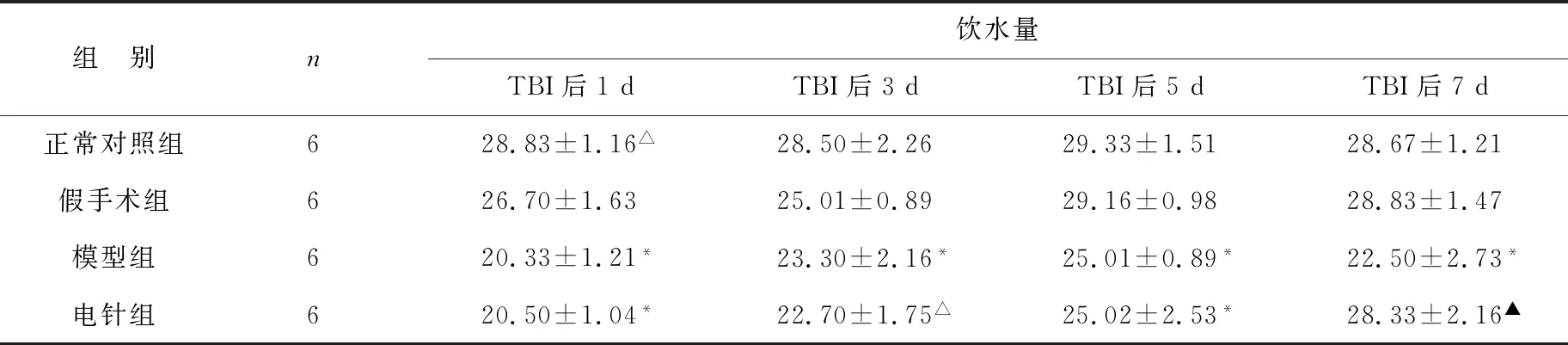
表2 四组大鼠饮水量比较(ml/d)

表3 四组大鼠体重比较(g/d)
2.2 各组大鼠行为学比较 见表4。各组大鼠在造模前mNSS评分比较无统计学差异,电针组和模型组在造模后 6 h、1 d mNSS评分相比较,差异无统计学意义(P>0.05);电针治疗后(3 d、7 d),与模型组相比较,电针组mNSS评分降低明显,差异有统计学意义(P<0.05,P<0.01)。
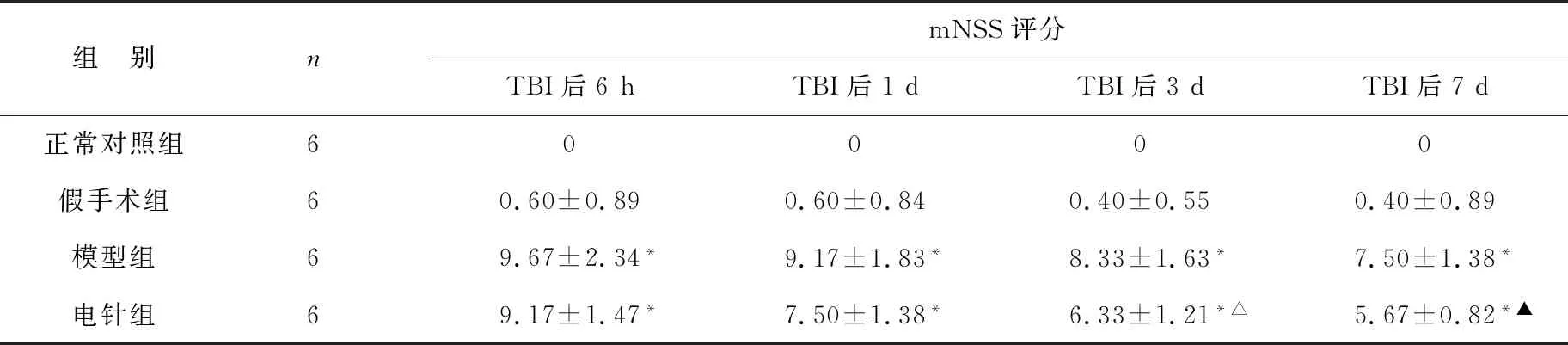
表4 各组大鼠电针干预后mNSS评分比较(分)
2.3 各组脑组织水含量比较 相比较于正常对照组,假手术组的大鼠脑组织含水量较低,差异无统计学意义(P>0.05);相比较于假手术组,模型组大鼠损伤脑组织含水量升高明显(P<0.05);相比较于模型组,电针组大鼠损伤脑组织含水量显著降低(P<0.05)。见表5。
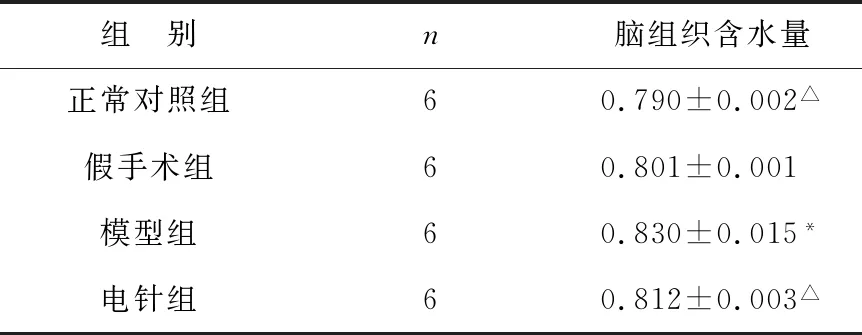
表5 四组大鼠TBI后3 d脑组织水含量比较(%)
2.4 各组大鼠血清炎症因子指标比较 相比于正常对照组,假手术组大鼠血清炎症因子IL-1β、TNF-α、IL-6的含量略有升高,差异无统计学意义(P>0.05),相比于假手术组,模型组大鼠血清炎症因子(模型组)IL-1β、IL-6、TNF-α的含量显著升高(P<0.05);相比于模型组,电针组大鼠血清炎症因子IL-1β、TNF-α、IL-6的含量明显降低。见表6。
2.5 各组大鼠损伤脑组织中炎性因子TNF-α、IL-1β、IL-6蛋白表达量的比较 Western blot 法检测显示,相比于正常对照组,假手术组大鼠大脑组织中TNF-α蛋白表达量有所升高(1 d,P<0.05,7 d,P>0.05);相比于假手术组,模型组大鼠1、7 d 时损伤脑组织TNF-α蛋白表达量均明显升高(P<0.05);相比于模型组,电针组大鼠电针干预后损伤脑组织TNF-α表达量有所升高(1 d,P>0.05),表达量降低(7 d,P<0.05);大鼠大脑组织IL-6在术后1、7 d蛋白量表达,相比于假手术组,正常对照组表达量较低(P<0.05),模型组表达量升高较为明显(P<0.05);相比于模型组,电针组大鼠电针干预后1 d脑组织IL-6表达量有所增加,无统计学意义(P>0.05),干预7 d大脑组织IL-6表达量明显降低(P<0.05);大鼠大脑组织IL-1β在术后1、7 d蛋白量表达,相比于假手术组,模型组表达量显著增加(P<0.05);相比于模型组,电针组大鼠脑组织IL-1β表达量降低较明显(图1)。

表6 各组大鼠干预后血清IL-1β、TNF-α、IL-6含量比较(pg/ml)

注:术后1 d、7 d各组损伤大脑组织TNF-α、IL-6、IL-1β蛋白表达情况(A图、B图),术后1 d、7 d各组损伤大脑组织TNF-α含量比较(C图),术后1 d、7 d各组损伤大脑组织IL-6含量比较(D图),术后1 d、7 d各组损伤脑组织IL-1β含量比较(E图)。
3 讨 论
TBI的损伤一般分为原发性损伤和继发性损伤,其中原发性损伤为机械外力所造成的脑组织结构损伤,是外力对脑组织的直接损伤,具有不可控性;继发性损伤是从原发性损伤开始时起,脑部组织、血管等由于微环境的变化所引起的病理生理过程。根据原发性损伤和继发性损伤的特点,学界认为有效控制继发性损伤是决定颅脑损伤患者预后转归的关键。颅脑损伤发生后,以脑水肿、神经炎症为代表的继发性脑损伤是影响TBI患者康复的重要因素之一,但目前尚无有效治疗方案[13]。
TBI后脑组织局部受损,局部及全身的炎症反应迅速被激活,小胶质细胞及星形胶质细胞首先被激活,进而产生大量如:TNF-α、IL-6等炎性因子,激活后的炎性细胞进入脑组织后可以再次重新释放炎症因子,导致血脑屏障破坏,诱发脑水肿,导致颅脑损伤[14-15]。研究表明,在颅脑损伤后,血清中IL-6、IL-1β、TNF-α 等与脑内及全身炎症密切相关的炎症因子水平明显升高[16-17]。
针灸作为中国传统特色疗法之一,在神经系统疾病的治疗中疗效显著。TBI作为神经外科常见病、多发病,针灸对其治疗和研究中,选取优势穴位“百会、水沟、内关、足三里”等穴位,或结合药物、穴位注射、神经肌肉电刺激、高压氧、康复训练等,在改善TBI后神经功能、认知功能、昏迷等方面具有良好的临床疗效[18-20]。由于TBI的病理生理过程较为复杂,对其针灸作用机制的研究目前还处于初步阶段,研究表明,在TBI继发性损伤早期的炎症反应中,白细胞介素和TNF-α 在其中起着非常重要的作用,而中医针灸能明显减少炎症因子在大脑组织中的含量,抑制大脑水肿,发挥有效保护神经元作用[21]。
本研究从电针对颅脑损伤后炎症因子及蛋白的表达入手,选取脑损伤急性期的1、7 d为时间点,观察各组大鼠脑组织及血清中炎症因子及蛋白的表达的情况。结果显示:在早期,损伤大脑组织及血清中的炎症因子IL-1β、TNF-α、IL-6表达急剧升高,而后逐渐降低,在治疗7 d后表达水平有所降低,而且,电针组TNF-α、IL-6、IL-1β表达量均明显低于相同时间段的模型组,这与行为学等检测结果变化是一致的。因此,电针“百会、水沟、内关、足三里”穴可明显改善创伤型颅脑损伤大鼠的神经功能,减轻损伤大脑组织的炎症反应,其相关机制可能与下调损伤大脑组织及血清中IL-6、IL-1β、TNF-α的表达,进而抑制炎症反应,改善脑水肿有关。

