四种中药不同药性与药理作用关系研究
安 娜,黄芳敏,王健辉,沈 伟
(1.西安市第一医院 西北大学附属第一医院 陕西省眼科研究所 陕西省眼科学重点实验室陕西省眼科疾病临床医学研究中心,陕西 西安 710002;2.陕西省新药审评中心,陕西 西安 710065)
中药药性与性能是阐释中药作用和指导中医临床用药的重要依据,概括归纳为四气、五味、归经、升降浮沉等内容,温、热、寒、凉四种药性是中药药性理论的重要组成部分[1-3]。药性体系中的各种性能,主要依据药物作用于机体所产生的效应和针对临床病证用药的实际疗效总结出来,其认识先于功效,是对功效的一种高度概括[4-5]。药性一致的每一味中药对机体生理状态所产生的效应是存有差异的[6],如何准确地推理与标识中药药性的实质内涵并赋予药理学理论意义,这对传统中药药性理论的重新升华具有重要意义。本文根据四种中药药性对肝郁脾虚小鼠和细胞内信号通路蛋白表达的影响,探讨中药药性体系对药理学理论的意义。
1 材料与方法
1.1 实验动物 昆明种小白鼠,体重18~22 g,由四医大动物中心提供,细胞来源:肝星状细胞系HSC-T6(长沙万百生物技术)。
1.2 试剂耗材 四氯化碳(CCl4,天津试剂二厂,批号:20060912);转化生长因子-β1(transforming growth factor,TGF-β1,美国罗氏,货号:H14406);MEK抑制剂PD98059(美国Promega,货号:41539903);丙氨酸氨基转移酶试剂盒(Alanine Aminotransferase Kit,ALT,批号:090521)、胆碱酯酶试剂盒(Cholinesterase,CHE,批号080751)、谷胱甘肽试剂盒(Glutathione, GSH ,批号:090637)(中生北控生物);α-Smooth Muscle Actin(D4K9N) XP Rabbit mAb #19245;Anti-p-ERK1/2,批号:G2508;Anti-ERK1/2,批号:C1307;Anti-TGF-β receptor typeⅠ,TβRⅠ,批号:D2407、Anti -TGF-β receptor type Ⅱ,TβRⅡ,批号:D1107;辣根过氧化物酶标记山羊抗大鼠IgG(H+L)(A0192 碧云天);Rabbit Anti-Ⅰ型胶原(CollagenTypeⅠ,COL-Ⅰ,批号:#I1906);辣根过氧化物酶标记山羊抗兔IgG(H+L)(A0208 碧云天);Rabbit Anti-Smad2/3(Boster,批号:080710);BeyoECL Moon(极超敏ECL化学发光试剂盒,批号:P0018FS 碧云天)、PVDF膜(No:FFP24 碧云天);BCA蛋白浓度测定试剂盒(No:P0012S碧云天)、RIPA裂解液(No:P0013 碧云天)。
1.3 药物剂量与分组设计 柴胡提取物每克稠膏含生药7.69 g;丹参提取物每克稠膏含生药2.50 g;五味子提取物每克稠膏含生药2.24 g;灵芝提取物每克稠膏含生药10.24 g;体内试验分六组:对照组、CCl4组、柴胡组、五味子组、丹参组、灵芝组,体内给药剂量参照2010版《中国药典》一部均为10 g生药/kg;体外试验分十二组:对照组、TGF-β1组、PD98059阻断剂组(100 μmol/L)、PD98059+TGF-β1组,各药物剂量依据MTT法测定IC50浓度100 mg/L。
1.4 体内实验 取90只正常雄性昆明种小白鼠,于适应环境3 d后开始进行试验,将其随机分为九组,每组10只小鼠,正常组在皮下注射0.9%氯化钠,注射量为2 ml/kg(小鼠体重比),其余分组均在小鼠皮下注射 20% CCl4的香油溶液制备肝郁脾虚模型[7],注射量为2 ml/kg(小鼠体重比),每隔3 d注射1次,共3次,期间以高脂低蛋白饲料饲养并饮用10%乙醇溶液,于末次注射后次日开始,正常组、模型组小鼠灌胃蒸馏水10 ml/kg,柴胡组小鼠给予柴胡提取物1.3 g/kg,丹参组小鼠给予丹参提取物4.0 g/kg,五味子组小鼠给予五味子提取物4.5 g/kg,灵芝组小鼠给予灵芝提取物0.97 g/kg,连续给药10 d;同时各试验组小鼠同法同时给予注射CCl4溶液2 ml/kg,正常组皮下注射0.9%氯化钠,末次给药后小鼠禁食给水,12 h后眼眶采血、离心后取血清进行测定。
1.5 细胞培养及蛋白样品制备 HSC-T6细胞传代步骤参考文献操作[8]。接种HSC-T6细胞于培养瓶中,待细胞生长至约70%时,将细胞培养瓶分别命名为八组,依次为:对照组、TGF-β1组、PD98059(PD)组、PD98059+TGF-β1(PT)组、五味子组、丹参组、柴胡组、灵芝组。对照组与TGF-β1组分别加正常培养液,其余组分别加对应的药物提取物溶液0.1 g/L,继续培养24 h。除对照组和PD组外,其余各组于试验结束前12 h时加入TGF-β1溶液(10 μg/L)至试验结束。弃去培养上清后,培养瓶中加PBS,洗涤2次,弃除PBS后加入适量RIPA裂解液,4 ℃静置10 min后,吸取瓶内液体于EP管中,4 ℃条件下12000 r/min离心10 min、对各样品进行BCA定量。
1.6 Western blotting检测 调整上样量为35 μg/well,电泳和转膜参考高宇勤等操作进行[9],电泳完采用10%脱脂奶粉进行封闭,分别用α-SMA、COL-Ⅰ、ERK、p-ERK、TβRⅠ、TβRⅡ、Smad2/3一抗进行孵育(稀释比例为1∶1000),4 ℃过夜后,加入HRP耦连的二抗进行孵育(稀释比例为1∶3000),显影后计算表达量:蛋白表达量=试验组目的蛋白表达灰度值/TGF-β1组目的蛋白表达灰度值,TGF-β1组表达量记为1。
1.7 统计学方法 数据采用SPSS 9.0统计学软件进行分析,采用最小显著差异法(LSD),以P<0.05为差异有统计学意义。
2 结 果
2.1 四味中药对CCl4所致肝郁脾虚小鼠酶活性的作用 对CCl4小鼠肝郁脾虚模型,柴胡提取物明显降低肝郁脾虚小鼠血清和肝匀浆ALT、ALP酶活性和MDA,反映肝功能蛋白合成的CHE和GSH增加;丹参提取物明显降低小鼠血清和肝匀浆ALT、ALP酶活性和MDA,CHE和GSH含量增加。五味子提取物明显降低小鼠血清和肝匀浆ALT、ALP酶活性和MDA,反映肝功能蛋白合成的CHE和GSH增加。灵芝提取物增加小鼠血清和肝匀浆ALT、ALP酶活性,CHE和GSH含量增加,明显降低MDA含量。见表1。
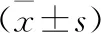
表1 四味中药对CCl4所致慢性肝损伤小鼠酶活性与自由基的影响
2.2 四味中药对TGF-β1诱导HSC-T6表达COL-Ⅰ、α-SMA蛋白的作用 TGF-β1诱导HSC-T6表达COL-Ⅰ、α-SMA明显增加,与对照组比较有统计学差异(P<0.05)。PD组与PT组能明显降低TGF-β1诱导的HSC-T6表达COL-Ⅰ,与TGF-β1组比较,有统计学差异(P<0.05),苦、寒柴胡或苦、微寒丹参,药性酸、甘、温的五味子,药性甘,平灵芝作用结果见图1。
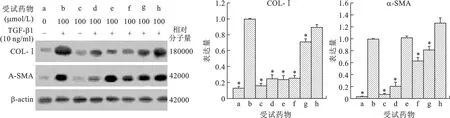
a:对照组;b:TGF-β1组;c:PD组;d:PD+TGF-β1组;e:五味子组;f:丹参组;g:柴胡组;h:灵芝组。
2.3 四味中药对TGF-β1诱导HSC-T6表达Ras、ERK、p-ERK蛋白的作用 TGF-β1诱导HSC-T6表达 Ras、ERK、p-ERK显著上调,与对照组比较,有统计学差异(P<0.05);PD98059能明显下调HSC-T6表达Ras,与TGF-β1组比较,有统计学差异(P<0.05),但对TGF-β1诱导HSC-T6表达Ras无影响;PD98059能明显下调TGF-β1诱导HSC-T6表达ERK、p-ERK(P<0.05)。苦、寒柴胡或苦、微寒丹参,药性酸、甘、温的五味子,药性甘,平灵芝作用结果见图2。

a:对照组;b:TGF-β1组;c:PD组;d:PD+ TGF-β1组;e:五味子组;f:丹参组;g:柴胡组;h:灵芝组。
2.4 四味中药对TGF-β1诱导HSC-T6表达TβRⅠ、TβRⅡ、Smad2/3的作用 TGF-β1诱导HSC-T6表达TβRⅠ、TβRⅡ、Smad2/3明显上调,与对照组比较,有统计学差异(P<0.05);PD组与PT组TβRⅠ、TβRⅡ、Smad2/3表达量明显下调,与TGF-β1组比较,有统计学差异(P<0.05);苦、寒柴胡或苦、微寒丹参,药性酸、甘、温的五味子,药性甘,平灵芝作用结果见图3。

a:对照组;b:TGF-β1组;c:PD组;d:PD+TGF-β1组 ;e:五味子组;f:丹参组;g:柴胡组;h:灵芝组。
3 讨 论
古代医学认为气是构成万物的本源[10],中医学认为任何疾病的发生发展过程都是致病因素(邪气)作用于人体,引起机体正邪斗争,导致阴阳气血偏盛偏衰或脏腑经络机能活动失常的结果[11]。中药药性是中药基本理论的核心,而升降浮沉为中药药性内容之一[12],中药之所以能够治愈疾病就是因为中药具有药性和性能的属性,四气是中药药性论的核心部分,即药物具有寒、热、温、凉。药性之寒凉属阴,温热属阳,以药性之寒热来纠正疾病表现出来的阴阳偏盛偏衰,寒凉药治疗热证,驱寒、温里、助阳药物治疗寒证的正治治疗原则[13],“广义”和“狭义”的药性均将四气、五味、升降沉浮等归入其范畴[14]。中药药性理论研究一直缺乏现代科学的阐述。本实验假设中药药性与其所含有效成分应满足一定的含量关系,则药性存在,否则药性会减弱甚至完全消失[15]。在我们以往实验中发现小鼠皮下注射CCl4引起的肝郁脾虚小鼠模型和TGFβ1诱导HSC-T6活化细胞模型,通过对模型相关指标的影响来探讨苦、寒柴胡,苦、微寒丹参,药性酸、甘、温的五味子,药性甘、平灵芝的作用。小鼠体内使用剂量均为10 g/kg(生药计)。体外细胞使用剂量依据是依据受试药物IC50来确定。整体试验显示药性苦、寒柴胡和苦、微寒丹参能对抗CCl4导致小鼠肝郁脾虚证,减轻肝细胞变性,促进肝细胞再生,恢复肝功能,抑制肝纤维组织增生确有一定生物效应。柴胡与丹参是两种不同的植物药,若中医药性论来分属性,两种属于苦、寒和苦、微寒药,在改善肝脏酶谱学指标苦寒属性柴胡和苦、微寒属性丹参没有质的区别。药性酸、甘、温五味子入肝经,在改善肝脏酶谱学上同样具有相同的作用效应,但药性与前二者不同,却有改善肝脏酶谱学指标效应,与药性论不同。而药性甘、平,灵芝除具有提高GSH清除自由基作用外,且无苦、寒药柴胡和苦、微寒药丹参上述作用,这与灵芝药性甘、平相吻。
生命基础物质是细胞,细胞膜上受体接受外部信号激动或静默细胞器活动。本实验选择的肝星状细胞是肝脏细胞外基质(Extracellular matrix,ECM)的主要来源,肝星状细胞的激活对肝郁脾虚的发生、发展起着关键作用,而TGF-β1是导致HSC活化的关键细胞因子之一[16-17],HSC通过激活Ras/ERK信号通路进一步导致Smad2、Smad3连接部位磷酸化,促进Smad3和Smad4复合体形成及转位入核,进而促进胶原的生成,干预ERK信号通路,可降低肝脏内胶原合成[18]。本实验采用TGF-β1诱导HSC-T6表达ERK和Smad信号通路蛋白,以ERK阻断剂PD98059为阳性对照,在细胞水平上探讨4味中药药性差异对HSC-T6信号通路蛋白表达所产生的影响。试验显示TGF-β1诱导HSC-T6表达Ras/ERK通路蛋白Ras、ERK、p-ERK明显增加,HSC-T6表达COL-Ⅰ含量平行性增加。PD98059(一种ERK磷酸化抑制剂)能显著降低HSC-T6表达Ras、ERK、p-ERK,不能拮抗TGF-β1诱导HSC-T6表达Ras、ERK,但可阻断TGF-β1诱导HSC-T6表达p-ERK,蛋白质的磷酸化才有可能具有激动蛋白信号的信号传导机制,HSC内p-ERK下降,COL-Ⅰ表达平行性降低,提示PD阻断Ras/ERK通路而降低COL-Ⅰ转录与合成。药性苦、寒柴胡和苦、微寒丹参对HSC-T6表达Ras、ERK无影响,但可明显降低p-ERK水平,同时COL-Ⅰ表达下降,显示苦、寒药和苦、微寒药具有抑制Ras/ERK通路中ERK磷酸化而降低COL-Ⅰ转录与合成。药性酸、甘、温的五味子提高HSC-T6表达Ras水平,可降低ERK和p-ERK水平而抑制COL-Ⅰ转录与合成,药性平、甘的灵芝提高HSC-T6内Ras和p-ERK表达水平。Ras是激活ERK蛋白而细胞激活,这与灵芝平、甘药性有关。试验显示TGF-β激活HSC-T6活化,其活化标志物α-SMA表达增加。TGF-β1/Smad通路蛋白TβRⅠ、TβRⅡ、Smad2/3表达增加。在TGF-β1/Smad信号传导通路中,TGF-β1先与TβRⅡ结合,形成的复合物再与TβRⅠ结合,磷酸化的Smad2、Smad3与Smad4形成异聚体复合物积聚核内选择性地促进靶基因转录[19-20]。试验发现ERK抑制剂PD可显著抑制HSC-T6和受TGF-β1激活的HSC-T6表达TβRⅠ、TβRⅡ、Smad2/3增加,提示PD对TGFβ1/Smad信号通路有抑制作用。PD的这种作用提示在HSC-T6内ERK与Smad信号传递途径存在相互调节,进而导致Smad2与 Smad3连接部位的磷酸化,最终促进Smad4和Smad3复合物形成及转化入核发挥HSC-T6活化COL-Ⅰ转录与合成的作用。试验显示药性苦、寒柴胡和苦、微寒丹参对TGF-β1激活HSC表达TβRⅠ、TβRⅡ和Smad有明显下调作用,两者无质的差异。药性酸、甘、温五味子对TGF-β1激活HSC表达TβRⅠ和Smad有明显下调作用,对TβRⅡ表达无影响。药性甘、平灵芝对TGF-β1激活HSC表达TβRⅠ、TβRⅡ和Smad有明显下调作用。试验结果显示药性苦、寒柴胡和苦、微寒丹参其化学成分完全不同,却产生相似抑制肝郁脾虚的作用,干预靶细胞内COL-Ⅰ转录与合成,其干预机制一致,药性酸、甘、温五味子与前二者药性不同而对TβRⅡ表达无作用,TβRⅡ是信号传递过程中关键蛋白, 显示五味子对TGF-β1/Smad信号通路作用不甚明显。药性甘、平灵芝出现与苦、寒相反的作用机制。本试验依据中药药性描述探讨影响机体生理变化和靶细胞内信号蛋白表达的意义,中药药性可宏观地反映药理作用关系,依据中药药性的描述,通过研究影响机体生理变化和靶细胞内信号蛋白表达的意义,探讨不同药性的药理学作用机制,辨证地为广义的中药药性赋予了药理学科学内涵。中药药性是中医临床治疗疾病的原则,不同药性对机体生理效应不同,在中医临床实践中有一定的指导意义。

