中性粒细胞胞外诱捕网形成的分子机制及其在脓毒症中病理作用的研究进展
郑大勇,张天翼,林源希,李真玉,3,宗晓龙(通信作者)
1 天津医科大学宝坻临床学院 (天津 301800); 2 天津医科大学第二医院重症医学科(天津 300211); 3 天津心脏病学研究所 (天津 300211); 4 天津医科大学第二医院检验科 (天津 300211)
2004年,Brinkmann 等[1]应用佛波酯(phorbol myristate acetate,PMA)、白细胞介素-8(interleukin-8,IL-8)和脂多糖(lipopolysaccharides,LPS)刺激中性粒细胞后,观察到一种释放至胞外的DNA 网状结构,即中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。此后,众多的刺激物如细菌、真菌、活化的血小板、免疫复合物(immune complex,IC)以及高迁移速率族蛋白(high mobility group box 1,HMGB1)等损伤相关模式分子(damage-associated molecular patterns,DAMPs)被陆续报道能够诱导NETs 形成[2]。NETs 与脓毒症存在密切联系,一方面在脓毒症进程中病原相关模式分子(pathogen-associated molecular patterns,PAMPs)和DAMPs 分子谱是诱导NETs 形成的潜在激活物[3-4],另一方面NETs 通过多种途径参与脓毒症发病机制。近年来,越来越多的研究提示NETs 是治疗脓毒症患者及其相关器官功能障碍的潜在靶点[5]。现对NETs 形成的分子机制及其在脓毒症中病理作用的研究进展进行综述。
1 NETs 形成的分子机制
1.1 NETs 形成的上游调控
天然免疫是机体抵御感染的第一道防线,中性粒细胞是人体内数量最多的先天免疫细胞,其主要通过吞噬或释放NETs 的方式清除病原微生物[6]。虽然吞噬与释放NETs 都能实现对病原体的捕杀,但两者的免疫效应机制截然不同。吞噬过程依赖于细胞骨架完整,而NETs 形成伴随着细胞骨架破坏。此外,吞噬过程将髓过氧化物酶(myeloperoxidase,MPO)、弹性蛋白酶(neutrophil elastase,NE)和吞噬底物共同包被于吞噬小体,以实现对病原体的杀灭,而MPO、NE由胞浆入核驱动染色质解聚是NETs 形成的关键环节[7]。
面对病原微生物入侵,中性粒细胞在吞噬与释放NETs 之间做出何种响应,以及调控这种选择的机制尚不明确。Branzk 等[8]的研究发现,病原体体积是影响这一过程的重要因素,中性粒细胞感受体积较大的病原体(如真菌菌丝)刺激后倾向于释放NETs,而对于细菌和酵母等小体积病原体则优先启动吞噬作用;进一步的机制研究发现,中性粒细胞模式识别受体树突状细胞相关性C 型凝集素受体-1(dendritic cell-associated C-type lectin-1,Dectin-1)在介导吞噬作用的同时能够抑制NE 入核,敲低Dectin-1后NETs 生成水平显著上调。脓毒症免疫失调在细胞水平表现为淋巴细胞减少和未成熟中性粒细胞增多[9]。Taneja 等[10]发现脓毒症患者外周血未成熟中性粒细胞吞噬功能和钙通道受损,而Ca2+内流在NETs 形成中发挥重要作用,因此,推测未成熟中性粒细胞倾向于优先形成NETs。与之类似,Abrams 等[11]最近通过体外诱导实验发现,脓毒症患者中性粒细胞形成NETs 水平高于对照组,且NETs 生成水平与弥散性血管内凝血发生率和全因死亡率相关。
1.2 NETs 形成的胞内信号传导
NETs 形成过程涉及胞内一系列分子事件,其中活性氧(reactive oxygen species,ROS)发挥核心作用。中性粒细胞感受内外源刺激后,以NADPH 氧化酶(NADPH oxidase,NOX)依赖或NOX 非依赖的方式产生ROS 蓄积于胞浆,诱导细胞骨架重排[7],同时破坏核膜与颗粒膜的完整性;颗粒酶MPO、NE 释放并入核,导致组蛋白水解、染色质解聚,肽酰基精氨酸脱亚胺酶4(protein-arginine deiminase type 4,PAD4)修饰组蛋白瓜氨酸化协同参与染色质解聚[12];最终,在NE 和消皮素D(gasdermin D,GSDMD)作用下细胞膜破裂[13],染色质与胞浆颗粒酶外排并通过静电力聚集于胞外,形成具有杀菌活性的NETs(见图1)。
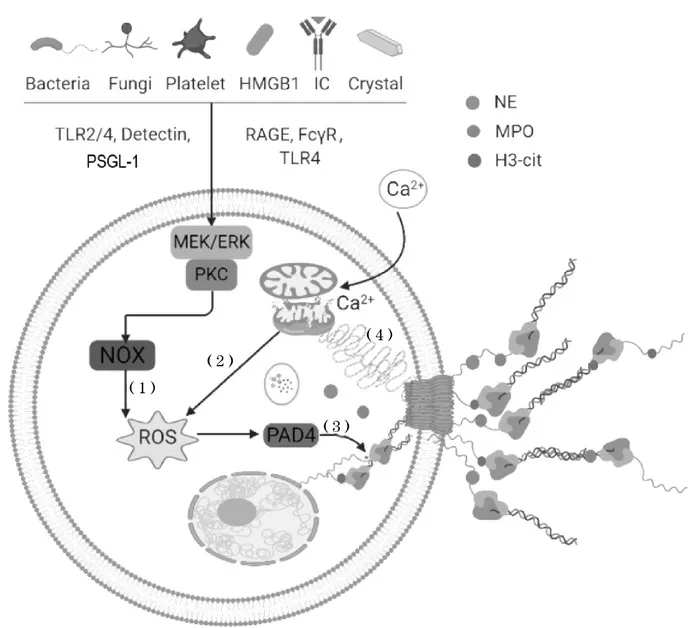
图1 NETs 形成的分子机制
NOX 依赖的NETs 形成途径是最早被发现且研究较为完善的通路,PMA、细菌、LPS、真菌、活化血小板、IL-8、IC 等众多刺激物均能经NOX 途径诱导NETs 形成。NOX 活化释放ROS 是该途径的核心环节,但不同刺激物激活NOX 的上游机制有所不同。PMA 经纤维肉瘤蛋白(rapidly accelerated fibrosarcoma,Raf)/丝裂原活化的细胞外信号调 节 激 酶(mitogen-activated extracellular signal regulatedkinase,MEK)/细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)通路激活NOX[14],而LPS 激活NOX 依赖Toll 样受体4(toll-like receptor 4,TLR4)和c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)的参与[15]。
NOX 非依赖的NETs 形成途径是近年发现的一种以线粒体释放ROS 为核心的全新机制,该过程中线粒体代替NOX 提供ROS 来源[16]。Ca2+通道与NOX 非依赖的NETs 形成密切相关,离子霉素作为Ca2+载体能够以NOX 非依赖性的方式诱导NETs 形成[16]。同时,PAD4诱导组蛋白瓜氨酸化、驱动染色质解聚是NOX 非依赖途径的必需环节[16]。
目前并不清楚在体内病生理条件下,中性粒细胞主要通过上述哪种途径释放NETs,抑或两者协同介导NETs 形成。Lood 等[17]的研究中通过通路抑制实验发现,来源于系统性红斑狼疮(systemic lupus erythematosus,SLE)患者中性粒细胞在IC 刺激下,单纯激活NOX 不足以启动NETs 释放,而激活线粒体释放ROS 能够显著提高NETs 水平,表明线粒体源ROS 在某些情况下是NETs 形成所必需的。后续研究应加强对特定病理条件下NETs 形成机制的解析,这不仅有助于理解不同NETs 形成机制的病理生理意义,还有助于指导精确靶向NETs 治疗。
1.3 NETs 释放与细胞命运结局
早期研究认为NETs 是中性粒细胞“自杀式”的免疫应答,在细胞坏死后几个小时,随着核膜和浆膜破裂,染色质DNA 以云雾状释放至胞外形成NETs[18]。后续研究进一步在分子水平建立了NETs 与细胞死亡的联系。受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)、RIPK3和混合谱系激酶结构域样蛋白(mixed-lineage kinase domain-like protein,MLKL)是介导细胞坏死性凋亡的关键原件,Schreiber 等[19]和Desai 等[20]发现PMA、尿酸结晶和抗中性粒细胞胞浆抗体能够以RIPK1/3-MLKL 信号依赖的方式诱导NETs 形成,但同时有研究指出敲除RIPK3基因或药物抑制MLKL 虽然能够抑制坏死性凋亡,但并不影响NETs 释放[21]。最近Amini 等[22]发现,PMA 刺激中性粒细胞几分钟后线粒体DNA 即可释放,而延长刺激时间会导致细胞死亡,提示NETs 形成与细胞死亡是不同机制驱动的不同过程。
实际上,已有多项研究报道细胞死亡并不是中性粒细胞释放NETs 后的唯一结局[23-25]。2009年,Yousefi 等[23]发现中性粒细胞经粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)和LPS 或补体C5a 刺激后能够释放线粒体DNA 形成NETs,但其生命周期并未改变。2010年,Pilsczek 等[24]发现金黄色葡萄球菌的杀白细胞毒素能够诱导中性粒细胞细胞核形成小泡,这些小泡释放至胞外形成NETs,此过程进展迅速且不依赖NOX 激活和细胞膜破裂。2012年,Yipp 等[25]观察到中性粒细胞释放NETs 后仍保有趋化和吞噬能力。以上报道提示NETs 形成和细胞死亡是不同机制调控的两种不同的细胞活动。
2 NETs 的体内清除
NETs 具有清除感染的作用,而过量的NETs 蓄积会导致组织损伤,因此,NETs 的及时清除对于维持组织稳态至关重要。研究发现,脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNase Ⅰ)和巨噬细胞在NETs 清除过程中发挥关键作用。DNase Ⅰ能够水解DNA 骨架,将网状NETs 降解为巨噬细胞能够吞噬的碎片底物[26]。DNase Ⅰ活性受限或巨噬细胞吞噬能力降低,体内NETs 蓄积,已被证明与狼疮性肾病、脓毒症性血栓以及急性呼吸窘迫综合征(acute respiratry distress syndrme,ARDS)密切相关,应用人工重组DNase 或重塑巨噬细胞对NETs 的吞噬能力,为这些疾病的治疗提供了全新思路[27-28]。
3 NETs 在脓毒症中的病理作用
尽管驱动NETs 形成的机制是多样的,其伴随的细胞结局也不尽相同,但NETs 的化学本质均是以DNA 为骨架,粘附有多种颗粒蛋白的网状复合物。NETs 组份的多样性为其发挥杀菌作用提供了物质基础,同时也为其产生广泛的病理作用埋下了隐患。
3.1 调节炎症反应
动物研究发现,脓毒症小鼠NETs 水平上调,注射重组人脱氧核糖核酸酶(recombinant human deoxyribonuclease,rhDNase)加速NETs 降解,能够降低趋化因子、IL-6、HMGB1水平,减少组织损伤和病死率[29]。NETs 的促炎机制可以是直接的,也可以通过调节其他免疫细胞间接实现。NETs 组份DNA 和组蛋白能够作为DAMPs 分子,直接启动或放大炎症反应[3]。Warnatsch 等[30]发现NETs 经TLR2或TLR4诱导巨噬细胞IL-6和pro-IL-1β 转录水平上调,加速动脉粥样硬化进展。与之类似,国内Song 等[31]最近发现NETs 能够诱导肺组织巨噬细胞向促炎的M1型极化,从而加重肺损伤。同时,Schauer 等[32]发现NETs 粘附的水解蛋白酶能够降解细胞因子和趋化因子,从而缓解局部炎症[32]。这种局部抗炎作用在脓毒症系统性炎症反应中是否同样发挥关键作用,有待进一步探讨。
3.2 诱发凝血功能紊乱
凝血功能紊乱是脓毒症的典型病理特征,NETs 的促栓机制是多样的[33]。首先,NETs 巨大的网状结构为其发挥血管占位作用提供了先天条件;其次,NETs 成份组蛋白H3/H4能够经接触途径激活凝血级联反应以及组织因子依赖的凝血酶生成,同时NE 和MPO 抑制抗凝蛋白组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)和血栓调节蛋白(thrombomodulin,TM);此外,NETs 可以激活血小板,形成血小板与中性粒细胞交互作用的正反馈调节网络[34]。
血小板与中性粒细胞协同作用诱导NETs 形成已被证实与血栓、自身免疫病、肿瘤等多种疾病密切相关[35]。血小板和中性粒细胞在外周循环中数量丰富,脓毒症肺损伤时两者共同聚集于肺组织[36],为两者相互作用提供了空间条件,而血小板本身能够作为调控NETs 形成的上游元件[37]。肝素/低分子肝素是ICU 最常用的预防性抗栓药物,肝素诱导性血小板减少症(heparin induced thrombocytopenia,HIT)是困扰临床的药物不良反应。既往认为HIT 是IC 介导的血小板消耗性减低伴发血栓并发症。新近一项关于NETs 与HIT的研究带来了HIT 概念上的突破,该研究发现,NETs 是HIT 伴发血栓形成的关键因素,且NETs 的这种促栓作用并不完全依赖于血小板的参与[38]。
3.3 介导组织损伤
NETs 具有细胞毒性,在体外能够直接杀伤内皮细胞和上皮细胞,体内过量的NETs 蓄积导致上皮组织和内皮组织损伤[39]。组蛋白通过破坏细胞膜发挥细胞毒作用[40],其他NETs 成份如防御素和NE 能够水解细胞间基质蛋白,导致细胞间连接破坏[41]。肺血管内皮屏障损伤是ARDS 的核心发病机制,血管内皮细胞钙粘连蛋白(vascular endothelial cadherin,VE-cadherin)是构成肺血管内皮粘附连接的核心蛋白,血清VE-cadherin 水平对脓毒症ARDS 具有预测价值和预后意义[42]。已经有研究建立了NETs 上调与VEcadherin 分子重排的联系[43],后续研究应深入对该过程调控机制以及潜在干预靶点的探讨。
4 靶向NETs 治疗脓毒症
随着临床前研究证据的积累,NETs 有望成为治疗脓毒症的全新靶点。总的来说,靶向NETs 策略可分为抑制NETs 形成、加速NETs 降解以及拮抗NETs 毒性成份3方面。
DNase 是一类能够消化DNA 的核酸内切酶,体内DNase Ⅰ和DNase Ⅲ是降解NETs 的重要成份[28],人工重组DNase Ⅰ已被临床用于治疗囊性纤维化。DNase 能够降解NETs 的DNA 骨架,动物水平研究显示,注射rhDNase 能够改善肺损伤,降低病死率[44]。国内Li 等[45]发现,抗瓜氨酸化组蛋白H3抗体能够提高盲肠结扎穿孔术(cecal ligation and peferation,CLP)模型小鼠的生存率。NE 是强效的蛋白水解酶,应用NE 抑制剂能够降低脓毒症肾损伤风险[46]。
循环DNA 和组蛋白不仅来源于NETs,也可能源自坏死的组织细胞,因此,靶向抑制NETs 形成的上游环节是更加特异的策略。PAD4在驱动染色质解聚环节发挥关键作用,PAD4脱氨活性抑制剂(Cl-amidine)能够特异性抑制PAD4的活性。脓毒症造模前预注射Cl-Amidine 能够抑制体内H3瓜氨酸化和NETs 水平,提高模型动物生存率[47]。重要的是,Martinod 等[48]发现敲除PAD4基因在抑制NETs 形成的同时并不影响CLP 模型小鼠体内细菌荷载量增加,提示PAD4可能是比较安全的干预靶点。
5 总结与展望
NETs 是中性粒细胞发挥免疫防御功能的重要方式,而过量的NETs 会产生广泛的病理作用。NETs 的形成机制复杂多样,NETs 组份中DNA 的来源、NETs 与细胞死亡的联系和区别、不同NETs 形成机制在生理病理条件下如何调控并发挥作用等问题,有待后续研究阐明。NETs 参与脓毒症及其相关器官功能障碍的发病机制,靶向NETs 是治疗脓毒症的潜在策略。然而,在脓毒症复杂病理条件下,驱动NETs 形成的关键上游机制仍不明确,加之NETs 本身具有清除感染和局部抗炎的作用,因此,干预靶点以及干预时机的选择和评价,是实现基础向临床转化前需要解决的关键问题。

