系统性炎症指数在冠心病中的临床意义及诊断价值研究*
李梦兰,梁 宾,曹树正,季明德
1.南京中医药大学附属医院/江苏省中医院检验科,江苏南京 210000; 2.武汉大学中南医院检验科,湖北武汉 430000;3.武汉亚洲心脏病医院检验科,湖北武汉 430000
冠心病(CAD)是一组由于冠状动脉血管发生粥样硬化病变,造成心肌缺血缺氧甚至坏死的一类心脏病,其发病率逐年升高[1]。按常见的临床表型可将CAD分为稳定型心绞痛(SAP)、不稳定型心绞痛(UA)、非ST段抬高型心肌梗死(NSTEMI)及ST段抬高型心肌梗死(STEMI)4种类型[2]。研究表明,炎性反应伴随着冠心病发生、发展的全过程[3]。而外周血白细胞作为天然免疫系统的主要成员,在炎性反应中发挥着重要的作用[4]。基于白细胞亚型计数的新型系统性炎症指数,特别是中性粒细胞与淋巴细胞的比值(NLR)、血小板与淋巴细胞比值(PLR)、单核与淋巴细胞比值(MLR)能够更加全面地反映机体的炎症水平,已被证实与多种心血管疾病的发生、发展及预后密切相关[5-6]。本研究主要分析了3个系统性炎症指数NLR、PLR、MLR在CAD不同临床表型中的水平变化,以及其与冠状动脉病变严重程度的相关性,旨在明确其在CAD中的临床意义及诊断价值。现报道如下。
1 资料与方法
1.1一般资料 纳入2017年3月至2018年3月就诊于武汉亚洲心脏病医院及武汉大学中南医院的311例CAD患者作为CAD组。CAD组的纳入标准为冠状动脉造影结果,即冠状动脉主要血管及其分支狭窄程度超过50%。排除标准:(1)先天性心脏病、心肌桥等严重非冠状动脉性心血管疾病;(2)系统性急慢性感染或炎症性疾病;(3)患有恶性肿瘤;(4)自身免疫性疾病;(5)合并肝、肾功能不全等。按照患者的临床症状和体征、心肌酶学检查、心电图、心脏彩超、心肌核素显像等结果,将CAD组进一步分为SAP组39例、UA组67例、NSTEMI组103例、STEMI组102例。选取同期在武汉大学中南医院体检健康者209例为对照组。CAD组中,男225例,女86例;年龄(60.5±10.9)岁;体质量指数(25.1±3.6)kg/m2;吸烟史182例;饮酒史76例;高血压史190例;高脂血症史60例;糖尿病史83例;Gensini评分46.00(27.25,76.50)分。对照组中,男150例,女59例;年龄(61.9±9.4)岁;体质量指数(24.3±1.9)kg/m2;吸烟史59例;饮酒史34例;高血压史66例;高脂血症史25例;糖尿病史32例。两组研究对象的性别及年龄差异无统计学意义(P>0.05),具有可比性。所有研究对象自愿参与并签署知情同意书。
1.2方法 收集研究对象的年龄、性别、体质量指数、糖尿病史、高脂血症史、高血压史、吸烟史及饮酒史等临床资料。采集患者入院24 h内的乙二胺四乙酸抗凝血2 mL,由武汉大学中南医院检验科采用临床常规方法进行血常规检测,根据中性粒细胞、淋巴细胞、单核细胞和血小板计数,计算系统性炎症指数NLR、PLR及MLR,采用Gensini评分法对冠状动脉病变严重程度进行评估[7]。

2 结 果
2.1各组NLR、PLR、MLR比较 与对照组比较,CAD组NLR、PLR、MLR明显升高(P<0.001);且NLR、PLR、MLR在SAP组、UA组、NSTEMI组及STEMI组中呈现逐渐升高的趋势。见图1。
2.2CAD组NLR、PLR、MLR与Gensini 评分相关性分析 CAD组NLR(r=0.139,P=0.018)、PLR(r=0.135,P=0.025)、MLR(r=0.122,P=0.036)水平与Gensini评分呈正相关,即随着CAD患者病情严重程度增加,NLR、PLR及MLR逐渐升高。

注:A为CAD组与对照组NLR水平比较;B为CAD组与对照组PLR水平比较;C为CAD组与对照组MLR水平比较;D为SAP组、UA组、NSTEMI组、STEMI组NLR水平比较;E为SAP组、UA组、NSTEMI组、STEMI组PLR水平比较;F为SAP组、UA组、NSTEMI组、STEMI组MLR水平比较。
2.3Logistic回归分析 单变量Logistic回归结果显示,NLR、PLR、MLR可作为CAD的独立风险因素(P<0.05)。在利用多元Logistic回归校正年龄、性别、体质量指数、吸烟史、饮酒史、高血压史、糖尿病史、高脂血症史混杂因素后,随着 NLR、PLR、MLR的水平每增加一个单位,CAD的发病风险分别增加1.600倍(调整后OR为2.600,95%CI:2.035~3.323)、0.020倍(调整后OR为1.020,95%CI:1.015~1.026)和1.342倍(调整后OR为2.342,95%CI:1.868~2.936),见表2。
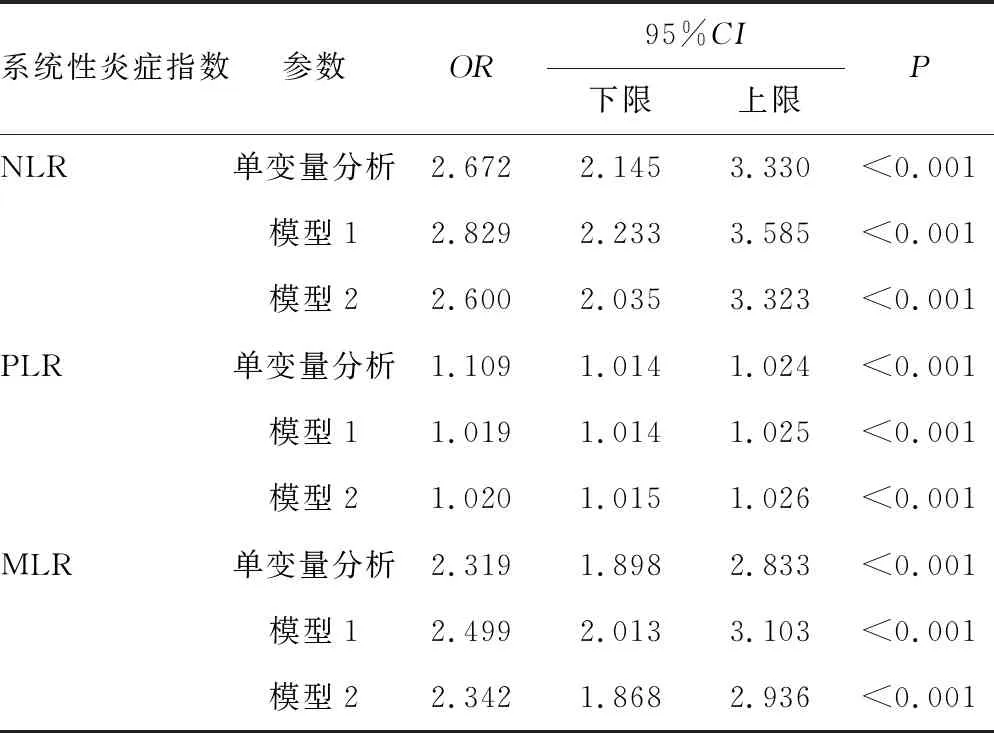
表2 NLR、PLR、MLR作为CAD独立影响因素的Logistic回归分析
2.4NLR、PLR、MLR单项及联合检测诊断CAD的ROC曲线分析 NLR诊断CAD的ROC曲线下面积(AUC)为0.814(95%CI:0.778~0.850),特异度和灵敏度分别为0.890(95%CI:0.840~0.929)、0.637(95%CI:0.581~0.690);PLR诊断CAD的AUC为0.717(95%CI:0.673~0.761),特异度和灵敏度分别为0.617(95%CI:0.548~0.683)、0.736(95%CI:0.684~0.785);MLR诊断CAD的AUC为0.763(95%CI:0.722~0.804),特异度和灵敏度分别为0.684(95%CI:0.617~0.747)、0.727(95%CI:0.674~0.776)。三者联合诊断CAD的AUC为0.819(95%CI:0.783~0.854),特异度和灵敏度分别为0.890(95%CI:.840~0.929)、0.633(95%CI:0.577~0.687),见图2。

图2 NLR、PLR、MLR单项及联合检测诊断CAD的ROC曲线
3 讨 论
CAD作为一种动脉粥样硬化性疾病,发病率逐年升高并有年轻化趋势。研究发现,长期大量的慢性炎症可能是CAD的残余风险[8]。例如,C反应蛋白作为机体内炎性反应的重要下游标志物之一,其水平的升高预示着心血管不良事件的发生风险增加[9-10]。RIDKER等[11]的研究发现,若C反应蛋白水平降至2 mg/L,心血管疾病的病死率能够下降31%。此外,外周血白细胞及其亚型也是反映机体炎症状态的经典标志物,NLR、PLR、MLR作为新兴的炎症指数,较传统指标能够更加全面地反映机体炎症状态。目前,NLR、PLR、MLR已被证实与糖尿病并发动脉硬化、心肌梗死等疾病的发生发展密切相关[12]。这些基于血液学的炎症标志物在临床上能够被常规检测,可为医生评估患者病情提供及时、客观的信息。
本研究发现,NLR、PLR、MLR在CAD组水平明显高于对照组,在SAP组、UA组、NSTEMI组及NTEMI组中呈现逐渐升高的趋势,且与反映CAD严重程度的指标Gensini评分呈正相关。有研究表明,动脉粥样硬化斑块的形成是CAD的典型病理特征,慢性炎性反应在此过程中发挥重要作用[13]。动脉血管内皮细胞损伤后引起中性粒细胞大量聚集,并释放肿瘤坏死因子-α(TNT-α)、白细胞介素(IL)-6等炎症因子,促进单核细胞黏附于内皮下,并逐渐分化为巨噬细胞,后者通过吞噬氧化型低密度脂蛋白进一步加速粥样斑块的形成[14-15]。血管内皮细胞功能障碍时,血小板被暴露的胶原和炎症介质迅速激活,黏附于血管受损部位,并与炎性细胞相互作用,进一步加速粥样斑块的发展、扩大乃至破裂,而此时免疫系统受到抑制,淋巴细胞水平降低[16-17]。粥样斑块缓慢演变的过程在临床上常表现为SAP,由于斑块的进一步破裂及血栓形成使其在临床上逐渐发展为UA、NSTEMI或STEMI[18]。因此,中性粒细胞、单核细胞、血小板高水平及淋巴细胞水平低水平与CAD的进程及严重程度密切相关,系统性炎症指数以比值的形式较单一计数能更全面地反映机体的炎症水平,可作为评估CAD发生、发展的潜在风险指标。尽管SAP、UA、NSTEMI和STEMI组的NLR、PLR、MLR呈逐渐增高的趋势,但并不是所有组间差异都有统计学意义,因此还需要大样本的数据来证实这一结论。此外,笔者还发现NLR、PLR、MLR三者联合诊断CAD的AUC为0.819,特异度为0.890,较单项指标具有更好的诊断预测价值。因此,临床上实时监测NLR、PLR、MLR有助于评估患者的炎症状态,减少CAD不良事件的发生,降低患者病死率。
综上所述,系统性炎症指数NLR、PLR、MLR与CAD严重程度呈正相关,可作为CAD的独立影响因素,三者联合检测对CAD具有良好的诊断和监测价值,对预防不良心血管事件的发生具有重要意义。

