加热灭活对下呼吸道病毒抗原检测结果影响的初步研究*
冯星星,陈俊伶,王艳春,贺晓丽
昆明市儿童医院/云南省儿童重大疾病研究重点实验室:1.检验科; 2.感染二科;3.云南省儿科研究所,云南昆明 650028
儿童呼吸道感染是临床上常见的儿科疾病,其中病毒是引起婴幼儿发生急性下呼吸道感染的最主要病原体[1],基层医院常用的检测方法为直接免疫荧光法(DFA),该方法操作简单,在基层医院广泛开展[2];但该方法在处理标本时可能具有潜在的病毒生物安全危害[3]。同时,自新型冠状病毒肺炎疫情暴发以后,国家卫生健康委员会要求,感染性材料或活病毒在采用可靠的方法灭活后再进行抗原检测[4]。因此找到一种简单、有效灭活病毒的标本前处理方法,降低检验人员感染风险很重要。参考有关严重急性呼吸综合征灭活效果的文章[5-7],加热是灭活病毒简单有效的方法。因此,本研究通过对下呼吸道痰液标本分别通过未灭活和加热灭活后行DFA检测,比较灭活前后呼吸道病毒抗原检测结果,探索标本加热灭活前处理,以期寻找提高实验室生物安全保障的方法,现初步研究报道如下。
1 资料与方法
1.1一般资料 收集2020年1月5日至4月29日昆明市儿童医院住院部经临床确诊为急性呼吸道感染、急性喘息性支气管炎、急性扁桃体炎、急性支气管炎、急性肺炎和急性重症肺炎的64例患儿,其中男41例,女23例;年龄为11 d至10岁。
1.2仪器与试剂 7项呼吸道病毒检测试剂盒(免疫荧光法)为上海贝西生物科技有限公司的产品。检测项目有甲型流感病毒(IFA)、乙型流感病毒(IFB)、副流感病毒1型(PIV1)、副流感病毒2型(PIV2)、副流感病毒3型(PIV3)、呼吸道合胞病毒(RSV)、腺病毒(ADV),包括荧光素标记的单克隆抗体7种(RSV、ADV、IFA、IFB、PIV1、PIV2、PIV3),浓缩洗涤磷酸盐缓冲液(40×),封闭液,抗原对照玻片,另外需配备冷丙酮。所用仪器为奥林巴斯BX65荧光显微镜和可调控温度水浴箱。
1.3标本采集 患儿入院后由专业护士用一次性吸痰管抽吸痰液1.0~2.0 mL置于无菌培养管中,不得倾斜或颠覆,标本采集后2 h内送检。
1.4操作方法
1.4.1标本处理 检验员按个人三级生物防护要求穿戴防护用品,在生物安全柜内将临床采集痰液标本分成5份,一份不加热灭活,直接用于常规7项呼吸道DFA检测,另外4份分别于56 ℃、30 min,56 ℃、60 min,60 ℃、30 min,70 ℃、15 min在水浴箱中水浴灭活后再进行常规7项呼吸道病毒抗原DFA检测的常规操作。
1.4.2操作步骤 未灭活和加热灭活后的痰液标本中加入磷酸盐缓冲液5~10 mL,在涡旋混匀器上轻微混匀,以1 500 r/min离心5 min,去除上清液留取沉淀,再用磷酸盐缓冲液洗涤沉淀1~2 次,最后将沉淀液溶解在0.5~1.0 mL磷酸盐缓冲液中,吸管轻轻吹打使其成为细胞悬液,移液器吸取25 μL细胞悬液于玻片上点样共7点,分别用于检测RSV、ADV、IFA、IFB、PIV1、PIV2,PIV3。玻片空气中室温干燥后,冷丙酮固定10 min,取出晾干。玻片上每个细胞点加1滴相应的荧光抗体,必须完全覆盖待测标本,将载玻片放在湿盒中置于37 ℃培养箱孵育30 min,反应时间到后,用事先配制好的磷酸盐缓冲液浸泡洗涤。晾干后用封闭液封片,盖上盖玻片,于荧光显微镜下观察。
1.4.3检测结果判断 以200倍视野见到≥2个苹果绿荧光细胞为阳性,否则为阴性。试剂盒提供的阴性对照/阳性对照处理同标本处理流程。合格的标本要求在放大倍数为200倍下,每个视野至少有2个上皮细胞。阴性结果为至少含有20个柱状上皮细胞的标本中无荧光染色。如果标本中上皮细胞数量<20个则为标本不合格,应重新采样再进行检测。
1.5统计学处理 采用SPSS17.0软件进行数据处理与统计分析,计数资料以频数或百分率表示,未灭活和加热灭活方法之间的比较采用R×C或配对χ2检验,以P<0.05为差异有统计学意义。一致性检验计算Kappa值,当Kappa值<0.50时一致性较差,0.50~0.75为一致性较好,>0.75时表示有极好的一致性。
2 结 果
2.1未灭活常规方法检测标本同加热灭活后标本结果比较 64份下呼吸道感染标本中,未灭活常规方法检出至少一种病原体阳性39份,检出率为60.9%(39/64),其中RSV阳性标本检出最多,为23份(35.9%),其次检出PIV3阳性11份(17.2%),ADV阳性2份(3.1%),PIV1 2份(3.1%),IFA 2份(3.1%),其中1份标本为RSV和PIV3两种病毒混合感染。以未灭活常规DFA检测结果为准,在未灭活常规方法呈阳性结果的39份标本中,经56 ℃、30 min,56 ℃、60 min,60 ℃、30 min,70 ℃、15 min加热灭活后均检测为阳性,不同温度时间加热灭活后的阳性符合率均为100.0%(39/39),未灭活常规方法呈阴性结果的25份标本中,4种方法加热灭活后均为阴性,阴性符合率为100.0%(25/25),总符合率为100.0%(64/64),加热灭活同未灭活常规检测方法一致性极好(Kappa=1.000),且检出结果差异无统计学意义(P>0.05)。
2.2未灭活标本同加热灭活后标本荧光显微镜下形态比较 DFA检测呼吸道病毒抗原在56 ℃、30 min,56 ℃、60 min,60 ℃、30 min加热后同未灭活常规方法比较,阳性细胞荧光状态、阳性细胞数基本一致,没有明显差异,见图1。70 ℃、15 min加热后比较,阳性细胞数减少明显、阳性细胞荧光强度可见明显下降,背景无黏液丝干扰,荧光滴度明显下降,见图2。
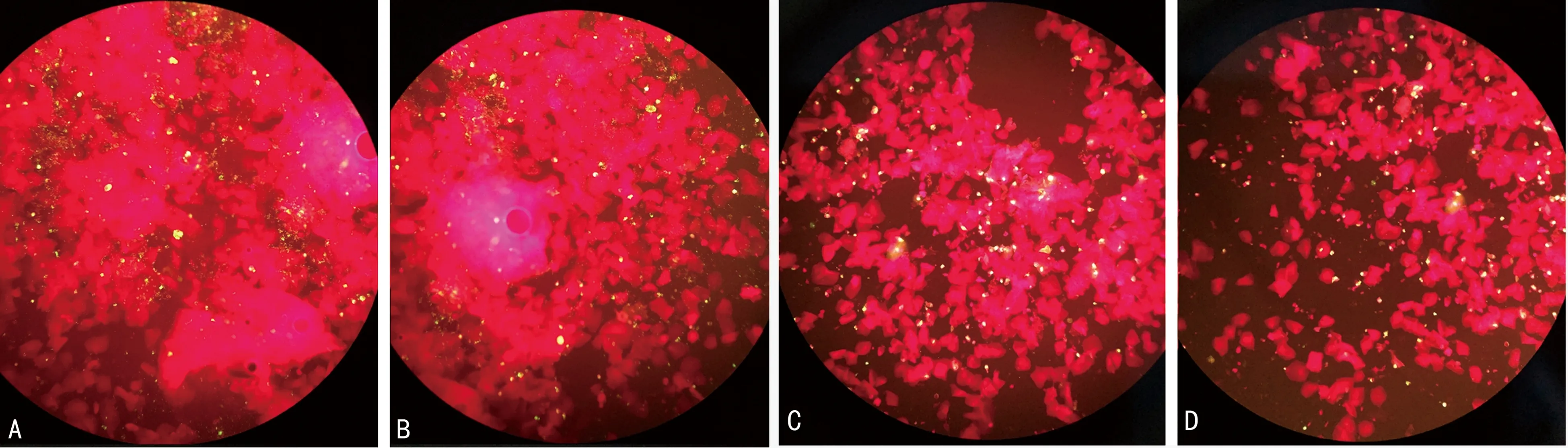
注:A为未灭活,B为56 ℃、30 min,C为56 ℃、60 min,D为60 ℃、30 min。
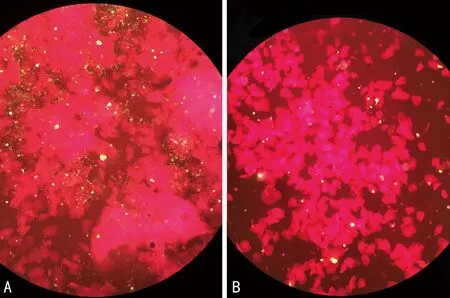
注:A为未灭活,B为70 ℃、15 min。
3 讨 论
急性呼吸道感染是导致小儿发病和死亡的一个重要原因,其中绝大多数感染由病毒引起,由于这些病毒感染的临床表现和流行特点相似,难以用临床症状和常规检测方法进行病原鉴定区分[8],所以对于引起呼吸道感染的病原体的早期鉴别诊断十分重要,及早干预、诊断与治疗,可以降低急性呼吸道感染的发病率及病死率[9]。研究表明,采用DFA检测7种呼吸道病毒抗原,特异度及灵敏度较高,能为小儿呼吸道病毒感染的早期诊断提供依据[10],但是由于该方法采用的试验标本为鼻咽拭子或下呼吸道灌洗液标本,所以在试验处理标本过程中可能会出现生物安全危害,感染检验人员,所以下呼吸道标本的安全处理在实验室生物安全防护上显得尤为重要。新型冠状病毒肺炎疫情暴发以来,对新型冠状病毒的检测也给实验室生物安全带来巨大风险,《新型冠状病毒肺炎诊疗方案(试行第八版)》指出冠状病毒对紫外线和热敏感[11],因此本研究采用56 ℃、30 min,56 ℃、60 min,60 ℃、30 min,70 ℃、15 min加热灭活前处理标本,并同未灭活常规方法检测标本进行比较,结果表明,加热灭活后标本阳性符合率、阴性符合率具有极好的一致性(Kappa=1.000),两者检测结果差异无统计学意义(P>0.05)。
加热是灭活病毒的简单有效的方法,该方法不加入任何化学试剂,依靠控制温度和时间,破坏病毒的高级结构,使其蛋白不再具有生理活性,从而失去感染、致病和繁殖能力[12]。在检验科实际工作中,涉及灭活标本为痰液标本的研究,更多关注的是加热灭活对流感病毒核酸[13]、新型冠状病毒核酸检测[14]能力的影响,以及加热灭活对分子生物学技术检测结果影响的相关研究,但分子技术对实验室条件设备、仪器、人员素质要求较高,并不适用于基层医院开展,而对于广大基层医院普遍开展的DFA检测下呼吸道病毒抗原加热灭活的研究鲜见相关报道。检验科实验室在采用DFA处理标本时,需要预防标本中存在的致病病毒可能带来的生物安全危害[15]。目前,冠状病毒理化特性多参考关于严重急性呼吸综合征(SARS)病毒的研究,鄢心革等[5]研究指出,56 ℃下,60 min比30 min具有更好的灭活效果,30 min灭活效率为99.99%,60 min对SARS病毒灭活效率为100.00%,因此为防止灭活不彻底,笔者不推荐标本进行56 ℃、30 min加热灭活处理。该文同时指出,灭活时间增加会导致SARS病毒抗原性降低,过长时间的灭活也会增加检验报告时间,因此笔者也不推荐标本56 ℃、60 min加热灭活处理。鲍作义等[7]报道,经过70 ℃、15 min加热灭活的标本检测不出活SARS病毒。由于DFA检测在结果判断上依赖技术人员的主观判断,因为本研究由高职称技师在荧光显微镜下进行形态比较,结果表明,阳性结果标本采用56 ℃、30 min,56 ℃、60 min,60 ℃、30 min加热灭活后与未灭活前比较,阳性细胞荧光状态、阳性细胞数基本一致,而采用70 ℃、15 min加热灭活后,阳性细胞数减少明显、阳性细胞荧光强度显著下降,会严重影响DFA阅片,导致可能发出假阴性结果,原因可能为过高的温度破坏了阳性细胞蛋白质的结构导致抗原性降低,从而影响抗原抗体反应,因此笔者不推荐为了节约检验时间而采用70 ℃、15 min加热灭活方法。RABENAU等[6]指出,60 ℃处理30 min后,SARS病毒完全灭活没有任何残留,同时此温度时间灭活后不影响荧光显微镜下观察结果。因此笔者推荐DFA检测采用60 ℃,30 min加热灭活方法。本研究中笔者还发现,加热灭活后在荧光显微镜下阅片,荧光背景比加热灭活之前更加清晰干净,有助于检验人员对结果进行主观判断,原因可能为加热有助于痰液中的黏液丝液化,可有效避免黏液产生背景荧光对DFA结果判读的影响。
综上所述,加热是灭活病毒简单有效的方法,实验室在进行下呼吸道病毒抗原检测实验时,建议对标本采用加热灭活后再进行检测,这样有利于检验人员主观结果判断,同时保证检测结果准确性,而且降低实验室生物安全风险,有效避免实验室工作人员发生感染。

