烟曲霉新基因pim1敲除菌株构建及其耐药功能鉴定
王凯杰,周哲伦,姜茹予,王晴晴,雷玉恬,王 莎
(湖州师范学院 医学院、护理学院,浙江 湖州 313000)
近年来,随着广谱抗生素、抗肿瘤药物、肾上腺皮质激素、免疫抑制剂等的广泛应用甚至滥用,以及器官移植和外科介入性治疗,菌群失调以致机体对真菌的抵抗力降低,侵袭性曲霉病(invasive aspergillosis, IA)感染的发生呈现上升趋势,成为了器官移植手术、白血病等重症免疫受损患者死亡的主要原因,病死率高达60%~100%[1-3].目前,治疗深部曲霉感染的临床应用一线药物是三唑类抗真菌药物(trizoles),如伊曲康唑(itraconazole)、伏立康唑(voriconazole)和泊沙康唑(posaconazole)[3-4].唑类药物通过与麦角固醇合成途径中的关键酶细胞色素P450羊毛甾醇14α-脱甲基酶(Erg11A/Cyp51A基因编码)结合,以抑制麦角固醇的合成并造成毒性固醇中间体的积累,从而抑制真菌的生长[5].然而,研究发现越来越多的临床分离菌对唑类药物会产生耐药性[6-7].因此,烟曲霉的耐药机制已经成为当前研究的一个重要领域.
本实验室前期建立了以根癌农杆菌(Agrobacteriumtumefaciens)介导的T-DNA(Transfer DNA)随机插入的烟曲霉突变菌株库,其中编号为T478号的烟曲霉菌株对伊曲康唑耐药.本研究以T478号菌株为出发菌株,利用Tail-PCR技术扩增该突变体中被T-DNA破坏的基因片段,并通过测序鉴定到该突变基因,进一步利用基因敲除技术在野生型菌株中敲除该基因,以观察验证该基因是否参与对伊曲康唑耐受性的调控.
1 材料与方法
1.1 材料与试剂
烟曲霉野生型菌株A1160来自FGSC(http://www.fgsc.net/),A1160c野生型对照菌株来自本实验室菌库,pim1插入突变菌株(T478)和敲除菌株(Δpim1)为本实验构建.本研究所用培养基为YAG丰富培养基(每升含酵母粉5 g、葡萄糖20 g、微量元素Trace elements 1 mL,固体培养基需加入2%琼脂粉)和YUU培养基(在YAG丰富培养基中再添加1.1 g/L尿苷Uridine和1.2 g/L尿嘧啶Uracil).Trace elements的配方:每升含ZnSO4·7H2O 22 g、H3BO311 g、MnCl2·4H2O 5 g、FeSO4·7H2O 5 g、CoCl2·5H2O 1.6 g、CuSO4·5H2O 1.6 g、(NH4)6MO7O24·4H2O 1.1 g、EDTA 50 g,加热并用KOH调节pH至6.5~6.8.本研究菌株的培养条件为37 ℃下培养48 h.
主要试剂:酵母抽提物(Yeast Extract)购自Oxiod公司(英国);葡萄糖购自生工生物工程(上海)股份有限公司(中国);各种无机盐购自国药集团试剂化学有限公司(中国);DMSO购自北京索莱宝科技有限公司(中国);伊曲康唑ITC购自南京森贝伽生物科技有限公司(中国).本实验用到的试剂均为粉末,纯度>99%.分子生物学PCR和Tail-PCR相关试剂购自南京诺唯赞生物科技股份有限公司(中国).
1.2 Tail-PCR
TAIL-PCR,即交错式热不对称PCR或巢氏PCR:设计3个嵌套的特异性引物(pPK2-RB1、pPK2-RB2、pPK2-RB3)分别与简并引物(AD1、AD2、AD3和AD4)组合进行连续的PCR循环(表1),利用不同的退火温度选择性地扩增目标片段,一般通过3次巢式PCR反应即可获取已知序列的侧翼序列,所获得的片段可通过测序得到被插入破坏的基因序列.
1.3 基因敲除
本研究采用PCR方法扩增,用于转化入菌株的DNA片段.其中,引物Pim1 P1和Pim1 P3扩增pim1基因的上游同源臂,引物Pim1 P4和Pim1 P6扩增pim1基因的下游同源臂,引物Pim1 P2和Pim1 P5将上下游同源臂片段和筛选标记基因进行整合.本研究使用的所有引物见表1,均由金斯瑞生物科技股份有限公司(中国)合成.

表1 本研究所用引物
2 结 果
2.1 伊曲康唑耐药突变菌株T478号的筛选
本研究前期以野生型亲本A293为出发菌株,建立了一个大于2 000株根癌农杆菌介导的T-DNA随机插入的烟曲霉突变菌株库,并利用琼脂稀释法对该突变菌株库中的菌株进行了伊曲康唑的耐药筛查,最终得到8株伊曲康唑耐药菌株.本文从8株伊曲康唑耐药菌株中选取1株比较典型的T478号菌株作为出发菌株.如图1所示,在正常的培养条件下,T478号菌株的菌落直径比其野生型亲本Af293要小,但经伊曲康唑处理后,其菌落直径明显大于野生型菌株,表明T478号菌株对伊曲康唑耐药.
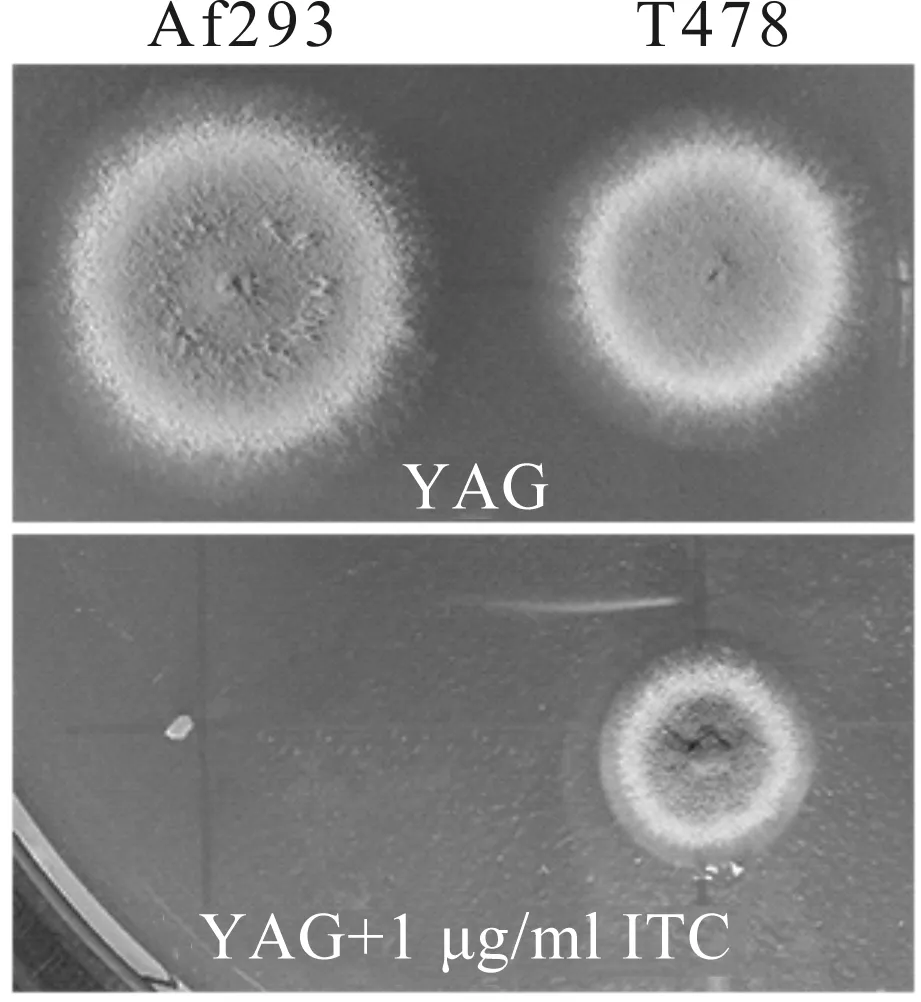
图1 伊曲康唑耐药T478号菌株Fig.1 Itraconazole-resistant T478 strains
2.2 T478号菌株突变基因的鉴定
将T478号菌株作为候选目标菌株,设计引物利用Tail-PCR技术对T478号菌株基因组上T-DNA的侧翼序列进行分离测序鉴定,结果在该菌株的基因组中,T-DNA左臂的侧翼序列扩增测序未得到目的基因,而T-DNA右臂的侧翼序列扩增测序得到一个未被研究的新基因,该基因的登录号为locus_tag="AFUA_2G11740".图2为T-DNA右臂的插入模式:插入到AFUA_2G11740基因开放阅读框内的一个外显子区域内,即插入到从起始密码子开始的第1 586个碱基处.因此,推测T478号菌株对伊曲康唑耐药可能与该基因功能被破坏存在密切关系.
据研究报道,该基因在酵母菌中的同源蛋白被预测为线粒体丝氨酸蛋白酶Pim1(mitochondrial serine protease Pim1, putative).Pim1蛋白酶是存在于酵母菌线粒体基质中的Lon类蛋白酶的另一种命名(Pim1 refers to mitochondrial ATP-dependent protease protein).
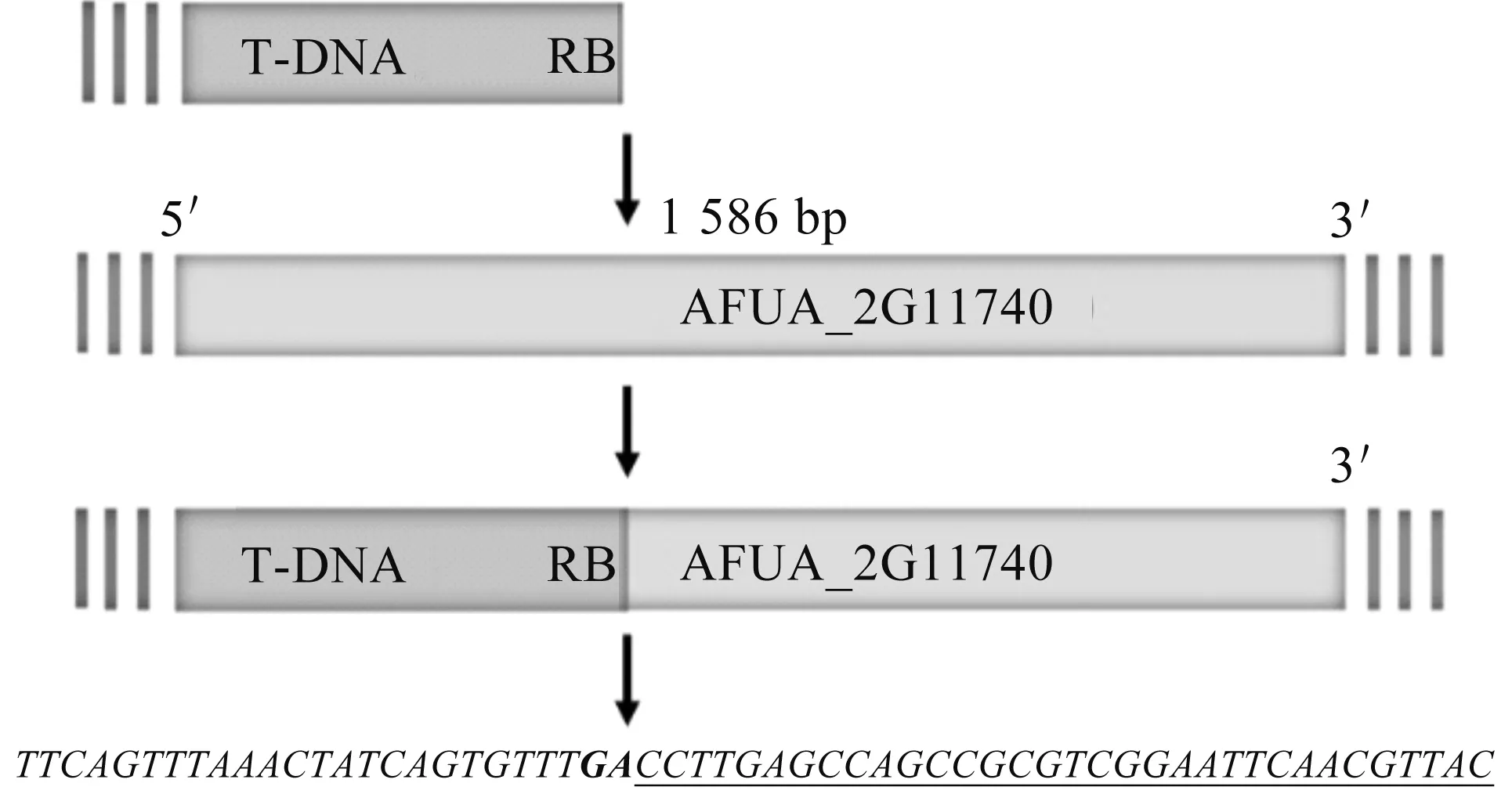
注:斜体字母为T-DNA右边界序列,斜体字母和粗体GA为T-DNA 右边界断裂位点,带有下划线的字母为基因AFUA_2G11740的片段.图2 T478号菌株的T-DNA插入模式推测图Fig.2 Speculative diagram of T-DNA insertion pattern of strain T478
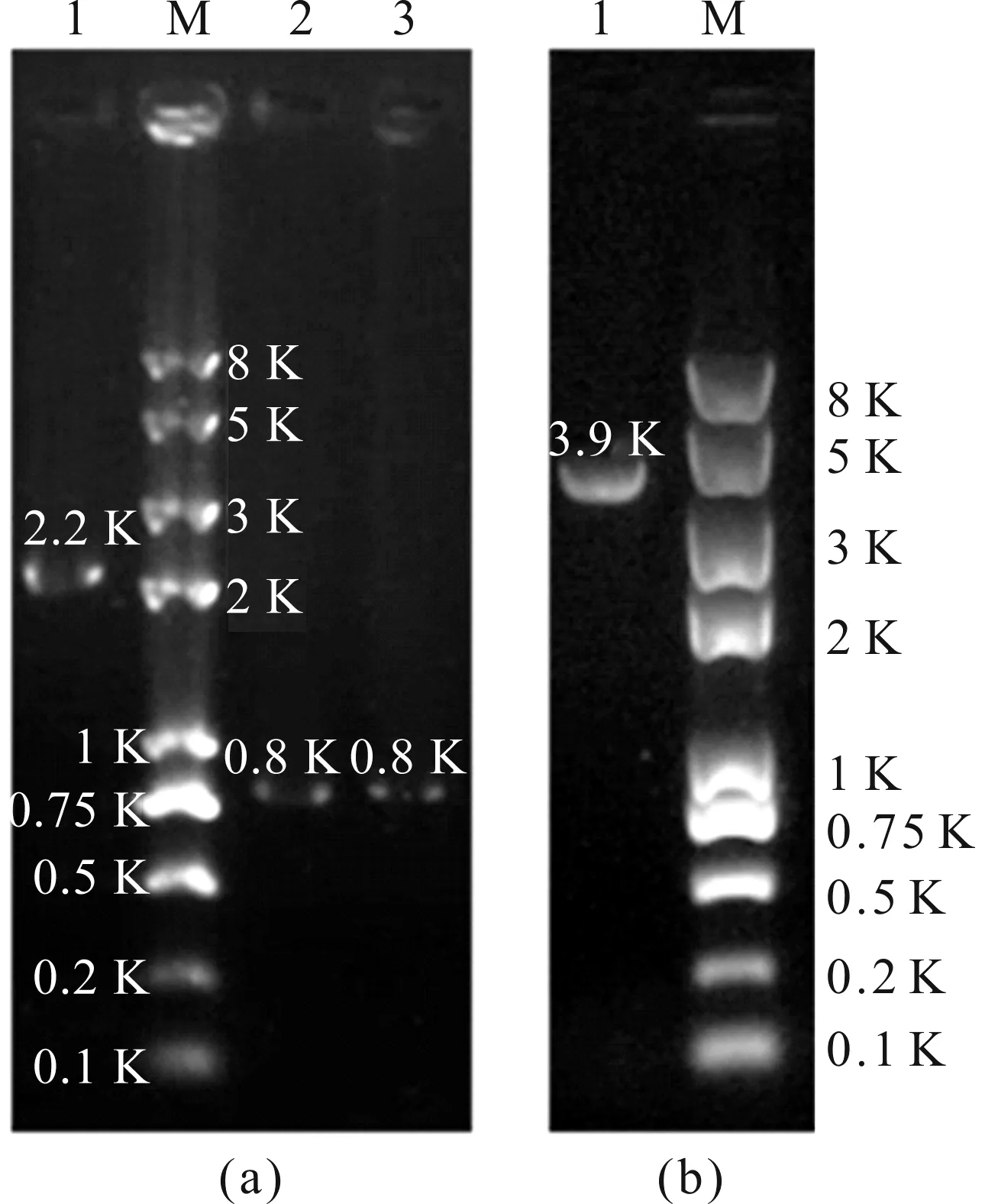
注:(a)为左(泳道2)右(泳道3)同源臂和中间的pyr4片段(泳道1), (b)为融合的全长片段(泳道1).图3 pim1基因敲除的融合片段电泳图Fig.3 Electrophoretogram of pim1 knockout fusion fragment
2.3 Δpim1菌株的构建
本文通过融合PCR技术,根据同源重组替换目的基因的原理构建烟曲霉pim1敲除菌株.首先用引物Pim1 P1/P3和Pim1 P4/P6分别扩增长度约为0.8 kb的pim1基因上下游同源臂,然后用引物pyr4 F/R从质粒pAL5上扩增2.2 kb筛选标记pyr4基因(图3(a)),再将上述3个片段混合作为模板,用引物Pim1 P2/P5将左同源臂、筛选标记和右同源臂整合成一个3.9 kb的融合片段(图3(b)),最后将融合片段转入野生型A1160菌株的细胞中,经基因同源重组后,pim1基因被pyr4基因替换,在筛选培养基上得到烟曲霉pim1缺失的敲除菌株.
2.4 Δpim1菌株耐药表型的验证
前期研究发现,pim1基因被T-DNA插入破坏后会导致突变菌株对唑类药物耐药.由图4可以看出,在正常情况下,野生型菌株的菌落直径大于Δpim1基因敲除菌株,当加入0.5 μg/mL伊曲康唑后,野生型菌株生长明显受到抑制,Δpim1基因敲除菌株的菌落直径远远大于野生型菌株.由此表明,Δpim1基因敲除菌株具有与T478号菌株相同的耐药表型,这进一步证实了前期菌株筛选和基因分离鉴定的准确性,也验证了pim1基因参与烟曲霉耐药功能的调控.
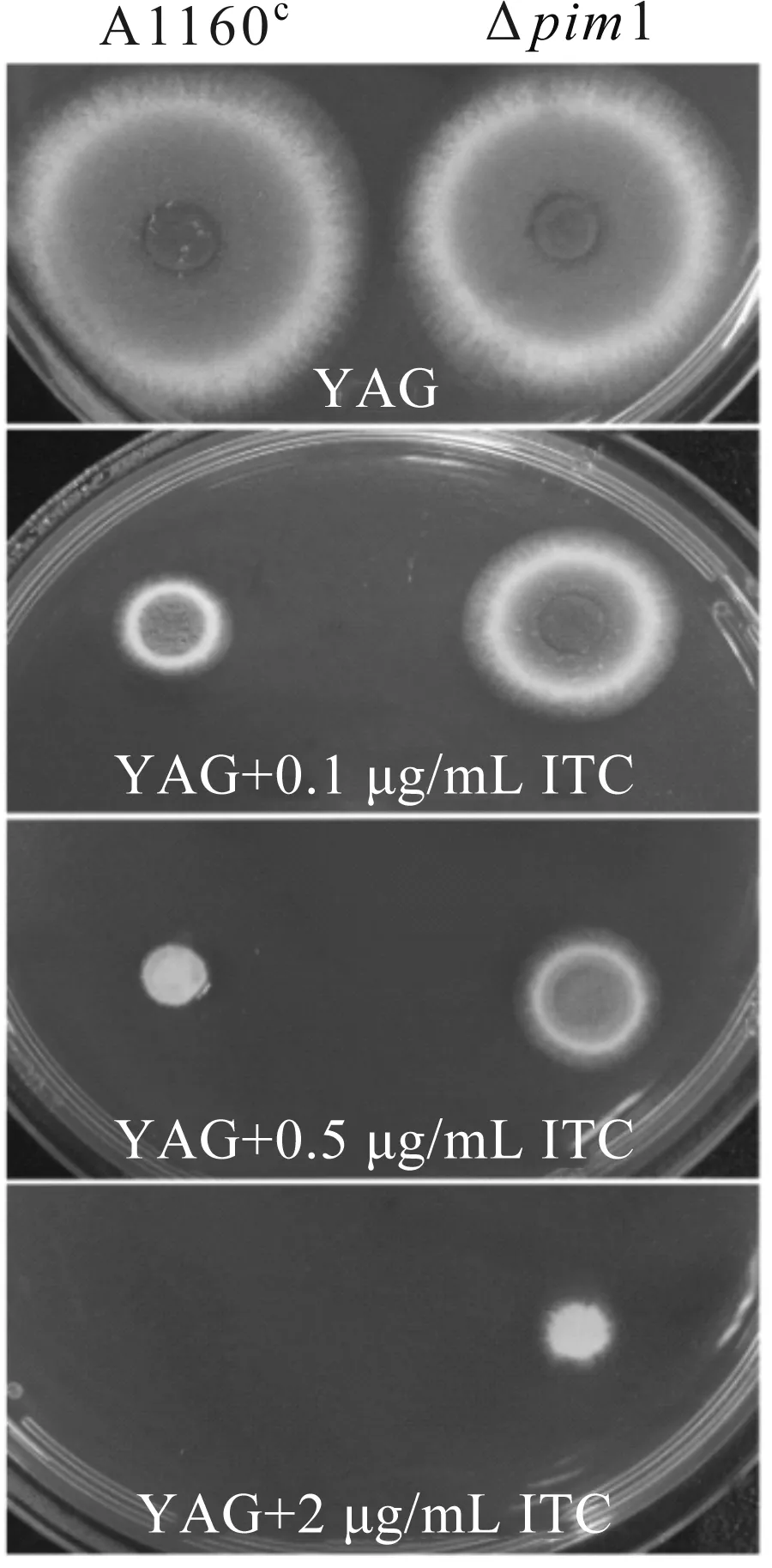
图4 Δpim1对唑类药物耐药的菌落表型Fig.4 Colony phenotypes of Δpim1 resistant to azole drugs
3 讨 论
本文从T-DNA随机插入的烟曲霉突变菌株库中筛选出T478号耐唑类药物突变菌株,并通过Tail-PCR技术鉴定到一个烟曲霉新基因pim1.为验证pim1基因的缺失是否与烟曲霉的耐药性存在直接关系,本研究在烟曲霉野生型亲本A1160株中敲除pim1基因,获得了Δpim1敲除菌株,并通过菌落表型鉴定发现,Δpim1具有与突变菌T478号相同的耐伊曲康唑表型.后期进一步研究发现,pim1基因的缺失并没有引起对棘白菌素类药物卡泊芬净的耐受,仅表现为对伊曲康唑耐药.
Lon类蛋白酶的基因名称最早来自大肠杆菌Lon基因的突变表型(These mutants tend to grow in long forms),该表型是由细菌在紫外线照射后形成的不分裂的长线状结构[8].Lon蛋白酶在原核生物的胞质及真核生物的线粒体中都高度保守,在高温、缺氧、损伤等应激情况下,Lon蛋白酶都呈高表达.许多研究表明,Lon蛋白酶定位于线粒体基质中参与线粒体DNA代谢,以维持前体mRNA稳定性,能够通过介导异常或损伤的蛋白和短暂调控蛋白的降解来维持细胞线粒体的正常生理功能和细胞自身的体内平衡[9].它也是一种分子伴侣,参与线粒体蛋白的折叠和去折叠[10].关于烟曲霉耐药的最新研究发现,线粒体呼吸链复合体结构中的Cox10蛋白突变后,线粒体有氧呼吸能力减弱,同时胞质内出现钙离子震荡,钙离子信号通路被激活,并进一步激活下游细胞壁整合通路和药物外排泵基因表达,最终实现对唑类药物耐受.因此,推测Pim1蛋白在烟曲霉中参与唑类药物耐受的调控可能是通过类似Cox10的作用机制实现的,后期可围绕该蛋白对线粒体功能的影响展开研究.
目前,人们对临床菌株耐药机制的认知还很浅,越来越多的研究发现临床上分离的耐药菌株存在多种未知机制,而丝状真菌中pim1基因参与耐药调控的功能还没有被研究,后期的研究可利用成功构建的Δpim1菌株,进一步深入研究pim1在烟曲霉细胞中参与唑类药物耐药的分子调控机制,为理解和控制真菌的耐药性提供依据.
——紫 苏

