乳腺浸润性导管癌中丝氨酸蛋白酶抑制剂A1表达及对预后判断的临床价值研究
李 欢,王世全,李 铎
(锦州市妇婴医院乳腺科,辽宁 锦州 121000)
乳腺癌是女性最常见的恶性肿瘤之一,其中最常见的类型是浸润性导管癌[1],病变的形成涉及多种分子生物学因子的调控异常。丝氨酸蛋白酶抑制剂A1(Serine protease inhibitor A1,SerPinA1)是丝氨酸蛋白酶抑制剂家族的重要成员之一,正常机体的肝细胞内有微量合成,在炎性相关疾病时表达升高,对炎性因子平衡起一定的调控作用[2]。近年学者在肿瘤研究中发现SerPinA1表达升高,尤其是上皮源性恶性肿瘤的形成过程中[3]。SerPinA1可能对促进肿瘤细胞的增殖有作用。本研究基于乳腺浸润性导管癌中SerPinA1的表达进行研究,探讨其在不同临床病理特征中的表达差别,分析其对预后的判断价值,以期为临床工作提供支持。
1 资料和方法
1.1 一般资料 收集2015年1-12月期间确诊为乳腺浸润性导管癌的患者作为研究对象,共93例。病例纳入标准:①均行根治性手术治疗,术后经病理医师确诊,符合WHO中的病理诊断标准;②原发肿瘤;③临床随访资料完整。排除标准:①术前行放、化疗;②诊断有异议者或伴有其他恶性成分者;③双原发癌或多原发癌。患者均为女性,年龄31~84岁,平均(59.7±6.5)岁,其中组织学Ⅰ级12例,组织学Ⅱ级60例,组织学Ⅲ级21例。留取肿瘤组织作为研究组,留取距肿物边缘>2 cm乳腺其他象限的非肿瘤性乳腺组织作为对照组。研究经医院伦理委员会批准,符合《赫尔辛基宣言》的要求。
1.2 研究方法
1.2.1 免疫组化实验:术后标本常规经中性福尔马林固定、取材、脱水及石蜡包埋后,切取4 μm切片后置于胶片上,应用免疫组化二步法检测SerPinA1、人类表皮生长因子受体2(HER-2)和Ki67的表达。SerPinA1的浓缩液、二抗和DAB均购自武汉博士德生物技术公司;HER-2和Ki67为工作液,购自北京中杉金桥生物技术公司。SerPinA1按不同配比浓度先行预实验,选择染色效果最佳的浓度(1∶250)用于正式实验。实验均手工操作,严格按说明书操作,操作均由同一病理技师完成,设阳性对照,减少人为误差。
结果由两位病理主治医师应用盲法进行判读。SerPinA1的显色部位为上皮细胞的细胞浆。应用着色强度和阳性率二维评分法进行综合评分。着色强度:无色为0分,弱为1分,中为2分,强为3分。阳性率:随机选择5个高倍(400倍)视野,计算阳性率,阳性率<5%为0分,5%~25%为1分,以26%~50%为2分,以51%~75%为3分,以>75%为4分。着色强度和阳性率的评分相乘为最终评分,总分范围0~12分。以≤4分为阴性,以>4分为阳性。计算每张切片SerPinA1表达的阳性率。HER-2的判读参考乳腺癌HER-2检测指南(2019版)[4],以阴性和+为阴性,以为阳性。对的病例行FISH检测。Ki67的显色部位是细胞核,以黄色-棕褐色为阳性,选择热点区进行观察,共选择3个400倍视野,计算阳性细胞百分率,取平均值,Ki67的阳性率亦称为增殖指数。
1.2.2 荧光原位杂交(FISH)实验:对肿瘤中免疫组化显示HER-2为的病例行FISH检测。步骤及判读参考乳腺癌HER-2检测指南(2019版)[4]。
1.3 统计学方法 应用SPSS 17.0统计学软件进行分析,率的组间比较采用χ2检验,生存分析应用K-M生存分析,并应用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 GEPIA数据库中检索结果 GEPIA数据库检索发现SerPinA1在乳腺浸润性导管癌中的表达高于对照组(P<0.05)。见图1。

图1 GEPIA数据库中检索结果
2.2 两组中SerPinA1阳性率比较 研究组中SerPinA1表达的阳性率明显高于对照组。见表1(图2)。
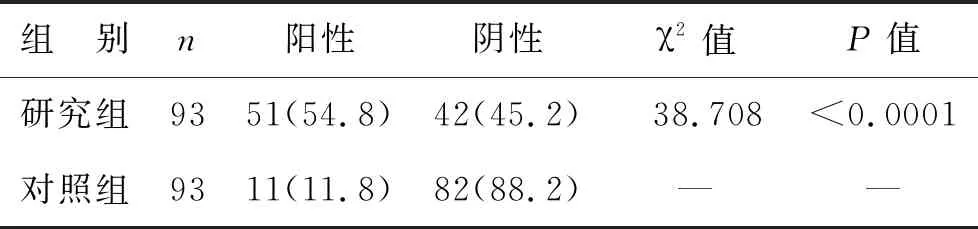
表1 两组中SerPinA1表达阳性率比较[例(%)]
2.3 SerPinA1在研究组不同临床病理特征分组中表达的比较 研究组中SerPinA1的表达在不同肿瘤最大径、脉管癌栓、淋巴结转移、HER-2表达和组织学分级的表达比较差异有统计学意义(均P<0.05)。见表2(图3)。
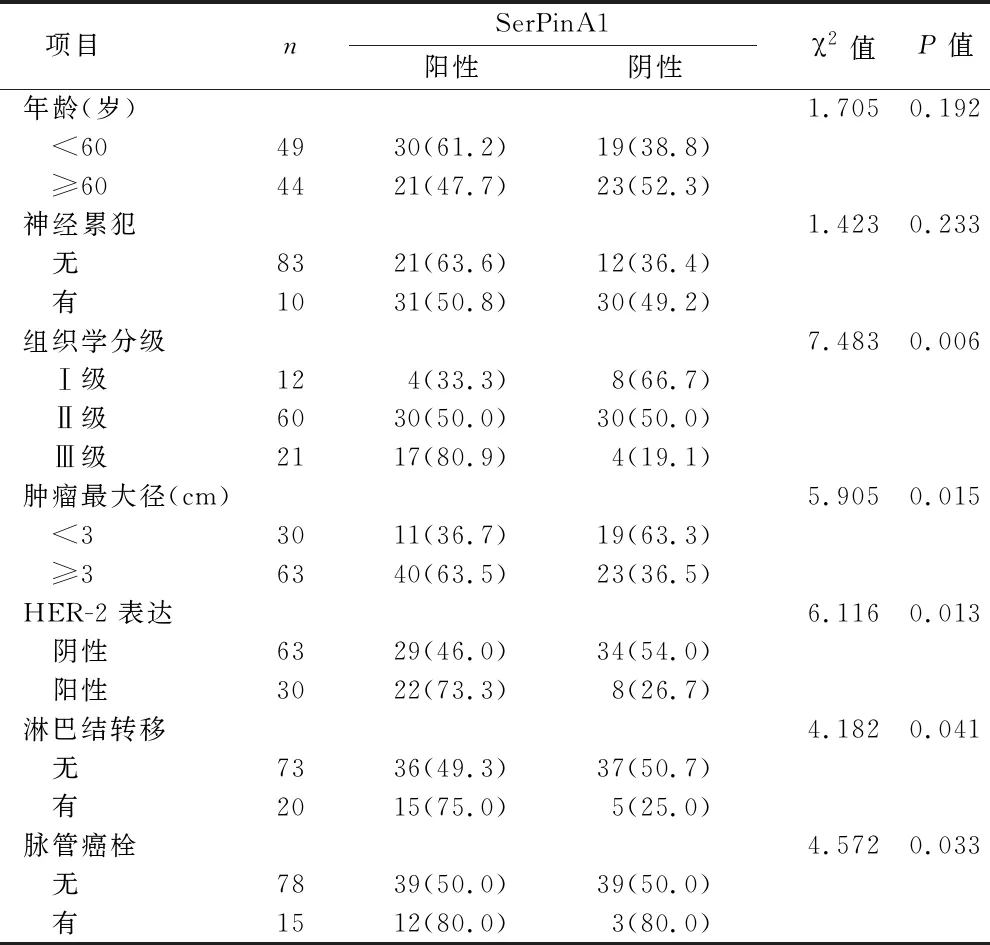
表2 SerPinA1在研究组不同临床病理特征分组中表达的比较[例(%)]
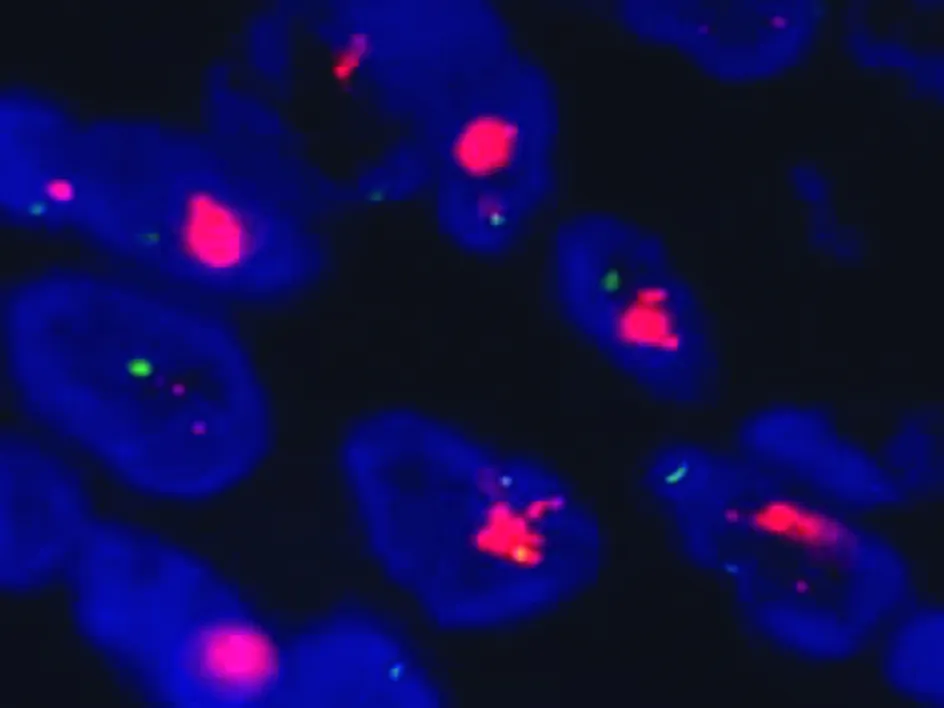
图3 研究组中HER-2阳性的表达(FISH法,×1000)
2.4 研究组中SerPinA1与Ki67的相关性 研究组中Ki67增殖指数表达范围是5%~80%,平均(34.3±5.4)%。Spearman相关分析显示SerPinA1与Ki67呈正相关性(r=0.66,P=0.021)。见图4、5。
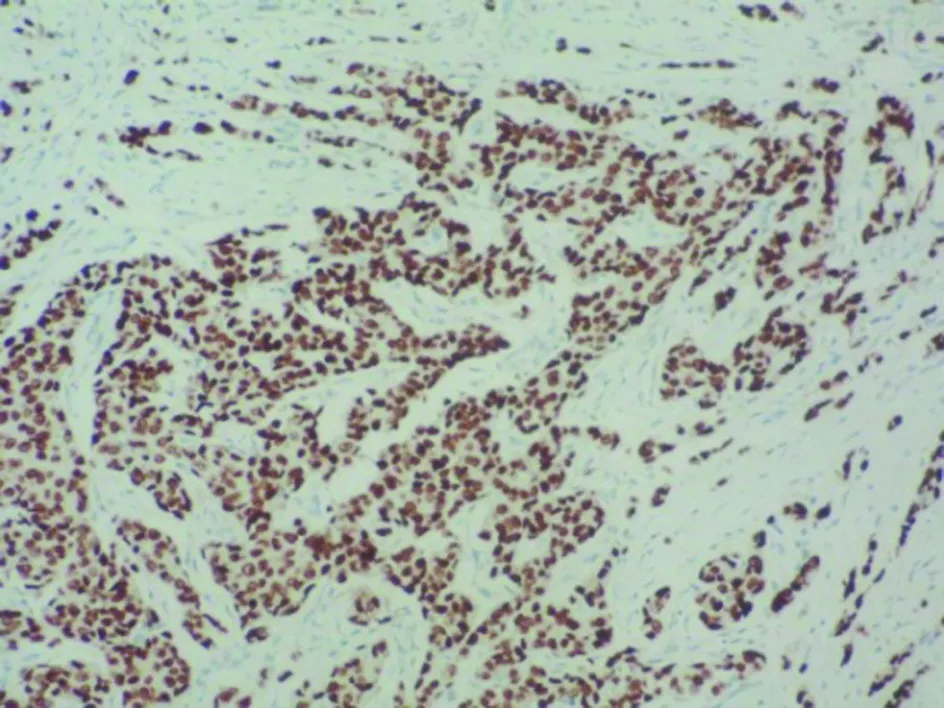
图4 研究组中Ki67的表达(IHC 二步法,× 200)
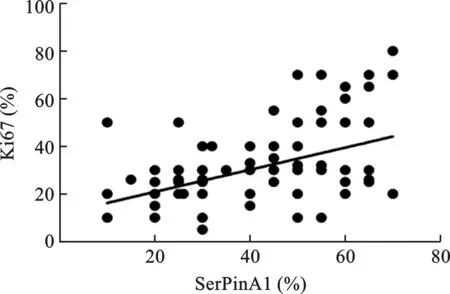
图5 研究组中SerPinA1与Ki67的相关性
2.5 研究组中SerPinA1的表达与生存时间的关系 患者均行术后60个月生存时间的随访,截止时间点为2020年12月31日。其中生存56例,死亡33例,失访4例。行K-M生存分析显示SerPinA1的表达与生存时间相关(χ2=4.32,P=0.019),即SerPinA1高表达的患者生存时间短,预后差。见图6。
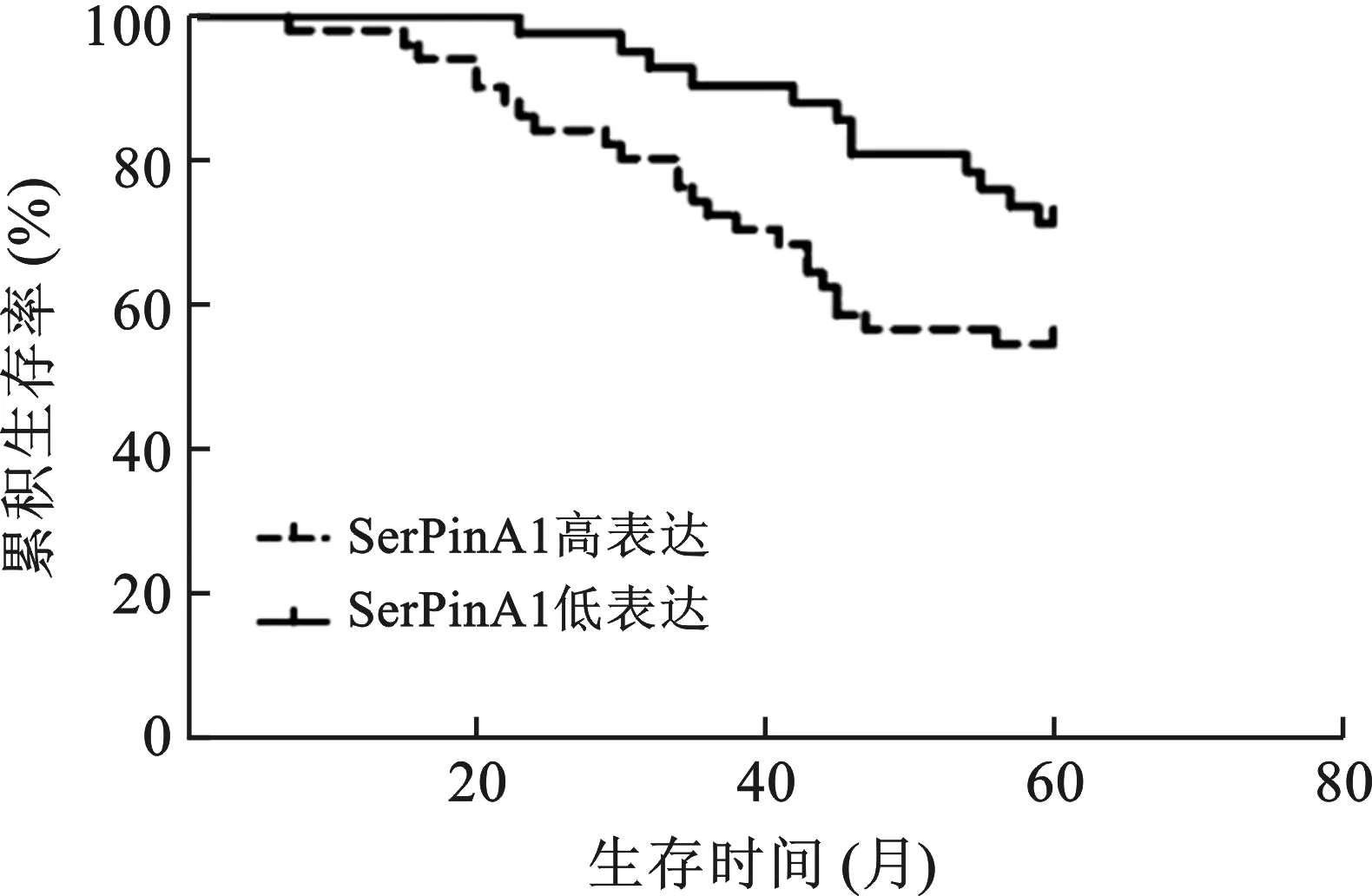
图6 SerPinA1与生存时间的关系
3 讨 论
乳腺浸润性导管癌的病变形成与基因表达失调有关[5]。SerPin是众多肿瘤相关基因中的成员,目前共发现有9个家族,其中最重要的因子是SerPinA1,也是学者关注最多的因子,具有高度的保守结构。研究认为SerPinA1在细胞外基质的降解(调节MMPs)、炎性因子的释放和细胞的转换中起着关键作用[6-7]。SerPinA1主要在肝细胞内合成,其在肝细胞中表达较高,具有急性时相蛋白的作用,但是在人体其它正常上皮成份中表达极少[8]。研究显示在恶性转变的上皮细胞中SerPinA1的表达可以升高[9-12]。SerPinA1高表达可以增加肿瘤细胞的增殖、出芽,抑制肿瘤细胞的凋亡,增强肿瘤细胞的迁移[13-15]。SerPinA1通过保守机制抑制靶酶,SerPinA1可作为“捕鼠器”的作用,其中的蛋白酶是“小鼠”,当蛋白酶识别诱导因子后形成可逆的复合物,形成对凋亡的抑制作用[11]。
本研究结果显示乳腺浸润性导管癌中SerPinA1的表达明显高于对照组,提示SerPinA1在肿瘤性病变时分泌增加,参与肿瘤的形成。结果显示肿瘤中SerPinA1的表达在不同肿瘤最大径、淋巴结转移、脉管癌栓及组织学分级的表达中差异有统计学意义,提示SerPinA1参与肿瘤的生长和细胞增殖,对肿瘤的局部侵袭和直接蔓延有重要的促进作用。SerPinA1在正常乳腺上皮细胞中表达极低,但在上皮细胞恶变过程中SerPinA1的表达明显升高,可能与肿瘤微环境中的低氧和低pH值有关,这些因素均能诱导肿瘤细胞分泌更多的SerPinA1。SerPinA1高表达能促进肿瘤细胞的增殖作用,并能使肿瘤细胞逃避化疗药物的影响,使肿瘤细胞具有旺炽性增殖的特征,肿瘤细胞增殖加速,肿瘤生长加速[16]。也有观点显示SerPinA1通过磷酸化调节细胞周期蛋白D1(CyclinD1)与CyclinD3的活性,使细胞处于高度活跃状态[17-19]。SerPinA1能促进染色体的重塑,也是其调节肿瘤形成的重要因素之一。SerPinA1对MMPs的调节可能是对转移调控的重要途径,SerPinA1高表达可以引起基质金属蛋白酶-2(MMP-2)、MMP-9的分泌,使细胞外基质和基底膜有效降解,为转移提供必要的条件[20]。研究显示SerPinA1的表达与HER-2表达密切相关,提示SerPinA1可能与基于HER-2为靶点的治疗有关。相关分析显示SerPinA1与Ki67指数呈正相关性,证实了SerPinA1对肿瘤细胞繁殖及肿瘤生长的促进作用。本实验观察到SerPinA1的表达与生存时间相关,提示检测SerPinA1的表达可能对判断预后有一定价值,即SerPinA1高表达的患者预后差,但是SerPinA1作为预后因子尚需要进行大样本、多因素及多中心的分析后进一步证实。
综上所述,SerPinA1在乳腺浸润性导管癌组织中表达升高,与肿瘤的形成和进展有关。术后检测SerPinA1的表达对判断预后有一定价值。

