下调miR-32对幽门螺杆菌诱导的肠上皮细胞凋亡及TAK1-p38通路的影响
易庆军 杨宇 胡煜 吴晓芳
幽门螺杆菌(helicobacter pylori,H.pylori)一种生存于胃和十二指肠内的革兰氏阴性需氧菌,该菌感染最先损害胃黏膜组织,引起胃黏膜上皮细胞增生、凋亡,促进胃癌癌前病变及发展[1-3]。近来由H.pylori引起的小儿肠炎发病率逐渐增加,肠炎是常见消化道疾病,可引起小儿腹痛、腹泻及消化不良,若不及时正确干预可导致慢性肠炎,导致儿童可能出现营养不良,甚至严重影响儿童的健康和生长[4]。H.pylori感染可通过招募和诱导中性粒细胞导致相关蛋白及微小RNA(microRNA,miRNA)异常表达,释放细胞毒素等物质。miRNA是一类非编码小RNA,在进化过程中高度保守,多种miRNA异常表达在肠上皮炎症损伤及肠癌发生发展过程中发挥重要作用[5,6],研究报道miR-32在结直肠癌组织中显著上调,可诱导其凋亡[7],miR-32-5p上调可加重H.pylori所致小儿肠炎的肠上皮细胞损伤[8],但其机制尚不完全明确。转化生长因子β激活激酶1(transforming growth factor β activated kinase 1,TAK1)是p38丝裂原激活蛋白激酶(p38 mitogen activated protein kinases,p38)和核因子-κB信号通路共同上游调节因子,与炎症损伤密切相关[9]。因此本研究拟探究下调miR-32对通过H.pylori诱导HIEC-6细胞凋亡及TAK1-p38通路的影响,以期揭示其作用机制,为临床小儿肠炎的靶向治疗提供新的思路,报道如下。
1 材料与方法
1.1 细胞、主要试剂及仪器 HIEC-6细胞购自中国细胞资源库保藏中心。H.pylori菌株购自ATCC细胞库;DMEM/F-12培养基(货号:12634010)、胎牛血清(fetal bovine serum,FBS,货号:10099-145)购自美国Gibco公司;CCK-8试剂盒(货号:11465007001)、AnnexinV-FITC凋亡检测试剂盒(货号:APOAF)购自美国Sigma公司。Lipofectamine® 2000转染试剂盒(货号:11668)购自美国Invitrogen公司;引物及miR-32 inhibitor/NC序列由广州锐博生物工程有限公司合成;兔源一抗anti-TAK1(货号:ab196955)、anti-p38(货号:ab170099)、anti-GAPDH(货号:ab181602)、二抗羊抗兔IgG(货号:ab6721)均购自英国Abcam公司;Evolution 220紫外分光光度计、FC酶标仪、Forma Steri-Cycle i160 5%CO2培养箱购自美国Thermo Fisher公司;7500 RT-qPCR仪购自美国Bio-Rad公司;FACS Canto II流式细胞仪购自美国BD公司;IX75倒置荧光显微镜购自日本Olympus公司等。
1.2 方法
1.2.1 细胞培养:HIEC-6细胞常规复苏后采用含10%FBS、1%青链霉素的DMEM/F-12培养基置于37℃、5%CO2、完全饱和湿度细胞培养箱中培养。细胞传代时用0.25%胰蛋白酶消化处理。
1.2.2 细胞转染及分组:取对数期生长HIEC-6细胞接种于6孔细胞培养板,分别设为空白对照组(BC组)、H.pylori组、H.pylori+NC组、H.pylori+inhibitor组。H.pylori用无菌PBS重悬,2 000 r/min离心后留取沉淀,添加2%FBS DMEM/F-12培养基调成为1×1012cuf/L。H.pylori组以细菌:细胞为200∶1共孵育24 h;H.pylori + NC组、H.pylori + inhibitor组均采用Lipofectamine® 2000转染法分别转染miR-32 inhibitor-NC、inhibitor序列,孵育4~6 h更换含有H.pylori新鲜培养基给予孵育24 h,转染具体操作严格按照试剂盒说明书进行;BC组为未进行任何处理正常生长细胞,每组6个重复。24 h观察到荧光表达,并通过实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)验证转染效果。
1.2.3 CCK-8检测HIEC-6细胞活性:将4组HIEC-6细胞以1×104个/孔密度接种于96孔细胞板,每组6个复孔,采用CCK-8试剂盒检测各孔HIEC-6细胞450 nm处吸光度(OD)值,细胞活性(%)=(OD试验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.4 Annexin V-FITC/PI检测HIEC-6细胞凋亡情况:收集各组HIEC-6细胞,并以1×109/L的浓度将细胞重悬于PBS液,添加5 μl Annexin V和5 μl PI室温避光孵育15 min后,使用流式细胞仪检测各组细胞凋亡情况。
1.2.5 ELISA检测HIEC-6细胞上清液TNF-α、IL-6表达量:收集各组HIEC-6细胞,离心后留取上清液,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELLSA)检测上清液中TNF-α、IL-6表达量,具体操作步骤严格按照试剂盒说明书进行。
1.2.6 RT-qPCR检测HIEC-6细胞miR-32、TAK1、p38 mRNA表达:采用Trizol提取各组HIEC-6细胞总RNA,用紫外分光光度计检测总RNA浓度及纯度(OD260/280为1.7~2.0)。反转录得到cDNA,置于-20℃保存备用。采用RT-qPCR仪扩增miR-32、TAK1、p38 mRNA片段。反应体系(20 μl):TB Green Premix Ex Taq II(Tli RNaseH Plus)(2×) 10.0 μl,ROX Reference Dye II(50×)0.4 μl,cDNA(50 ng/μl)2.0 μl,上下游引物(10 μmol/L)各0.8 μl,ddH2O 6.0 μl。反应条件为:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。采用2-ΔΔCT法定量分析细胞中miR-32、TAK1、p38 mRNA相对表达水平。见表1。

表1 RT-qPCR引物序列
1.2.7 WB检测HIEC-6细胞TAK1、p38蛋白表达水平:提取4组HIEC-6细胞总蛋白,BCA法测定蛋白浓度,置于-80℃冰箱保存待用。采用免疫印迹(western blot,WB)法检测TAK1、p38蛋白表达。取50 g蛋白样品经十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)、转膜、封闭、一抗孵育(anti-TAK1稀释比
1∶1 000;anti-p38稀释比1∶2 000;anti-GAPDH稀释比1∶5 000),4℃过夜,二抗孵育(IgG稀释比1∶10 000),37℃ 1 h,显像、曝光、拍照并分析结果。以靶蛋白灰度值与内参GAPDH灰度值比值为靶蛋白相对表达量。
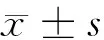
2 结果
2.1 miR-32转染效率鉴定 H.pylori + NC组、H.pylori + inhibitor组细胞转染24 h后即出现大量荧光,且RT-qPCR检测发现,与BC组比较,H.pylori组HIEC-6细胞miR-32表达水平显著增加(P<0.05);H.pylori、H.pylori + NC组miR-32表达水平比较,差异无统计学意义(P>0.05);与H.pylori + NC组比较,H.pylori + inhibitor组miR-32表达水平显著降低(P<0.05),提示转染成功。见图1,表2。

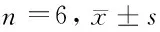
表2 4组HIEC-6细胞miR-32表达水平、细胞活性及凋亡率比较
2.2 下调miR-32表达对HIEC-6细胞活性的影响 与BC组比较,H.pylori组HIEC-6细胞活性显著降低(P<0.05);H.pylori、H.pylori+NC组HIEC-6细胞活性比较,差异无统计学意义(P>0.05);与H.pylori+NC组比较,H.pylori+inhibitor组HIEC-6细胞活性显著增加(P<0.05)。见表2。
2.3 下调miR-32表达对HIEC-6细胞凋亡的影响 与BC组比较,H.pylori组HIEC-6细胞凋亡率显著增加(P<0.05);H.pylori、H.pylori+NC组HIEC-6细胞凋亡率比较,差异无统计学意义(P>0.05);与H.pylori+NC组比较,H.pylori+inhibitor组HIEC-6细胞凋亡率显著降低(P<0.05)。见图2,表2。

2.4 下调miR-32表达对HIEC-6细胞上清液炎性因子表达量的影响 与BC组比较,H.pylori组HIEC-6细胞上清液TNF-α、IL-6表达量显著增加(P<0.05);H.pylori、H.pylori + NC组HIEC-6细胞上清液TNF-α、IL-6表达量比较,差异无统计学意义(P>0.05);与H.pylori + NC组比较,H.pylori + inhibitor组HIEC-6细胞上清液TNF-α、IL-6表达量显著降低(P<0.05)。见表3。
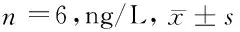
表3 4组HIEC-6细胞上清液TNF-α、IL-6表达量比较
2.5 下调miR-32对HIEC-6细胞TAK1、p38 mRNA表达水平的影响 与BC组比较,H.pylori组HIEC-6细胞TAK1、p38 mRNA表达水平显著增加(P<0.05);H.pylori、H.pylori+NC组HIEC-6细胞TAK1、p38 mRNA表达水平比较,差异无统计学意义(P>0.05);与H.pylori + NC组比较,H.pylori+inhibitor组HIEC-6细胞TAK1、p38 mRNA表达水平显著降低(P<0.05)。见表4。
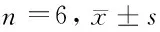
表4 4组HIEC-6细胞TAK1、p38 mRNA表达水平比较
2.6 下调miR-32对TAK1、p38蛋白表达的影响 与BC组比较,H.pylori组HIEC-6细胞TAK1、p38蛋白表达量显著增加(P<0.05);H.pylori、H.pylori + NC组HIEC-6细胞TAK1、p38蛋白表达量比较,差异无统计学意义(P>0.05);与H.pylori + NC组比较,H.pylori + inhibitor组HIEC-6细胞TAK1、p38蛋白表达量显著降低(P<0.05)。见表5。
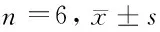
表5 4组HIEC-6细胞TAK1、p38蛋白表达量比较
3 讨论
miRNA是通过转录后调控参与多种疾病基因表达的内源性非编码小RNA,是细胞功能和体内平衡的重要调节因子,近来研究发现,多种miRNA异常表达在肠道疾病发生机制中发挥重要作用[10-12]。Liang等[13]研究报道,与正常结肠上皮细胞比较,miR-32-5p在结肠癌细胞中显著上调,抑制其表达可增强结肠癌细胞放射敏感性,抑制其迁移和侵袭。魏凯等[14]研究报道,miR-32在胃癌细胞中亦显著上调,与胃癌细胞增殖及侵袭有关。H.pylori被世界卫生组织国际癌症研究协会定义为Ⅰ类致癌因子,H.pylori感染能够影响相关miRNA表达,通过参与调控细胞生物学行为、表观遗传学修饰等,在胃肠道疾病发生发展中起重要作用[15]。有研究报道,H.pylori感染与小儿肠炎有显著相关性[16],而与炎症性肠病患者呈负相关[17],但具体机制尚不明确。Feng等[8]研究报道,miR-32-5p可促进H.pylori所致小儿肠炎的肠上皮细胞HIEC-6细胞凋亡,加重其炎症损伤,可能与靶向SMAD6基因,调节TAK1-p38信号通路有关。本研究结果发现,与BC组比较,H.pylori组HIEC-6细胞miR-32表达水平、凋亡率显著增加,细胞活性显著降低,而下调miR-32可减轻H.pylori诱导的细胞凋亡,增加其活性,提示miR-32可能促进H.pylori感染引起的HIEC-6细胞凋亡,而下调其表达则可逆转H.pylori促HIEC-6细胞凋亡作用,促进其存活。
TAK1是一种丝氨酸/苏氨酸激酶,可被TNF-α、IL-1β等多种因素激活,是介导MAPK、NF-κB信号通路的关键调节因子,主要参与下游信号分子的表达介导组织损伤及细胞炎性反应[18]。p38是MAPK家族成员之一,自身发生磷酸化后被激活。Zaidi等[19]研究报道,H.pylori可通过新的TAK1-p38激活途径,以不依赖于HB- EGF的方式诱导EGFR的丝氨酸磷酸化,与相关性胃癌发生有关。Wei等[20]研究报道,抑制TAK1/p38/NF-κB信号通路可减轻oxo-LDL诱导的内皮细胞凋亡及炎症损伤。但目前关于miR-32在小儿肠炎中的研究较少。本研究结果发现,与BC组比较,H.pylori组HIEC-6细胞TNF-α、IL-6表达量、TAK1、p38 mRNA及蛋白表达水平显著增加,提示H.pylori感染可促进HIEC-6细胞凋亡可能与促进炎性反应,激活TAK1-p38通路有关。与H.pylori + NC组比较,H.pylori + inhibitor组HIEC-6细胞TNF-α、IL-6表达量、TAK1、p38 mRNA及蛋白表达水平显著降低,提示下调miR-32可能对H.pylori感染导致的HIEC-6细胞炎性反应及TAK1-p38通路激活有抑制作用。
综上所述,下调miR-32可抑制H.pylori感染诱导的HIEC-6细胞凋亡,可能与抑制TAK1-p38通路激活及炎性反应有关。但关于miR-32在调控TAK1-p38通路中的具体作用靶点及对相关炎症通路的调节作用,有待进一步深入探究。

