circPDSS1通过靶向miR-1298调控肝癌细胞侵袭、迁移和凋亡的分子机制
李敏 吴兴桂 朱军华
肝癌全球最常见的人类恶性肿瘤之一,是癌症相关死亡的第三大原因[1]。尽管肝切除术、消融术和化疗等肝癌治疗策略不断完善,但由于其无限增殖、高度浸润和远处转移特性,多数患者预后仍不理想[2]。因此,深入研究肝癌进展的分子机制对寻找新的策略至关重要。近年来,环状RNA(circRNA)在癌症进展中的复杂而关键的作用引起研究者的广泛关注[3-4]。circRNA异戊二烯基二磷酸合酶亚基1(circPDSS1)是一种胃癌致癌性RNA,其高表达促进胃癌细胞周期进展并抑制细胞凋亡[5]。序列分析显示,miR-1298是circPDSS1的潜在靶基因。miR-1298在多种恶性肿瘤中被广泛下调,从而促进细胞增殖,侵袭性和迁移[6-7]。然而,circPDSS1、miR-1298在肝癌中的作用、二者是否存在调控作用并不清楚。
材料与方法
一、一般资料
选取2017年1月至2018年12月于进行手术切除的41对肝癌组织和其对应的癌旁组织(正常组织)。所有组织均经医院病理科确诊。所有患者术前未接受任何放疗、化疗或免疫治疗。每位患者签署知情同意书,本研究得到医院伦理委员会的批准。
二、细胞和试剂
肝癌细胞MHCC97H购于中国科学院上海细胞库;TRIzol试剂、反转录酶、SYBRTMGreen Master Mix、miRNeasy Mini试剂盒、miScript II反转录试剂盒、miScriptSYBR○RGreen PCR试剂盒购自北京天根生化科技有限公司;DMEM培养液、胎牛血清、青链霉素双抗、膜联蛋白-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)购自北京索莱宝生物公司;小干扰RNA(si-RNA)、miRNA模拟物(miRNA mimics)、miRNA抑制物(anti-miRNA)、过表达质粒(pcDNA-RNA)、双荧光素酶报告基因载体由北京华大基因公司提供;Transwell小室和基质胶购自美国康宁公司;基质金属蛋白酶2(MMP-2)、MMP-9、B细胞淋巴瘤-2(Bcl-2)、Bcl相关X蛋白(Bax)、磷酸甘油醛脱氢酶(GAPDH)、兔多克隆抗体、抗抗兔IgG二抗购自上海赛信通公司。
三、细胞培养和实验分组
MHCC97H培养于含10%胎牛血清、1%青链霉素双抗的DMEM培养液中,在37℃、含5% CO2的培养箱中培养。每2天传代一次,取对数期细胞进行实验。按照每孔2×105个细胞接种6孔板,利用脂质体转染法将si-NC、si-circPDSS1、miR-NC、miR-1298 mimics、si-circPDSS1+anti-miR-NC、si-circPDSS1+anti-miR-1298分别转染MHCC97H细胞,依次记为si-NC组、si-circPDSS1组、miR-NC组、miR-1298 mimics组、si-circPDSS1+anti-miR-NC组、si-circPDSS1+anti-miR-1298组,48 h后,参照RT-qPCR步骤检测转染效果合格后进行后续分析。
四、实时荧光定量PCR(RT-qPCR)检测circPDSS1和miR-1298表达
为检测circPDSS1表达,TRIzol试剂提取组织标本总RNA,核糖核酸酶R孵育15 min除去线性RNA,反转录酶合成cDNA后,用SYBR○RGreen Master Mix和特异性引物进行RT-qPCR反应。circPDSS1上游引物5′-GTGGTGCATGAGA-TCGCCT-3′:下游引物5′-GGGTTGTGTGATG-AAACCTG-3′;内参GAPDH上游引物5′-GAAGGTGAAGGTCGGAGTCGAPD-3′,下游引物5′-GAAGATGGTGATGGGATTT-3′。为检测miR-1298表达,miRNeasy Mini试剂盒提取组织标本miRNA,miScript II反转录试剂盒进行反转录,miScriptSYBR○RGreen PCR试剂盒进行RT-qPCR反应。2-△△Ct法计算circPDSS1和miR-1298表达表达水平。miR-1298上游引物5′-ACACTCCAGCTGG-GTTCATTCGGCTGTCCA-3′:下游引物5′-TGGT-GTCGTGGAGTCG-3′;内参U6上游引物5′-CTCGCTTCGGCAGCACA-3′:下游引物5′-GTGC-AGGGTCCGAGGT-3′。
五、细胞凋亡以及迁移侵袭检测
(一)细胞凋亡检测 采用流式细胞术法。收集各组细胞,重悬于500 μL 1×结合缓冲液中。按照凋亡检测试剂盒依次加入5 μL Annexin V-FITC和5 μL PI,避光染色30 min。1 h内应用流式细胞仪检测细胞凋亡。
(二)细胞侵袭检测 采用Transwell法。用不含血清培养基稀释Matrigel基质胶,预先包被Transwell上腔室膜。每组取200 μL细胞悬液(不含血清培养基稀释,细胞数为1×105)接种到Transwell上室。取500 μL完全培养基加入到24孔板下室。培养24 h后,用棉签轻轻拭去上腔室中未过膜细胞。用甲醇固定穿过小室膜孔附着于小室下表面的细胞30 min,结晶紫染色20 min。倒置显微镜下随机选择3个视野计数、拍照,取均值表示细胞侵袭数量。
(三)细胞迁移检 迁移实验与侵袭实验类似,不同之处在于Transwell上腔室未包被Matrigel基质胶。
六、蛋白质印记(western blot)检测MMP-2、MMP-9、Bcl-2和Bax蛋白表达
预冷的细胞裂解液提取细胞总蛋白,二喹啉甲酸法进行蛋白定量。将蛋白样品按照每泳道30 μg通过聚丙烯酰胺凝胶电泳分离,并转移至聚偏二氟乙烯膜。在室温下,将膜在5%脱脂牛奶中封闭1 h。洗膜后,将膜与1∶1000稀释的一抗4℃孵育过夜。洗膜后,将膜与1∶2000二抗室温孵育1 h。增强型化学发光底物显色。ImageJ软件检测各条带光密度值计算目的蛋白表达水平。
七、双荧光素酶报告基因实验
将含有miR-1298结合位点的circPDSS1野生型(WT)或突变型(MUT)序列片段克隆到psiCHECK-2载体,构建双荧光素酶报告基因载体WT-circPDSS1、MUT-circPDSS1。利用脂质体转染法将WT-circPDSS1、MUT-circPDSS1分别与miR-1298 mimics、miR-NC共转染,48 h后,使用双重荧光素酶报告基因测定系统检测细胞裂解物中的荧光素酶活性。
八、统计学分析
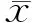
结 果
一、circPDSS1和miR-1298在肝癌组织中的表达
肝癌组织中circPDSS1表达量为3.41±0.33,与肝癌组织的1.00±0.06比较显著升高(P<0.05);肝癌组织中miR-1298表达量为0.42±0.04,与肝癌组织的1.00±0.07比较显著降低(P<0.05)。
二、抑制circPDSS1表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的影响
与si-NC组比较,si-circPDSS1组MHCC97H细胞circPDSS1的表达显著降低,侵袭和迁移细胞数、MMP-2蛋白、MMP-9蛋白和Bcl-2蛋白表达显著降低,细胞凋亡率、Bax蛋白表达显著升高(P<0.05)。见表1和图1。
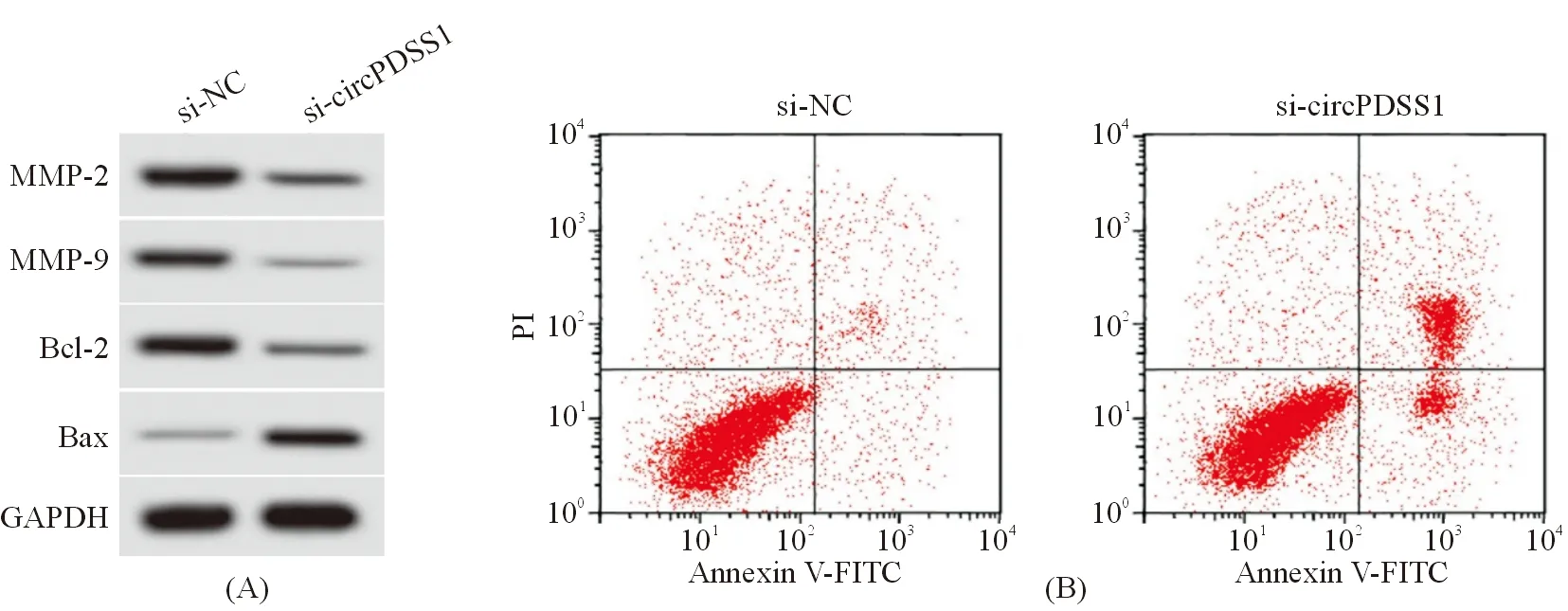
图1 抑制circPDSS1表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的影响

表1 抑制circPDSS1表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的影响(±s,n=9)
三、miR-1298过表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的影响
与miR-NC组比较,miR-1298组MHCC97H细胞miR-1298表达显著升高,侵袭和迁移细胞数、MMP-2蛋白、MMP-9蛋白和Bcl-2蛋白表达显著降低,细胞凋亡率、Bax蛋白表达显著升高(P<0.05)。见表2和图2。

图2 miR-1298过表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的影响

表2 miR-1298过表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的影响(±s,n=9)
四、circPDSS1靶向调控miR-1298的表达
Circular RNA Interactome预测显示,miR-1298与circPDSS1序列间存在结合位点,见图3。与miR-NC和WT-circPDSS1共转染组比较,miR-1298 mimics和WT-circPDSS1共转染组MHCC97H细胞的双荧光素酶活性显著降低(0.38±0.03 vs 0.97±0.07,P<0.05);与miR-NC和MUT-circPDSS1共转染组比较,miR-1298 mimics和MUT-circPDSS1共转染组MHCC97H细胞的双荧光素酶活性无显著变化(1.00±0.05 vs 0.98±0.05,P=0.409)。pcDNA-circPDSS1组MHCC97H细胞miR-1298表达较pcDNA组显著降低(0.58±0.04 vs 1.00±0.05,P<0.05);si-circPDSS1组MHCC97H细胞miR-1298表达较si-NC组显著升高(2.77±0.24 vs 1.02±0.05,P<0.05),见表5。提示,circPDSS1靶向负性调控miR-1298的表达。
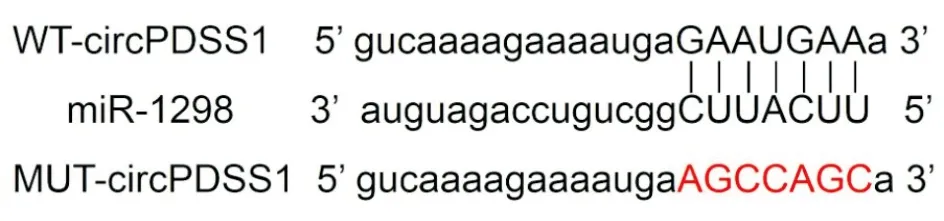
图3 circPDSS1的序列中含有与miR-1298互补的核苷酸序列
五、干扰miR-1298表达逆转了抑制circPDSS1表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的作用
与si-circPDSS1+anti-miR-NC组比较,si-circPDSS1+anti-miR-1298组MHCC97H细胞miR-1298表达显著降低,侵袭和迁移细胞数、MMP-2蛋白、MMP-9蛋白和Bcl-2蛋白表达显著升高,细胞凋亡率、Bax蛋白表达显著降低(P<0.05)。见表3和图4。
图4 干扰miR-1298表达逆转了抑制circPDSS1表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的作用

表3 干扰miR-1298表达逆转了抑制circPDSS1表达对肝癌MHCC97H细胞侵袭、迁移和凋亡的作用(±s,n=9)
讨 论
circPDSS1是已被鉴定为胃癌、膀胱癌的致癌基因,膀胱癌中circPDSS1表达增加,circPDSS1高表达导致膀胱癌细胞的增殖,侵袭和迁移速率增加[5-8]。本研究探讨circPDSS1在肝癌中作用发现,肝癌组织中circPDSS1表达较癌旁正常组织显著增加,说明circPDSS1高表达可能与肝癌进展有关。体外功能验证发现,转染si-circPDSS1抑制circPDSS1表达可降低肝癌细胞MHCC97H的迁移和侵袭能力。细胞迁移和侵袭是一个复杂的过程,涉及细胞外基质(ECM)降解。众所周知,MMPs可以降解ECM和基底膜,从而促进癌细胞的迁移和侵袭,且高水平的MMPs与癌细胞转移有关[9-10]。本研究显示,抑制circPDSS1可显著降低MMP2和MMP9表达水平,与功能实验结果吻合。此外,抑制circPDSS1还可降低抗凋亡蛋白Bcl-2表达,升高促凋亡蛋白Bax表达,提高细胞凋亡率。以上研究说明,circPDSS1在肝癌中具有癌基因作用。
研究表明circRNA通过与miRNA相互作用进而调控靶mRNA表达是其发挥作用的重要机制。hsa_circ_0001445通过抑制miR-17-3p和miR-181b-5p活性,促进金属蛋白酶抑制剂3(TIMP3)的表达,抑制肝癌细胞的增殖和迁移[11]。为探讨circPDSS1作用机制,本研究通过序列分析发现miR-1298是circPDSS1的潜在靶基因。既往研究显示,miR-1298在体内、外均能够抑制鼠类肉瘤病毒癌基因(KRAS)突变驱动的肺癌细胞生长,抑制膀胱癌细胞增殖,迁移和侵袭能力[12-13]。本研究显示肝癌组织中miR-1298表达降低,转染miR-1298 mimics可上调miR-1298表达可降低MHCC97H的迁移和侵袭能力,提高细胞凋亡率,并相应改变MMP2、MMP9、Bcl-2和Bax表达水平。进一步研究显示,miR-1298 mimics还可降低WT-circPDSS1的荧光素酶活性,而MUT-circPDSS1荧光素酶活性无显著变化,且过表达或抑制circPDSS1可分别降低或升高miR-1298的表达水平,提示circPDSS1对miR-1298具有靶向负调控作用。此外,干扰miR-1298表达还可逆转抑制circPDSS1对MHCC97H细胞迁移、迁移和凋亡的影响,这进一步说明circPDSS1通过靶向miR-1298参与调控肝癌细胞的迁移、侵袭和凋亡。
综上所述,本研究证实肝癌组织中circPDSS1表达增加,抑制circPDSS1通过上调miR-1298表达能够降低肝癌细胞的迁移和侵袭能力,诱导细胞凋亡,表明circPDSS1在肝癌中具有致癌作用,为临床肝癌治疗提供了潜在靶点。

