新型喜树碱衍生物PCC0208021的合成及其体外抗人结直肠癌细胞增殖作用
李 敏,魏颖杰,刘宗亮,邹方霞,王洪波,田京伟
(烟台大学药学院,新型制剂与生物技术药物研究山东省高校协同创新中心,分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
结直肠癌是最常见的恶性肿瘤之一,其发病率和死亡率均排名前五位,严重威胁人类的生命和健康[1]。NCCN 2018版《结直肠癌临床实践指南》指出,常用的化疗方案一般同时使用两种或三种化疗药物,其中喜树碱类衍生物伊立替康(CPT-11)是最常用药物之一[2]。
CPT-11属于喜树碱衍生物[3],于1994年在日本上市,并于1996年被美国FDA批准用于晚期结直肠癌的治疗[4]。CPT-11在体内被水解成活性成分SN-38,SN-38的体外抗肿瘤活性是CPT-11的100到1000倍[5]。尽管CPT-11显示出良好的抗肿瘤活性,但有腹泻、中性粒细胞减少和乏力等诸多不良反应[6]。CPT-11引起的腹泻有两种类型:早发性腹泻和迟发性腹泻,其中早发性腹泻是由乙酰胆碱综合征引起的,迟发性腹泻是剂量限制的毒性作用,可能是由SN-38导致的肠粘膜损伤引起的[7-8]。因此,寻找具有高抗肿瘤活性且低不良反应的新结构喜树碱衍生物将为临床患者带来更多的获益。通过化学合成得到了一种新的喜树碱类衍生物,将它命名为PCC0208021(图1),并在体外实验中显示出良好的抗肿瘤作用。该研究有望为临床提供抗肿瘤效果良好的新型喜树碱先导化合物。

图1 PCC0208021的结构
1 实验材料
1.1 细胞株
结直肠癌细胞系LS180、HCT116、CT-26和HT-29购自中国科学院上海细胞库。
1.2 药品与试剂
乙腈、丁二酸酐、乙酸乙酯、无水硫酸钠、N,N-二甲基甲酰胺、4-二甲氨基吡啶、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺购自伊诺凯科技有限公司(中国北京);SN-38购自上海瀚香生物科技有限公司(中国上海,批号:20190306);CPT-11购自上海瀚香生物科技有限公司(中国上海,批号:20170617);拓扑异构酶I药物筛选试剂盒购自博奥派克科技有限公司(中国上海);MTT检测试剂盒购自碧云天生物技术公司(中国上海);结晶紫染色液购自碧云天生物技术公司(中国上海);超纯溴化乙锭购自赛默飞(中国上海)。
1.3 主要仪器
光学显微镜(日本Olympus),CO2培养箱(日本SANYO公司),离心机(美国Beckman公司),电泳仪(美国Bio-Rad公司),凝胶成像仪(上海Tanon公司)。
2 实验方法
2.1 化学合成
2.1.1 化合物2的制备 向1 L烧瓶中加入化合物1 (5.42 g, 22 mmol)、 乙腈 (108.4 mL)、丁二酸酐 (2.0 g, 20 mmol)和4-二甲氨基吡啶 (3.7 g, 30 mmol),将反应混合物室温搅拌过夜。先浓缩,再加入乙酸乙酯稀释,用水洗涤,再用无水硫酸钠干燥有机相,浓缩至干,得到的残留物用制备HPLC分离,得到化合物2(2.1 g,30.3%产率)。LC-MSm/z: 347[M+H]+;RT=4.901 min。
2.1.2 化合物PCC0208021的制备 向含有化合物2(2.5 g, 7.22 mmol)的N,N-二甲基甲酰胺 (25 mL)溶液中添加化合物3(2.83 g, 7.22 mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺 (2.8 g,14.4 mmol)和4-二甲氨基吡啶 (88 mg, 0.722 mmol)。将反应混合物室温搅拌过夜。先浓缩,再加入乙酸乙酯稀释,用水洗涤,再用无水硫酸钠干燥有机相,浓缩至干,得到的残留物用HPLC分离,得到目标化合物PCC0208021 (2.1 g,40.3%产率),为白色固体。LC-MSm/z: 721 [M+H]+;RT=7.147 min。1H NMR (400 MHz, DMSO-d6)δ: 11.94 (d,J=4.8 Hz, 1H), 8.21 (d,J=9.2 Hz, 2H), 8.08 (d,J=6.8 Hz, 1H), 8.00 (d,J=2.0 Hz, 1H), 7.65 (m, 1H), 7.33(s, 1H), 6.52 (s, 1H), 5.76 (d,J=5.2 Hz, 2H), 5.44 (s, 2H), 5.34 (s, 2H), 4.91~4.88 (m, 1H), 4.47~4.45 (m, 1H), 4.08~4.04 (m, 1H), 3.20~3.14 (m, 2H), 3.01~2.98 (m, 2H), 2.86~2.83 (m, 2H), 1.92~1.82 (m, 2H), 1.35~1.23 (m, 7H), 0.90~0.86 (m, 3H)。HPLC: purity @254 nm: 98.35%; 214 nm: 98.70%。
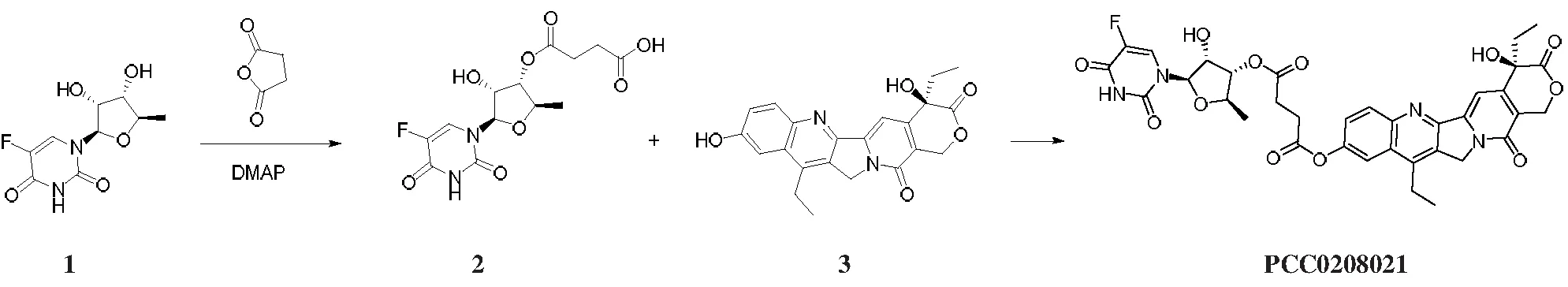
图2 PCC0208021的合成路线
2.2 细胞增殖实验
2.2.1 MTT实验检测PCC0208021 对结直肠癌细胞增殖的影响 LS180和CT-26在含10%胎牛血清的Roswell Park Memorial Institute(RPMI)1640培养基中培养,HCT116和HT-29含10%胎牛血清的McCoy's 5A(改良)培养基中培养。所有细胞在37 ℃,5% CO2培养箱中培养。四种结直肠癌细胞(LS180、HCT116、HT-29和CT-26)以3000个/孔(100 μL)分别接种96孔板,在37 ℃,5% CO2培养箱中培养过夜。待细胞贴壁后,分别加入不同浓度的PCC0208021、SN-38、CPT-11以及相应溶剂对照的培养基处理细胞,PCC0208021、SN-38和CPT-11浓度分别为20、6、2、0.3、0.1、0.03、0.01、0.003、0.001 μmol/L,每孔加入100 μL,每组设三个平行孔,在37 ℃,5% CO2培养箱中培养72 h后,每孔加入20 μL MTT(5 mg/mL),继续在37 ℃,5% CO2培养箱中孵育2 h,弃上清,每孔加入150 μL DMSO溶解生成的结晶产物MTT甲瓒沉淀,摇床充分震荡10 min,用酶标仪检测各组在570 nm波长下的吸光度。
2.2.2 平板克隆实验检测PCC0208021对结直肠癌细胞集落形成能力的影响 选用两种贴壁性强且能形成集落的结直肠癌细胞LS180和HCT116,将结直肠癌细胞LS180和HCT116接种于六孔板,300个/孔(2 mL),在37 ℃,5% CO2培养箱中培养过夜。分别加入浓度为0.02、0.04 μmol/L的PCC0208021、0.04 μmol/L的SN-38、3 μmol/L的CPT-11以及相应溶剂对照的培养基处理细胞,每组设三个平行孔。孵育14 d(每3 d换一次液),结晶紫染色,拍照并进行集落数的统计。
2.3 PCC0208021抗肿瘤机制研究
2.3.1 拓扑异构酶I的酶活性检测实验 在20 μL的体系中加入10×TGS Buffer 2 μL、超螺旋质粒DNA(pHOT 1) 2 μL、PCC0208021/阳性对照2 μL、含有4U Topo I 2 μL,在37 ℃孵育30 min,加入2 μL 10% SDS终止反应,加入2 μL蛋白酶K在37 ℃孵育15 min,最后补充ddH2O至20 μL。加入2 μL 10倍的上样缓冲液,样品加到1%琼脂糖凝胶上,70 V电泳至溴酚蓝的染料层在凝胶的70%~80%,用0.5 μg/mL溴化乙锭浸泡15 min染色,流水冲洗15 min,凝胶成像仪拍照[9-10]。
2.3.2 分子对接实验 小分子的准备:首先应用Chemdraw 14.0绘制PCC0208021的2D结构(图1),然后经由Discovery Studio 2018 (DS 2018)转为3D构象,并通过“CHARMm Minimization”模块,对PCC0208021进行初步能量优化。将处理的化合物使用DS 2018中的“Minimize Ligand”模块进行后续对接准备,主要包括以下两个方面:(1) Algorithm设置为Steepest Descent,Max Steps 5000, RMC Gradient 0.01;(2) Algorithm设置为Conjugate Gradient,Max Steps 5000, RMC Gradient 0.01。最后,小分子已经处理完毕以备对接。
Topo I-DNA受体复合物处理:选取Topo I-DNA和Topotecan的晶体复合物 (PDB号:1K4T)为对接中的蛋白受体,活性位点则选择Topotecan所在的区域。其中Topo I-DNA受体复合物的准备采用“Prepare Protein”模块,步骤如下:(1) 将水分子尽数除去,加入全部氢原子;(2)对非标准名称、非完整的氨基酸及某一残基同时存在的多种构象等问题进行校正;(3)赋予CHARMm力场对蛋白的能量收敛;(4)其他参数保持默认值。
分子对接:采用的是Discovery Studio 2018 中的“Dock Ligands (CDOCKER)”模块,主要是模拟PCC0208021和Topotecan在Topo I-DNA受体复合物的结合相似性。对接步骤如下:将处理Topo I-DNA设置为Receptor,定义晶体的配体分子Topotecan所在区域为活性位点,半径设置为0.9 nm,其余默认。点击“Run”运行工作[11]。
2.4 统计学方法
3 实验结果
3.1 目标化合物的合成 通过化学合成得到PCC0208021 2.1 g,其产率为40.3%,性状为白色固体,纯度为98.35%。
3.2 细胞增殖实验
3.2.1 MTT实验 评估了PCC0208021对四种结直肠癌细胞(LS180、HCT116、HT-29和CT-26)增殖抑制作用,实验结果如表1所示,PCC0208021对四种结直肠癌细胞具有良好的抗肿瘤活性,计算得PCC0208021对LS180、HCT116、HT-29和CT-26的IC50值分别为0.030、0.795、0.424和1.504 μmol/L,体外活性与SN-38相当,强于CPT-11。

表1 PCC0208021对LS180、HCT116、HT-29和CT-26细胞的抑制作用
3.2.2 平板克隆实验 PCC0208021作用细胞14 d后,与对照组相比,PCC0208021能显著抑制LS180和HCT116细胞集落形成(图3)。在0.02 μmol/L和0.04 μmol/L PCC0208021处理下,LS180细胞集落形成抑制率分别为33.86%和66.82%,对HCT116细胞集落形成抑制率分别为44.28%和59.28%。
3.3 PCC0208021抗肿瘤机制研究
3.3.1 拓扑异构酶I的酶活性检测实验 如图4所示,DNA质粒处于超螺旋的状态,加入Topo I后,超螺旋的DNA被Topo I松弛。PCC0208021可以抑制超螺旋DNA的松弛,且呈剂量依赖性。阳性化合物SN-38抑制了超螺旋DNA的松弛。PCC0208021以类似于SN-38的方式抑制超螺旋DNA的弛豫。

与对照组相比,*P<0.05。
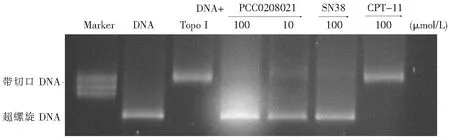
图4 PCC0208021对拓扑异构酶I酶活性的影响
3.3.2 分子对接实验 前期研究发现,Topotecan与Topo I-DNA的结合模式较为独特:Topotecan整个分子被ASN352、GLU356、ARG364、ASP533、ILE535、THR718和ASN722氨基酸包围。其中,酚羟基可与GLU356的羧基形成氢键,六元内脂环上的氧原子与THR718形成另一极性相互作用。这些作用力有助于Topotecan与Topo I-DNA稳定结合,从而产生抑制效果。
与Topotecan和Topo I-DNA形成的结合构象类似,PCC0208021与周围氨基酸形成的作用力如下:内酯环上的氧原子与THR718形成了氢键,11位氟原子跟MET428形成疏水作用,四氢呋喃环上的甲基与GLU356形成疏水作用。这些保证了PCC0208021的结合模式与Topotecan类似,且对Topo I-DNA产生抑制效果。
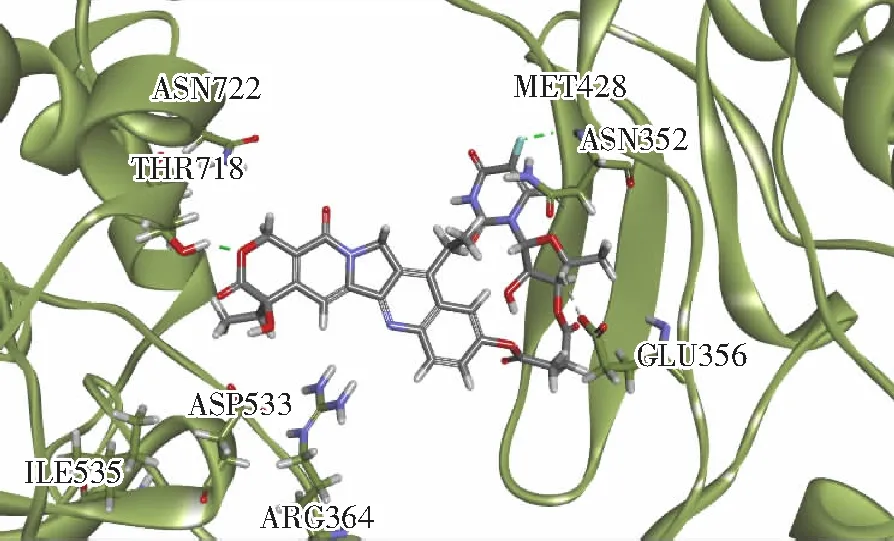
图5 分子对接检测PCC0208021与Topo I-DNA 的结合
Fig.5 Binding of PCC0208021 with Topo I-DNA estimated by molecular docking
4 讨论与结论
结直肠癌的发病率和死亡率均排名前五位,严重威胁人类的健康。喜树碱类抗肿瘤药CPT-11是结直肠癌的临床一线用药,其副作用大大限制了它的临床使用,因此寻找新型喜树碱衍生物成为研究的热点之一。CPT-11在体内被水解成其活性成分SN-38,从而发挥抗肿瘤效果[3],为此本研究基于SN-38结构合成了一种代号为PCC0208021的新型喜树碱衍生物。PCC0208021的化学合成是一种经典的成酯反应,操作简单。
MTT实验和平板克隆实验证明PCC0208021可以抑制结直肠癌的增殖和集落的形成,并且抑制作用随剂量的增加而增强。Topo I是人体必需的酶,是喜树碱类化合物的作用靶点。喜树碱类药物可通过形成喜树碱-DNA-Topo I的三元复合物抑制Topo I的活性,进而诱导DNA损伤最终导致肿瘤细胞的死亡[12]。为了验证PCC0208021的作用靶点,通过Topo I的酶活性实验发现PCC0208021以类似于SN-38的形式抑制Topo I的活性。通过分子对接实验,发现PCC0208021可直接与Topo I结合。以上实验结果证明了PCC0208021的靶点也是Topo I。新型喜树碱衍生物PCC0208021的体内抗肿瘤活性及安全性尚需要进行进一步的研究。
本研究首次合成了具有新结构、强Topo I抑制活性的喜树碱衍生物PCC0208021,该化合物体外具有较强的细胞增殖抑制活性,是一种良好的新型喜树碱的先导化合物。

