血清EPCA-2与尿PCA3联合检测诊断PSA灰区前列腺癌的研究
聂 勇 王 超 吴江锋 张德华 黄品信 杨兴国 曹 君 张 宇 石文仲
(1. 宜昌市夷陵医院 泌尿外科, 湖北 宜昌 443100; 2. 三峡大学 医学院, 湖北 宜昌 443002)
随着我国人均寿命的不断增长与生活水平的逐步提高,男性前列腺癌的发病率出现快速上升。目前前列腺癌的诊断主要依据病史、直肠指诊、前列腺特异性抗原(prostate specific antigen,PSA)检测、经直肠超声检查、磁共振检查等,确诊主要依靠前列腺穿刺活检或病理学检查。随着研究的深入,临床单一检测PSA常发生不必要的误诊及漏诊,检测结果容易受到其他疾病或检查的影响,特别是对PSA值在4~10 ng/mL的灰区患者,诊断结果缺乏特异性[1]。前列腺穿刺活检为创伤性检查,可能并发感染、出血、肿瘤种植及迷走神经反射等并发症[2]。随着分子生物学、基因技术的发展,前列腺癌诊断的新型标志物不断涌现,多种标志物联合应用可以有效提高前列腺癌早期诊断的特异度和敏感度。早期前列腺癌抗原-2(early prostate cancer antigen-2,EPCA-2)是一种与前列腺癌相关的核基质蛋白,有研究表明它能较病理切片提前5年或更早时间准确地诊断出前列腺癌,提示其可作为前列腺癌筛查的肿瘤标记物[3]。而前列腺癌抗原3(prostate cancer atigen 3,PCA3),是前列腺癌特异性基因,在前列腺癌组织中呈高表达,在正常前列腺中表达水平较低,在其他正常组织、血液或其他肿瘤标本中不表达[4]。为提高PSA灰区前列腺癌患者的早期诊断率,本研究拟探讨联合检测血清EPCA-2与尿液中PCA3对早期诊断PSA灰区前列腺癌的应用价值。
1 资料与方法
1.1 临床资料
收集我院2016年2月~2020年10月收治的PSA灰区男性患者180例,包括前列腺癌组46例和前列腺良性增生组134例。纳入标准:依据中国前列腺癌诊疗指南,诊断金标准为前列腺穿刺活检[2],所有患者均经直肠穿刺活检病理确诊。排除标准:①检测前1周内行导尿、前列腺按摩、直肠指诊、经尿道器械检查操作;②1个月内有前列腺穿刺、3个月内有急慢性前列腺炎病史者;③有尿潴留、前列腺手术史及口服5α-还原酶抑制剂等药物;④有其他肿瘤患者;⑤血清PSA不在4~10 ng/mL者。同时选取健康体检者120例作为正常对照组。本研究经我院伦理委员会批准,患者均签署书面知情同意书。伦理批准号:KY2016-01-2802。
1.2 主要仪器和试剂
1.2.1 主要仪器
美国Biorad公司生产酶标仪(型号为BR550)、杭州安誉科技有限公司生产AGS实时荧光PCR仪、广州景颐光电科技有限公司产微量分光光度计721、瑞士罗氏公司生产电化学发光分析仪。
1.2.2 主要试剂
EPCA-2酶联免疫试剂盒由上海研吉生物科技有限公司生产;PCA3检测试剂盒购自苏州为真生物医药科技有限公司。
1.3 血清PSA的检测
采集患者外周静脉血5 mL,分离出血清,冷冻保存备用。采用化学发光免疫染色法,按照PSA检测试剂盒(瑞士罗氏公司生产)说明书检测患者血清PSA含量。
1.4 血清EPCA-2的检测
所有患者入院第2 d清晨空腹采血,收集血清标本。所用的试管无热原和内毒素等,避免任何实验操作过程中对细胞的刺激。血液采集后,3 000 rpm/min离心分离血清,标本如果无法立即检测可先于-20℃冰箱保存。采用 EPCA-2酶联免疫试剂盒检测三组患者血清EPCA-2水平,实验操作严格按照说明书进行。利用酶标仪在450 nm波长下测定OD值,采用标准曲线计算样品中EPCA-2的浓度,绘制ROC曲线获得阈值、敏感度及特异度。
1.5 尿液PCA3的检测
嘱患者排出晨尿后,适量饮水,当有明显尿意时,进行前列腺按摩并收集尿液标本。具体方法为传统前列腺按摩法:患者取截石位,检查者对其作直肠指诊,当触及前列腺后,分别从左、右两侧叶对称性地向中央沟方向用力按摩 3~4次,再从前列腺底部向尖部按摩中央沟 3~4 次,然后嘱患者排尿。采用高压灭菌后的Rnase-free试管收集初始段尿液30 mL,3 000 rpm/min离心10 min,收集尿沉渣,加等量冷D-hanks液洗涤2次,-70℃保存备用。
RNA的抽提:根据试剂盒说明书提取总RNA,微量分光光度计测RNA的含量及A260/A280比值。根据逆转录试剂盒说明书合成cDNA,采用RT-PCR半定量法检测尿液PCA3的表达。PCA3引物序列为:上游引物TGGGAAGGACCTGATG ATACA,下游引物CCCAGGGATCTCTGTGCTT。扩增产物经凝胶电泳鉴定,以PCA3阳性表达为判断标准。
1.6 统计学方法
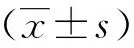
2 结果
2.1 前列腺癌组、前列腺良性增生组和正常对照组基线资料
表1为三组的基本临床资料。三组年龄差异无统计学意义(均P>0.05)。三组间血清PSA有统计学差异(P<0.05),前列腺癌组PSA高于正常对照组(P<0.05)。

表1 前列腺癌组、前列腺良性增生组和正常对照组基线资料比较
2.2 EPCA-2单独鉴别前列腺癌和前列腺增生的诊断价值
与正常对照组相比,前列腺癌组与前列腺良性增生组EPCA-2均增高,且均有统计学差异(均P<0.05),见表1。绘制前列腺癌组与前列腺良性增生组血清EPCA-2的ROC曲线,以18.57 ng/mL为EPCA-2的阈值,其单独鉴别前列腺癌和前列腺增生特异度为79.50%,敏感度为67.70%,见图1。
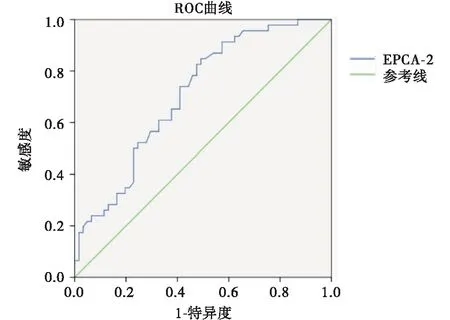
图1 前列腺癌组与前列腺增生组血清EPCA-2的ROC曲线
2.3 PCA3单独鉴别前列腺癌和前列腺增生的诊断价值
PCA3在前列腺癌组中可见阳性表达29例,17例为阴性;前列腺良性增生组可见阳性表达8例,阴性126例;PCA3在前列腺癌组阳性表达较高,在前列腺良性增生组中有少量阳性表达,正常对照组均无阳性表达,三组间阳性表达差异有统计学意义(P<0.05)。PCA3单独鉴别前列腺癌和前列腺增生的敏感度和特异度分别为63.04%和94.03%,见表2。

表2 前列腺癌组、前列腺良性增生组PCA3表达情况
2.4 EPCA-2、PCA3对PSA灰区前列腺癌协同诊断的效能分析
EPCA-2并联PCA3对PSA灰区前列腺癌协同诊断,其敏感度为76.08%,特异度为85.82%,见表3。提示联合检测可用于PSA灰区前列腺癌与良性前列腺增生的鉴别诊断。

表3 EPCA-2、PCA3对PSA灰区前列腺癌协同诊断的效能分析
3 讨论
前列腺癌是男性泌尿系统常见的恶性肿瘤[5-7],近年来在我国发病率亦呈现快速增长趋势[8-10]。目前PSA仍是临床上用于筛查前列腺癌的主要检测指标。它是由前列腺腺泡和导管上皮细胞分泌的一种单链糖蛋白,具有组织特异性[1]。前列腺癌患者的血清PSA可有不同程度升高,但在各种前列腺炎、前列腺良性病变、急性尿潴留以及前列腺组织损伤性操作时也可出现PSA的反应性增高,使得PSA检测的特异性受到影响[10-14]。特别是在4~10 ng/mL(灰区)时,PSA缺乏足够的特异度和灵敏度,即便采用PSA相关衍生指标如游离型PSA、结合型PSA、PSA速率、PSA密度等仍可能漏诊,而此类患者前列腺穿刺活检的阳性率仅20%左右,重复穿刺或者筛查可能造成过度医疗,加重患者痛苦及经济负担,也不能从根本上解决PSA本身特异性低等问题[1]。因此,寻找有效的肿瘤标志物一直是泌尿外科研究的热点。
近几年,多种新型前列腺癌的诊断标志物不断涌现,采用多种标志物联合检测可能是肿瘤诊断和早期筛查的趋势,能够提高前列腺癌的早期诊断率。EPCA-2是EPCA的亚型,是与前列腺癌相关的核基质蛋白之一[15]。研究发现,EPCA-2具有组织细胞特异性及肿瘤相关性,可以用于早期诊断前列腺癌。若以EPCA-2>30 ng/mL为前列腺癌的判定标准,总体上约94%的前列腺癌患者可以通过EPCA-2检测出来[16]。提示EPCA-2可以作为前列腺癌筛查的肿瘤标记物之一。
相较于血清PSA,PCA3为前列腺癌所特有,其水平不受前列腺疾病、前列腺或尿道侵入性操作等影响,可以作为比较可靠的前列腺癌的诊断标志物。PCA3在前列腺癌中表达明显增高,并可在多种体液,如血液、尿液、精液和前列腺液中检出[17-20]。Merola等[21]发现,与tPSA及f/t PSA相比,PCA3诊断前列腺癌的准确性更高,且PCA3评分与活检阳性率呈正相关。有学者研究发现,对于判断首次前列腺穿刺活检阴性,但血清PSA仍升高者是否需再次活检时,PCA3检测能发挥一定的作用[22]。当PSA处于灰区时,尿PCA-3可帮助减少不必要的穿刺活检,提高PSA灰区前列腺癌的诊断阳性率[23]。
目前联合检测EPCA-2与PCA3用于PSA灰区前列腺癌诊断的研究较少[24]。本研究发现,前列腺癌组EPCA-2的含量较高,而前列腺增生组及正常对照组均偏低;以18.57 ng/mL为EPCA-2的阈值,其单独鉴别前列腺癌和前列腺增生特异度为79.50%,敏感度为67.70%;尿液PCA3在前列腺癌组中可见阳性表达29例,前列腺良性增生组8例,正常对照组均无阳性表达。说明尿液PCA3可鉴别出早期前列腺癌患者,但单一指标存在一定局限性,可能引起漏诊[25]。据此我们推测,联合检测EPCA-2及PCA3可以发挥协同诊断作用,结果表明EPCA-2并联PCA3对PSA灰区前列腺癌协同诊断,其敏感度为76.08%,特异度为85.82%。本研究说明EPCA-2和PCA3联合检测可用于PSA灰区前列腺癌与前列腺增生症的早期筛查,提高诊断率,避免不必要的前列腺穿刺活检。本研究由于受入组病例数的限制,研究结论仍有待于大样本、多中心的研究进一步验证。

