盐浓度对自制香肠理化因子及原核微生物群落多样性的影响
孙 筱
(石家庄职业技术学院 食品与药品工程系,河北 石家庄 050081)
香肠是我国传统的腌腊肉制品,通常由搅碎的生猪肉、盐、糖、白酒、料酒等原料在自然环境下发酵25~30 d制成[1]。香肠因具有醇香可口、外形美观、色泽鲜艳、皮薄肉嫩等特点,深受广大中国消费者喜爱[2]。香肠在发酵过程中经历了多种微生物的更迭及复杂的物理化学变化,而香肠的发酵会受到盐度和温度等工艺条件的影响。盐作为重要的配料,一直被用来改善咸味和延长肉制品保质期。盐可以抑制发酵过程中有害微生物的生长代谢。此外,盐也能降低乳酸菌的生物量和代谢速率[3]。因此,盐可以直接或间接地影响香肠发酵过程中微生物群落结构,从而影响香肠的品质特征。ROSEIRO L C等[4]研究对比发现,6%盐浓度的葡式干发酵香肠相比3%盐浓度的香肠在成熟后具有更低的pH值和水分含量。黄郑朝等[5]研究发现,不同工艺和地域的传统发酵香肠的微生物组成存在差异。此外,田星等[6]研究发现,食盐添加量为3%时,香肠出品率和保水性最好。
16S rRNA高通量测序技术和生物信息学分析可以全面解析传统酿造食品的微生物群落组成,从而了解各种酿造微生物的发酵功能。许多研究表明,香肠发酵初期主要以弧菌属(Vibrio)、不动杆菌属(Acinetobater)、肠杆菌属(Enterobacter)、耶尔森菌属(Yersinia)和环丝菌属(Brochothrix)为主,而后期则以乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和葡萄球菌属(Staphylococcus)为主[2,7]。香肠发酵作为一种典型的厌氧发酵微生态系统,有利于乳酸菌等厌氧微生物的增殖。研究表明,明串珠菌属(Leuconostoc)是低盐香肠发酵中期的优势微生物,随着发酵的不断进行,乳杆菌属(Lactobacillus)为低盐香肠后期的优势菌群[8-9]。此外,DI GIOIA D等[10]研究发现,意大利发酵香肠中的乳酸菌可以代谢碳水化合物生成有机酸,并且产生细菌素抑制其他病原菌的生长繁殖。
本研究基于16S rRNA高通量测序技术探究盐浓度对自制香肠原核微生物多样性及理化因子的影响,揭示不同盐浓度处理下香肠原核微生物群落的结构组成差异,通过冗余分析(redundancy analysis,RDA)确定理化因子与原核微生物群落的关系。为探明自制香肠原核微生物多样性、不同盐浓度对香肠原核微生物多样性的影响及香肠发酵微生态调控提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
新鲜生猪肉、肠衣、食盐、糖:市售。
硝酸银、氯化钠、铬酸钾、碘化钾、乙酸、硫代硫酸钠(均为分析纯):国药集团化学试剂有限公司;PowerSoil脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Mobio公司;Q5高保真DNA聚合酶:英国NEB公司;细菌16S rDNA V3-V4区扩增引物(338F:5'-ACTCCTACGGGAGGCAGCA-3'和806R:5'-GGACTACHVGGGTWTCTAAT-3'):广州基迪奥生物科技有限公司。
1.2 仪器与设备
PB-10型pH计:德国Sartorius公司;TGL-20M型高速冷冻离心机:上海卢湘仪离心机仪器有限公司;Illumina Miseq PE250型测序仪:美国Illumina公司;NanoDrop 2000型超微量分光光度计:美国Thermo公司。
1.3 实验方法
1.3.1 香肠的制作
参考WANG X H等[7]的工艺制作香肠,具体方法如下:将新鲜生猪肉分为瘦肉和肥肉,切成2.0 cm×1.0 cm×0.5 cm的块状,分别加入3%蔗糖、2%白酒、1%料酒和1%酱油,最后加入不同质量分数的食盐(不添加食盐:Z组;添加食盐质量分数2%:T组;添加食盐质量分数4%:F组;添加食盐质量分数6%:S组),充分混匀,将混合物装入直径为10 cm的天然肠衣中。将香肠置于10~15 ℃的环境进行自然发酵30 d。在发酵完成后收集各组香肠样本,并储存于-20 ℃冰箱中,用于DNA提取及理化因子测定。
1.3.2 理化指标分析
使用pH计测定香肠样品的pH值;参照国标GB 5009.3—2016《食品中水分的测定》测定水分的含量[11];参照国标GB 5009.44—2016《食品中氯化物的测定》测定氯化钠的含量[12];参照国标GB/T 5009.37—2003《食用植物油卫生标准分析方法》测定过氧化值[13]。
1.3.3 DNA提取与Miseq高通量测序
1.3.4 序列分析
将测序数据根据条形码进行划分,并使用FLASH软件[14]进行拼接,随后使用Trimmomatic软件[15]过滤低质量的序列,利用UCHIME软件[16]去除嵌合体,得到优质序列。根据USEARCH软件[17]在相似性97%的水平上进行操作分类单元(operational taxonomic unit,OTU)聚类,得到代表序列。使用Silva 138数据库[18]对代表序列进行比对注释,生成不同分类水平上的物种丰度表,并删除不能注释到门水平的OTU。基于OTU表计算各样品的α-多样性指数及各注释水平的相对丰度。使用R软件实现未加权(unweighted)UniFrac距离算法的主坐标分析(principal coordinates analysis,PCoA)与冗余分析。
1.3.5 统计分析
所有柱状图均用Graphpad Prism软件绘制。采用SPSS 20.0软件进行方差分析,P<0.05 时认为具有显著差异。
2 结果与分析
2.1 盐浓度对香肠理化性质的影响
不同盐浓度对香肠pH、水分含量、盐度和过氧化值的影响见图1。

图1 盐浓度对香肠pH值(A)、水分含量(B)、盐度(C)和过氧化值(D)的影响Fig.1 Effect of salt concentration on pH value (A),moisture contents (B),salinity (C) and peroxide value (D) of sausage
由图1可知,相比Z组,添加食盐均会显著降低香肠pH(P<0.05),而F组pH最低,为5.84,与S组无显著差异(P>0.05)。盐会抑制有害微生物分解蛋白质产生胺、氨等碱性物质[19]。此外,盐会促进乳酸菌的大量繁殖分解碳水化合物产生乳酸,导致产品pH下降[19]。水分含量随着盐浓度的升高而降低。相比Z组,添加食盐均会显著降低香肠的水分含量(P<0.05),但F和S组无显著差异(P>0.05)。Z、T、F和S组的盐度分别约为0、1.71%、3.46%和5.58%。过氧化物是脂类氧化的第一个中间产物,其性质极不稳定,可分解为醛、酮及酸等小分子物质[20],因此过氧化值可反映香肠受到氧化的程度。Z组的过氧化值最高,可达25.12 mmol/kg,显著高于T、F和S组(P<0.05),而T、F和S组的过氧化值在18.59~19.76 mmol/kg之间,表明盐可以降低香肠的过氧化值。过氧化值过高会使香肠产生哈败味,但适量范围内的过氧化值有益于香肠独特风味的形成[21]。
2.2 盐浓度对测序数据与α-多样性的影响
不同盐浓度对香肠测序数据和α-多样性的影响见表1。由表1可知,不同盐浓度香肠样品(12个)的Illumina Miseq测序原始序列经过样本拆分、拼接和过滤后共获得653 001条优质序列,且各组样品的优质序列数目无显著差异(P<0.05)。香肠样品的测序覆盖率均在97%以上,且各组样品之间无显著差异(P<0.05),表明测序结果足以表征香肠中原核微生物群落的多样性。与Z组相比,T组、F组和S组具有较少的OTU和Chao1指数(P<0.05),说明盐会抑制不耐盐微生物的生长繁殖,从而改变香肠内的原核微生物群落结构。该结果与GAN X等[22]研究结果相一致。此外,除T组的Simpson指数之外,T组、F组和S组的Shannon指数和Simpson指数均显著低于Z组(P<0.05),进一步说明盐的加入会降低香肠内的原核微生物的物种多样性。OTU、Chao1指数、Shannon指数和Simpson指数均存在盐浓度抑制性,随着盐度的不断增加,这些α-多样性参数均呈下降趋势,但F组和S组的α-多样性参数均无显著差异(P<0.05)。上述结果与图1的结果相一致,推测这种现象与香肠发酵环境有关,食盐添加量会影响微生物群落结构,从而改变群落α-多样性[22]。
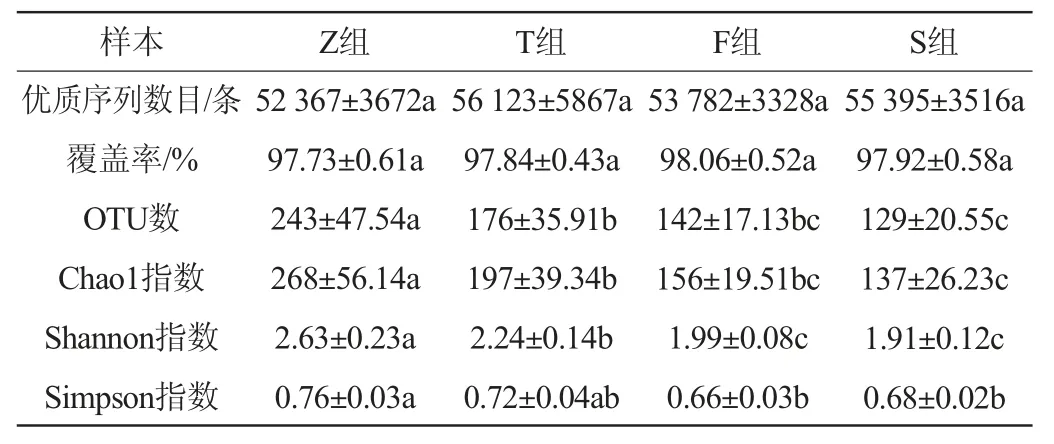
表1 盐浓度对香肠原核微生物群落序列数量和α-多样性参数的影响Table 1 Effect of salt concentration on sequence numbers and α-diversity parameter of prokaryotic microbial communities of sausage
2.3 盐浓度对β-多样性的影响
基于未加权UniFrac距离算法将OTUs缩放至距离矩阵中,随后使用PCoA比较不同盐浓度香肠内原核微生物群落的差异。不同盐浓度对香肠β-多样性的影响见图2。由图2可知,PCoA第一轴和第二轴显示物种累积百分比方差值分别为90.54%和2.69%。总的来说,93.23%的物种差异可以用两个轴来解释。不同盐浓度香肠样品中原核微生物群落结构的组间差异显著(不同盐浓度香肠样品在其投影平面上的距离较远),尤其是Z组和其他组之间的差异较大。上述结果表明不同盐浓度香肠内原核微生物类群呈现出明显的组成差异,与CHEN J X等[23]研究结果相一致。

图2 盐浓度对香肠原核微生物群落β-多样性的影响Fig.2 Effect of salt concentration on β-diversity of prokaryotic microbial communities of sausage
2.4 盐浓度对原核微生物群落组成与结构的影响
不同盐浓度对香肠内原核微生物群落门水平的影响见图3。由图3可知,经OTUs注释,所有样品中共检测到12个可鉴定门,其中最主要的门是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、弯曲杆菌门(Campilobacterota)和拟杆菌门(Bacteroidota)。厚壁菌门和变形菌门在香肠中占绝对优势地位,二者之和占总相对丰度的98%以上。随着盐度的不断增加,厚壁菌门的平均相对丰度从63.52%升高至88.81%;而变形菌门的平均相对丰度则持续降低,从34.36%降低至10.01%。上述结果表明,盐主要是通过改变厚壁菌门与变形菌门的比例来调节香肠内原核微生物群落结构。
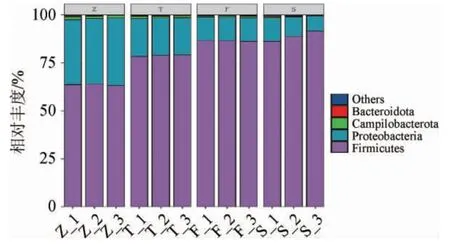
图3 盐浓度对香肠原核微生物群落门水平的影响Fig.3 Effect of salt concentration on phylum level of prokaryotic microbial communities of sausage
不同盐浓度对香肠内原核微生物群落属水平的影响见图4。由图4可知,基于层次聚类分析(hierarchical cluster analysis,HCA)可将所有样品划分为2个簇,Z组样品单独聚为1簇(Ⅰ),其他组样品聚为另一簇(Ⅱ);第Ⅱ簇又可以分为3个亚簇,T组样品聚在第ⅰ亚簇,S组样品聚在第ⅱ亚簇,F组样品聚在第ⅲ亚簇,该结果与图2的结果相一致,说明盐会显著改变香肠样品中原核微生物的组成。在属水平上,香肠中较多的是乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、弧菌属(Vibrio)、乳球菌属(Lactococcus)、不动杆菌属(Acinetobacter)。弧菌属和不动杆菌属是腐败致病菌,其在Z组中相对丰度分别为18.66%和7.49%,而其他添加食盐组的样本中弧菌属和不动杆菌属的相对丰度范围分别为1.19%~7.34%和0.23%~4.22%,与Z组差异显著(P<0.05)。弧菌属是食品中的致病菌,会引发腹泻、呕吐、头痛等[24]。不动杆菌属是肉制品中常见的腐败菌之一,具有不耐酸和不能利用葡萄糖等特征[25]。
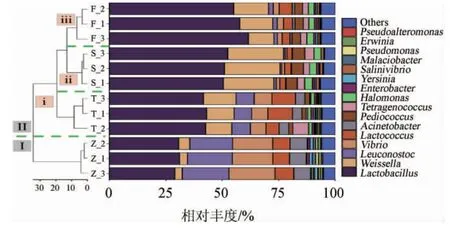
图4 盐浓度对香肠原核微生物群落属水平的影响Fig.4 Effect of salt concentration on genus level of prokaryotic microbial communities of sausage
欧文氏菌属(Erwinia)、明串珠菌属(Leuconostoc)、Malaciobacter、假单胞菌属(Pseudomonas)和耶尔森氏菌属(Yersinia)主要在Z组中富集,随着盐度的不断升高,这些微生物的平均相对丰度持续降低。乳杆菌属是香肠中占比最大的微生物,其相对丰度在30.29%~58.15%。相比Z组,添加食盐可显著增加乳杆菌属相对丰度(P<0.05),其F组中乳杆菌属的相对丰度最高。乳酸菌可能来源于肉类和自然环境,可将肉类中的小分子糖类物质转化为酸类化合物,赋予香肠柔和的酸感[26]。此外,乳酸菌可通过蛋白水解系统将发酵基质中可溶性蛋白分解短肽和氨基酸等小分子代谢产物,从而赋予产品独特的鲜味特征[27]。
魏斯氏菌属相对丰度随盐度的不断增加呈逐渐升高的趋势,在Z组中相对丰度最低,仅为3.89%;而在T组、F组和S组中分别可达12.73%、13.76%和23.90%,成为优势菌属。魏斯氏菌属具有耐盐等特性,且可以代谢碳水化合物,为其自身生长繁殖提供能量[2]。此外,魏斯氏菌属和乳杆菌属是互利共生关系,魏斯氏菌属可以合成葡萄聚糖、异麦芽低聚糖等低聚糖来促进乳杆菌属中益生菌的增长[28],导致乳杆菌属成为香肠中丰度最高的优势属,而乳杆菌属产生的酸性代谢物质会抑制不耐酸微生物的生长繁殖,减弱与魏斯氏菌属对碳源的竞争。盐单胞菌属(Halomonas)、片球菌属(Pediococcus)、盐弧菌属(Salinivibrio)和四联球菌属(Tetragenococcus)的变化趋势与魏斯氏菌属(Weissella)的变化相一致,其在Z组的相对丰度分别为0.38%、0.13%、0和0,而在S组的相对丰度分别为3.23%、5.25%、1.21%和3.33%。盐单胞菌属和片球菌属具有耐盐的特性,能分解葡萄糖,产生多种风味物质[29]。四联球菌属广泛存在与含盐的腌制类发酵食品中,可参与氨基酸的合成及生成醛、醇、酮和酯等挥发性风味物质,从而提升发酵食品的风味和口感[29]。
2.5 理化因子与原核微生物群落的相关性
理化因子是影响酿造食品微生物群落组成的主要因素。在本研究中,冗余分析被用来辨别香肠原核微生物群落和理化因子之间的相关性。理化因子与原核微生物群落的相关性见图5。由图5可知,理化因子对原核微生物群落结构前两个标准轴的解释贡献率分别为60.46%和10.64%,可将不同盐度香肠样品较好的区分开。多个理化因子共同影响香肠中原核微生物群落结构,其中Z组原核微生物群落与水分含量、pH值、过氧化值呈正相关;T组原核微生物群落只与水分含量呈正相关;而F组和S组则与盐度呈正相关。此外,乳杆菌属(Lactobacillus)与水分含量呈正相关;弧菌属(Vibrio)、不动杆菌属(Acinetobacter)、欧文氏菌属(Erwinia)、明串珠菌属(Leuconostoc)和乳球菌属(Lacto coccus)与水分含量、pH值、过氧化值呈正相关;盐单胞菌属(Halomonas)、片球菌属(Pediococcus)、盐弧菌属(Salinivibrio)、四联球菌属(Tetragenococcus)和魏斯氏菌属(Weissella)与盐度呈正相关。利用条件限制分析探究每个理化因子对原核微生物群落结构的影响程度,其中盐度(30.29%)对菌群的影响最大,其次为pH(26.08%),进一步说明多个理化因子共同决定不同盐度香肠原核微生物群落的变化。

图5 香肠样品的原核微生物群落和理化因子冗余分析Fig.5 Redundancy analysis of prokaryotic microbial communities and physicochemical factors of sausage samples
3 结论
本研究采用16S rRNA高通量测序技术揭示盐浓度对自制香肠原核微生物群落多样性的影响,同时分析盐浓度对自制香肠理化因子的影响。盐可以显著影响pH、水分含量及过氧化值,并且也会显著影响原核微生物的多样性和组成。随着盐浓度的不断增加,OTU、Chao1指数、Shannon指数和Simpson指数均呈下降趋势。在门水平上,厚壁菌门和变形菌门占绝对优势地位,厚壁菌门的平均相对丰度随香肠中盐浓度升高而增加,而变形菌门则呈相反的变化趋势。在属水平上,乳杆菌属是香肠原核微生物的绝对优势菌属,其相对丰度在30.29%~58.15%范围之间。明串珠菌属、弧菌属、不动杆菌属、魏斯氏菌属、盐单胞菌属、片球菌属、盐弧菌属和四联球菌属受盐添加量的影响显著。此外,冗余分析结果表明原核微生物群落结构与盐度呈正相关,且盐度对菌群的影响最大。综上所述,添加4%食盐的香肠具有更高的乳酸菌丰度。本研究有助于了解加盐对香肠发酵微生态的影响,为香肠的质量控制提供科学依据。

