益生菌发酵饲料对仔猪生长性能、血清免疫指标及肠道菌群的影响
吴 东,计 徐,周 芬,杨家军,吴义景,夏伦志,朱洪龙,陈丽园,于 政,汪兴生,谢继奎
(1.安徽省农业科学院畜牧兽医研究所,畜禽产品安全工程安徽省重点实验室,安徽 合肥 230031;2.申亚生物科技股份有限公司,安徽 阜阳 236065)
益生菌发酵饲料是饲料原料接种益生菌菌种进行发酵后获得包含饲料原料、菌体及其代谢产物的混合物。发酵饲料不仅提高了饲料的营养质量和利用率,还为动物提供了益生元、健康的微生物及代谢产物,发挥了促进生长的作用[1]。Yuan等(2017)[2]研究发现,发酵豆粕对哺乳仔猪的营养物质消化率和粪便微生物群有积极作用。Zhu等(2018)[3]发现断奶仔猪饲喂发酵豆粕可改善肠道菌群,进而提升动物机体的整体免疫水平和健康状态。蓝海恩等(2020)[4]研究表明,复合益生菌发酵饲料可显著改善断奶仔猪的生长性能、肠道微生物菌群、血清生化指标、血清免疫指标。益生菌发酵饲料具有丰富的脂肪酶、蛋白酶,同时能产生其特有的发酵酸香味以改善动物对饲料的适口性,增加采食量,并提高饲料的消化率和增加动物对饲料的消化能力,进而提高动物的生长性能[5-6]。本试验研究益生菌发酵饲料对仔猪生长性能、血清免疫指标及肠道菌群的影响,为选择适宜的饲用抗生素替代饲料提供试验依据。
1 材料与方法
1.1 材料
益生菌发酵饲料:安徽省重点研究和开发计划项目“生猪无抗生素生态养殖技术集成与示范”项目组研制。
1.2 试验动物与分组
试验于2020年7—8月在安徽省阜阳市某猪场进行。选择体重15 kg左右、日龄相近的健康杜长大三元杂种仔猪80头(公母比1∶1),随机分为抗生素组和益生菌发酵饲料组,每组设4个重复,每个重复10头,公母各半,单圈饲养。预试期6 d,正试期33 d。抗生素组在基础饲粮中添加15%金霉素500 g/t、20%土霉素钙预混1 000 g/t,益生菌发酵饲料组是90%基础饲粮+10%益生菌发酵饲料。
1.3 试验饲粮及饲养管理
试验基础饲粮组成及营养水平见表1。试验期间所有猪自由采食和饮水,每天清扫圈舍,以保持圈内清洁,采取自由通风,所有圈舍定期消毒,免疫消毒程序按照猪场常规方法进行。

注:仔猪预混料可为每千克饲料提供维生素A 9 800 IU,维生素D3 2 500 IU,维生素E 35.0 IU,维生素K3 3.0 IU,烟酸60 mg,泛酸30.0 mg,吡哆醇 3.5 mg,核黄素4.5 mg,生物素0.08 mg,叶酸1.0 mg,硫胺素3.0 mg,钴胺素0.05 mg,铜25 mg,铁100 mg,锰40 mg,锌80 mg,硒0.35 mg,碘0.6 mg。
1.4 测定指标及方法
1.4.1 生长性能指标测定 试验开始和结束时,试验猪禁食(自由饮水)12 h后称重,以重复为单位记录始重和末重,统计耗料量,并计算各组的日增重、日采食量和料重比。
1.4.2 血清生化指标和总抗氧化能力测定 试验结束时,禁食12 h,每个重复随机选取1头猪进行颈下静脉采血,每头采血10 mL,3 000 r/min离心15 min,于-20 ℃保存,待测;测定血糖(GLU)、总蛋白(TP)、尿素氮(UREA)含量,谷丙转氨酶(ALT)、谷草转氨酶(AST)活性,血清中总抗氧化能力(T-AOC)。采用南京建成公司试剂盒在酶标仪上进行分析检测。
1.4.3 血清免疫指标测定 试验结束时,禁食12 h,每个重复随机选取1头猪进行颈下静脉采血,每头采血10 mL,3 000 r/min离心15 min,于-20 ℃保存,待测。测定血清中免疫球蛋白IgA、IgG和IgM含量。采用南京建成公司试剂盒在紫外可见分光光度计上进行分析检测。
1.4.4 肠道菌群的测定 盲肠粪便采集与处理:每个重复选取1头猪,早晨饲喂1 h后,现场及时采集直肠粪便,直接在肛门采集(用已灭菌的棉签伸入肛门取样,无菌采集直肠末端新鲜粪球2~5 g灭菌离心管封装,置于冰盒,直到完成整个采样过程,整个过程保证在1 h以内完成。低温条件下带回实验室检测。无菌操作台中取盲肠粪便0.5 g于10 mL的灭菌离心管中,加入无菌生理盐水4.5 mL,用漩涡混合仪混匀后进行10-5~10-9倍比稀释,每个稀释度3个重复,乳酸菌和大肠杆菌分别在MRS琼脂培养基和麦康凯琼脂培养基上培养。细菌计数采用平板计数法进行统计,最终以每克肠道内容物中细菌个数的对数lg(CFU/g)表示。
1.5 数据分析处理
试验数据均采用t检验统计分析。
2 结果与分析
2.1 益生菌发酵饲料对仔猪生长性能的影响
由表2可知,抗生素组和益生菌发酵饲料组仔猪始重差异不显著(P>0.05);与抗生素组相比,益生菌发酵饲料组末重提高8.98%(P<0.01),平均日增重提高18.20%(P<0.01),平均日采食量提高0.88%(P>0.05),料重比下降14.89%(P<0.01)。

表2 益生菌发酵饲料对仔猪生长性能的影响
2.2 益生菌发酵饲料对仔猪血清生化指标和总抗氧化能力的影响
由表3可知,与抗生素组相比,益生菌发酵饲料组中总抗氧化能力提高141.44%(P<0.01);血糖下降10.47%(P>0.05),总蛋白提高6.38%(P>0.05),尿素氮提高2.23%(P>0.05),谷草转氨酶下降27.08%(P>0.05),谷丙转氨酶下降37.34%(P<0.05)。

表3 益生菌发酵饲料对仔猪血清生化指标和总抗氧化能力的影响
2.3 益生菌发酵饲料对仔猪血清免疫指标的影响
由表4可知,与抗生素组相比,益生菌发酵饲料组中IgA提高118.28%(P<0.01),IgG下降35.60%(P>0.05),免疫球蛋白M(IgM)提高37.31%(P>0.05)。

表4 益生菌发酵饲料对仔猪血清免疫指标的影响
2.4 益生菌发酵饲料对仔猪肠道菌群的影响
由表5可知,与抗生素组相比,益生菌发酵饲料组中乳酸菌含量提高5.13%(P>0.05),大肠杆菌含量下降15.48%(P<0.05)。
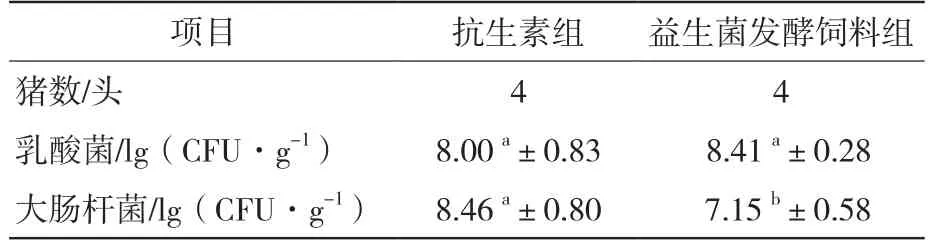
表5 益生菌发酵饲料对仔猪肠道菌群的影响
3 讨论
3.1 益生菌发酵饲料对仔猪生长性能的影响
蓝海恩等(2020)[4]研究表明,复合益生菌发酵饲料组与对照组相比较,日均采食量提高0.66%(P<0.05),日均增重提高1.19%(P<0.05),说明复合益生菌发酵饲料可显著改善断奶仔猪的生长性能。李志云等(2014)[7]用发酵配合饲料饲喂仔猪,同比用常规饲料饲喂,仔猪平均日增重增加18.06%。李泳宁等(2015)[8]研究了微生物发酵饲料对断奶仔猪生长性能的影响,发现分别添加0.5%、1.0%微生物发酵饲料的试验组日增重分别比对照组显著提高13.32%、15.69%;1.0%微生物发酵饲料的料重比最低,比对照组显著降低了12.89%。胡新旭等(2013)[9]发现断奶仔猪20%无抗发酵饲料组平均日增重提高了6.37%,料重比降低了5.54%。本试验结果与上述报道基本一致,益生菌发酵饲料组平均日增重极显著提高,料重比极显著下降。
3.2 益生菌发酵饲料对仔猪血清生化指标和总抗氧化能力的影响
蓝海恩等(2020)[4]研究表明,复合益生菌发酵饲料组与对照组相比较,血清中总蛋白含量和白蛋白含量分别提高7.44%(P<0.05)和7.61%(P<0.05),血清中碱性磷酸酶含量降低5.75%(P<0.05)。说明复合益生菌发酵饲料可显著改善断奶仔猪的血清生化指标。本试验中与抗生素组相比,益生菌发酵饲料组中总抗氧化能力提高141.44%(P<0.01),谷丙转氨酶下降37.34%(P<0.05);血糖、总蛋白、尿素氮、谷草转氨酶两组差异都不显著(P>0.05);本试验中益生菌发酵饲料组中总抗氧化能力和谷丙转氨酶指标极显著改善,益生菌发酵饲料导致仔猪总抗氧化能力提升少见相关报道,谷丙转氨酶参与氨基酸的转氨基作用,谷丙转氨酶主要存在于肝细胞浆内,当肝细胞膜损伤时谷丙转氨酶释放到血液中(李忠荣等,2013)[10];但总蛋白等指标差异都不显著,与上述报道不太一致,这其中的机理还需进一步研究。
3.3 益生菌发酵饲料对仔猪血清免疫指标的影响
蓝海恩等(2020)[4]研究表明,复合益生菌发酵饲料组与对照组相比较,血清中IgG、IgA、IgM含量分别提高18.90%(P<0.05)、9.89%(P<0.05)、1.19%(P>0.05),说明复合益生菌发酵饲料可显著改善断奶仔猪的血清免疫指标。Jiang等[11]对早期断奶仔猪膳食补充活酵母(LY)或超细粉体酵母(SFY),可提高饲料转化率,增加仔猪十二指肠和仔猪空肠绒毛高度,提高了断奶猪的免疫力。本试验中益生菌发酵饲料组中IgA极显著提高,改善了仔猪血清免疫指标,与上述报道的结果一致。
3.4 益生菌发酵饲料对仔猪肠道菌群的影响
蓝海恩等(2020)[4]研究表明,复合益生菌发酵饲料组与对照组相比较,盲肠、结肠、直肠中的大肠杆菌数分别降低2.39%(P<0.05)、2.01%(P<0.05)、1.64%(P<0.05),盲肠、结肠、直肠中的双歧杆菌数分别提高1.20%(P<0.05)、1.34%(P<0.05)、1.20%(P<0.05),盲肠、结肠、直肠中的乳酸杆菌数分别提高2.14%(P<0.05)、1.66%(P<0.05)、2.05%(P<0.05),说明复合益生菌发酵饲料可显著改善断奶仔猪的肠道微生物菌群。Yuan等(2017)[2]研究发现,发酵豆粕对哺乳仔猪的粪便微生物群有积极作用。本试验中益生菌发酵饲料组中大肠杆菌含量显著下降,乳酸菌含量有一定程度的提高,这与上述报道的结果一致。
4 结论
综上所述,在仔猪饲粮中添加益生菌发酵饲料替代抗生素,猪的生长性能、总抗氧化能力及免疫指标显著提高,肠道菌群结构显著改善。

