蓝色荧光碳量子点的制备应用于石菖蒲中有效成分细辛醚的检测*
杨春艳 达瓦 靳贵林 益西拉姆 罗珍 冯明科
(西藏藏医药大学,西藏 拉萨 850000)
石菖蒲(拉丁学名:Acorus tatarinowii),属天南星科、菖蒲属禾草状多年生草本植物,其根茎具气味。叶全缘,排成二列,肉穗花序(佛焰花序),花梗绿色,佛焰苞叶状。根茎常作药用。
当前对于石菖蒲的研究注重于其煎煮液和挥发油的药理研究,并取得了相应的成果。研究报道石菖蒲的煎煮液和挥发油提取物具有良好的药理活性,具体体现在:(1)作用于中枢神经系统:临床上表现为镇静、抗惊厥、降温及治疗癫痫的作用。(2)作用于心血管系统:临床常用于冠心病、肺心病等属于痰浊气滞之胸痹者的治疗。(3)作用于消化系统:石菖蒲煎剂内服能促进消化液的分泌及制止胃肠异常发酵,并有缓解肠管平滑肌痉挛的作用[2-4]。
但是对于其含量测定与成分检测的研究相对较少,目前对于石菖蒲挥发油的分析检测方法,主要采取GC-MS 分析手段进行组分研究和检测,其缺点在于设备仪器复杂、操作繁琐、成本高等特点,对于石菖蒲这种药材的后续研究带来不便。因此所开展的研究重点在于建立一系列特异性的荧光探针对其中不同组分进行特异性识别,具体而言就是建立快速、灵敏、准确的分析检测方法,对石菖蒲中有效成分细辛醚进行含量测定。这对于建立石菖蒲的持续研究开展提供了基本条件,进一步可以促进藏药研究方法的标准化与国际化。
1 材料和方法
1.1 所用试剂及仪器
尿素、二甲双胍、对苯并醌、磷酸二氢钠(NaH2PO4)、苯胺、苯甲酸、间苯二酚、异烟肼、葡萄糖、烟酸、半胱氨酸(Cys)、谷胱甘肽(GSH)、对硝基苯酚、氢氧化钠(NaOH)、盐酸(HCl)金属离子(Mg2+,K+、Ca2+,Sr2+,Fe3+,Na+,Ni2+)、甲醇(MEOH)、乙醇(ETOH)、正丙醇、丙酮(DMK)、二甲亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、乙腈(ACN)、四氢呋喃(THF)和氯化钠来自Dingguo 昌盛生物技术有限公司有限公司(中国,北京)。超纯水,整个实验过程采用Aquapro超纯水系统(中国成都)。
所有的荧光光谱分析都是通过日立F-7000 荧光分光光度计(日本东京)进行测定,激发和发射狭缝为5/5nm,检测池为1cm×1cm。紫外/可见吸收光谱由紫外-2450 分光光度计测定(日本东京),采用ES‐CALAB 250 的X 射线光电子能谱仪完成元素分析(日本东京),傅里叶变换红外能谱仪对官能团进行探索(日本东京)。Zetasizer 纳米动态光散射(DLS)仪器(Malvern,England)测定碳量子点的尺寸分布。恒温水浴(DF-101s)购自巩义仪器有限公司(中国巩义),pHS-3C数字pH计用于测定溶液的pH值(中国上海),绝对PL 量子产率光谱仪C11347(日本Hamamatsu)用于测定量子产率,碳量子点的粉末通过PiloFD8-4.3V(美国Charlotte)中进行冻干后获得。
1.2 碳量子点的合成
0.5g 尿素和1.0 g 二甲双胍溶解在6 mL 的水中,将混合溶液依次转移到25mL 内衬聚四氟乙烯的不锈钢高压釜,随后在180℃下反应6 h。冷却至室温后将粗产物溶解于10mL 超纯水中。将之前的溶液以3000 rpm 离心3min,将上清液用0.22mm 滤膜过滤以此除去较大的产物。再通过100MWCO的透析膜透析12h,最后通过冻干得到灰色的CDs粉末[5-7]。
1.3 样品检测
将两个平行的200 µL 的CDs (1 mg/ mL)和800µL 的DMF 依次加入1.5 mL 的样品管中。然后将200µL 的待测品(10-4 M)加入到之前的溶液中并进行充分涡旋反应。然后将上述混合物分别孵育5分钟后进行荧光测定。
2 结果与讨论
2.1 CDs的表征
首先对所制备的CDs 进行表征,CDs 在400nm 激发时表现出最大发射波长465 nm 的蓝色荧光(图2A)。可以观察到CDs 在365 nm 的紫外下发出蓝色荧光(Fig 1 a,b)。通过测得CDs 的荧光寿命计算是7.42 ns(图1 B),以及最终的绝对测量量子产率是34.52%.同时CDs 的荧光强度随激发在280 nm 到325 nm 范围内降低,阐明了CDs 的荧光发射依赖于激发(图S1)。同时在280 nm 处测量CDs 的紫外-可见吸收光谱(图S2),说明C=O 键存在n-π*电子跃迁。此外通过HRTEM 图像显示所制备的CDs 类似于球形,通过DLS 可以测得直径主要位于4nm~9 nm 范围内,阐述了所合成的CDs 是均匀的且具备良好分散性。随后通过FTIR 和XPS对CDs的组成和主要官能团进行了表征。其中FTIR 光谱在3352 cm-1处出现了O-H 的伸缩振动,在1675cm-1处出现了C=O 的伸缩振动。同样,1450cm-1处的峰与C-H 的弯曲振动有关,也与C-O 在1086 cm-1处的峰有关(图1D)。此外,在XPS 表征结果中还观察到C1s,O1s和N1s三种元素。碳和氧的含量分别为21.96%、58.75%和10.29%,阐明了制备的CDs主要由C,O,N 组成(图2A)。C1s 谱的分峰表明存在C-C (284.78 eV)、C-O (286.38 eV)、O-C=O (288.67 eV)和C=O(288.90 eV)四种类型的碳键(图3C)。同样,O1s光谱显示了O=C-O 在529.89 eV,C=O 在531.22 eV,C-O 在533.42 eV(图3D)。XPS 结果表明,制备的CDs主要具有-COOH,-OH,-C=O 的官能团,这与FTIR结果一致[8-9]。
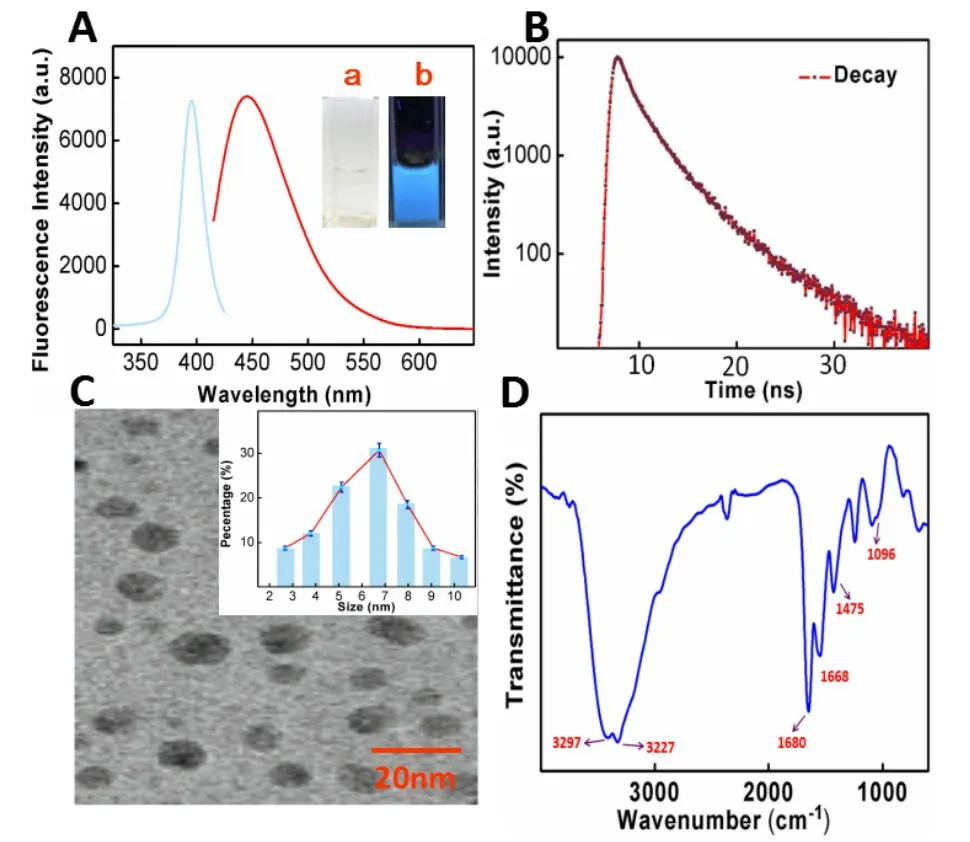
图1 (A)CDs的激发以发射以及在(a)日光及(b)365 nm紫外光下的图谱;(B)CDs的荧光量子产率;(C)CDs的H-TEM成像及粒径分布直方图;(D)CDs的红外吸收光谱
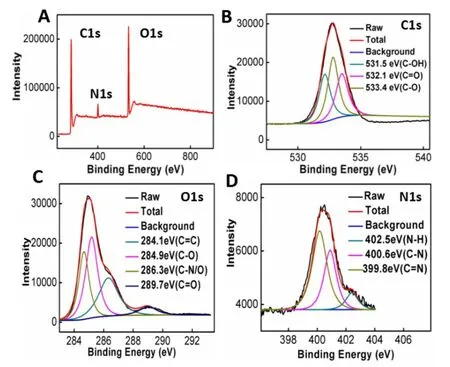
图2 (A)CDs的XPS元素总谱;(B)C1s;(C)O1s;(D)N1s 不同元素的XPS分峰
2.2 合成条件优化
通过实验对CDs的合成进行了优化,如图3所示,CDs的荧光强度随柠檬酸(图3A)以及二甲双胍的量相关(图3B),并且随着反应时间(图3C)和以及反应温度(图3D)的变化而变化,说明CDs 的合成受到这些条件的调控。因此,0.5 g 尿素和1.0 g 二甲双胍,6h 以及180℃为制备CDs的最佳条件。
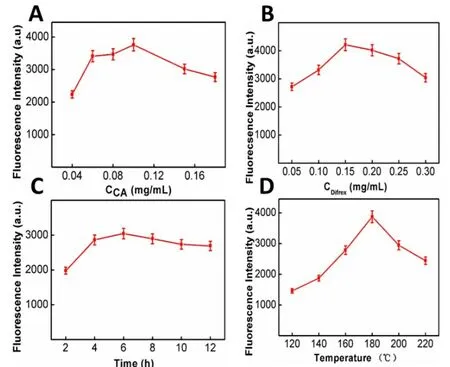
图3 (A)柠檬酸及(B)二甲双胍合成用量的优化;(C)合成时间以及(D)合成温度的优化
2.3 建立分析策略
由于所制备的碳量子点的表面富含氨基羧基羟基以及环氧基等负电性基团,因此基于此本研究探究CDs 是否能与潜在靶标相互作用。同时,细辛醚的结构中多个基团以及氧原子,因此该分子可能存在较大的电负性,二者可能存在相互作用并导致碳量子点的荧光信号发生改变。因此将细辛醚(4×10-3~4.82×10-7M)浓度梯度加入1 mg/mL 的CDs 中进行荧光光谱扫描,可以明显看出,随着待测样品浓度的提升而荧光强度开始下降,4×10-4M的细辛醚的加入使得荧光强度猝灭仅为原强度的10%。基于此建立起通过碳量子点检测细辛醚的方法,通过测定得到线性范围为为8×10-7~4×10-4M(R2=0.988),检测限为20.68 nM,信噪比为3。验证了该方法具有较宽的线性响应范围和较低的检测限,较之其他分析方法,通过荧光碳量子点分析细辛醚含量的方法具有较好的线性[10-13]。
2.4 检测机理
本研究对检测机制进行了详细的探索。对于碳量子点荧光猝灭,先前文献报道主要是由于量子尺寸效应导致,因此通过探究细辛醚的引入是否导致粒径的变化来论证。将4×10-3M 的细辛醚加入1mg/L 的CDs溶液中并充分搅拌混合,随后通过H-TEM 和DLS对其粒径进行表征,通过表征引入待测物后粒径平均分布在400nm~560 nm 之间,因此可以推断由于细辛醚的加入碳量子点发生聚合,从而导致水合粒径的增加,可以推断量子效应导致荧光发生猝灭。随后通过对加入待测物前后引起的电势的变化,可以看出待测物的加入使得溶液电负性从2.3 mV 降至-2.4 mV,即引入细辛醚后发生了电势的变化,因此可以推断由于二者存在电势差,所制备的CDs 与待测物之间通过电子之间的相互作用力发生聚集,进而导致监测体系的荧光发生猝灭,从而实现了通过CDs对细辛醚进行分析检测。
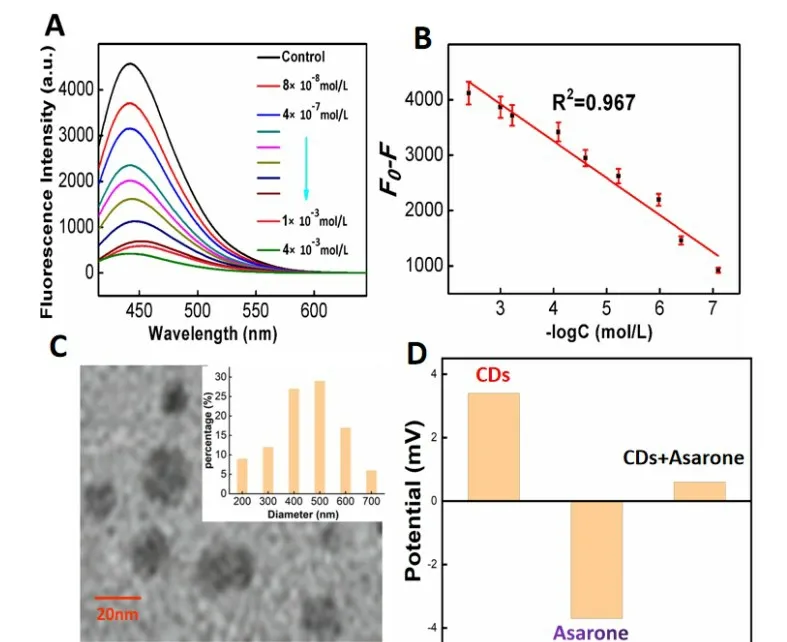
图4 (A)加入不同浓度的细辛醚后扫描得到的CDs的荧光光谱;(B)F-F0引入不同浓度细辛醚的对数浓度;(C)加入细辛醚后测得的H-TEM及DLS分布;(D)加入细辛醚后测得的电势变化
3 结论
本研究通过水热法制备得到一种高荧光量子产率的蓝色荧光碳量子点,并对其进行了详细的表征,通过表征验证了碳量子点表面富含氨基,羟基羧基等官能团,这些官能团为碳量子点作为荧光探针提供了可能性。通过对碳量子点选择性考察,发现细辛醚对所制备的碳量子点的荧光具有很好的猝灭作用。基于此建立了以CDs 为荧光探针来分析细辛醚的策略,检测限可以达到20.68nM,突出了对细辛醚的优异检测能力,实现了对目标物优异的检测能力。

