子宫内膜异位症患者异位病灶组织FoxM、CDK表达观察
李佩,穆丹,陈利平
监利市人民医院妇产科,湖北监利433300
子宫内膜异位症(EMs)指子宫内膜组织在子宫体之外部位生长,是妇科常见良性疾病,在育龄期女性中发病率为10%~15%,且呈逐年上升趋势[1-2],可引发月经紊乱、痛经、盆腔痛、难治性不孕等,严重影响患者身心健康及生活质量[3]。既往研究显示,EMs虽然属于良性病变,但具备局部种植、浸润性生长、远处转移等类似恶性肿瘤的特点,其发病与遗传、内分泌、免疫、炎症等因素有关,但其确切发病机制尚不明确[4-5],探讨其发生机制是当前研究热点课题。叉头框转录因子M1(FoxM1)在细胞增殖、迁移及血管生成等过程中发挥关键调控作用;细胞周期蛋白依赖性激酶6(CDK6)是关键细胞周期相关蛋白,可诱导细胞增殖过程;两者均与恶性肿瘤细胞增殖过程关系密切[6-8],而EMs发生机制与恶性肿瘤存在相似之处,推测FoxM1、CDK6可能参与EMs的病理过程,既往研究中鲜有FoxM1、CDK6与EMs关系的探讨。我们观察了EMs患者异位病灶组织FoxM1、CDK6表达的变化,分析了EMs异位病灶组织中FoxM1、CDK6表达之间的关系及与患者病理分期、临床分型的关系。
1 资料与方法
1.1 临床资料选取2019年2月—2021年1月在监利市人民医院妇产科就诊的EMs患者105例(观察组),年龄23~46(32.78±6.19)岁,体质量指数(BMI)为(23.27±2.56)kg/m2,月经周期(30.18±3.19)d,月经持续时间(5.51±0.95)d。纳入标准:术后病理学结果证实为EMs;6个月内无激素类药物使用史;月经规律;临床资料完整。排除标准:合并内分泌疾病、免疫性疾病、其他严重器质性病变、恶性肿瘤者;妊娠及哺乳期女性。依据《子宫内膜异位症的诊治指南》中的分期标准[9]可分为:Ⅰ期11例,Ⅱ期27例,Ⅲ期58例,Ⅳ期9例;依据EMs病理分型可分为:卵巢型86例,深部浸润型19例。另外选取同期行子宫切除手术的105例子宫肌瘤患者为对照组,年龄23~46(33.73±6.52)岁,BMI(23.41±2.51)kg/m2,月经周期(30.26±3.24)d,月经持续时间(5.32±1.07)d。两组基线资料比较差异无统计学意义(P均>0.05)。本研究经医院伦理委员会批准(LD2018-113),研究对象均签署知情同意书。
1.2 组织中FoxM1、CDK6检测术中分别收集观察组异位病灶组织及对照组健康子宫内膜组织,用生理盐水冲洗,纱布蘸干,10%甲醛固定,常规脱水,石蜡包埋,4 μm连续切片,然后采用免疫组织化学染色法检测组织中FoxM1、CDK6。由经验丰富的两名病理科医师采用双盲法对染色结果进行独立评价。随机在每张切片上选取6个视野,每个视野计数100个细胞,以出现棕黄色或深棕色颗粒判定为阳性细胞,FoxM1定位于细胞质及细胞核,CDK6定位于细胞质及细胞膜,根据阳性细胞比例以及染色程度进行评分。阳性细胞比例评分:5%以下判为0分,5%~25%判为1分,26%~50%判为2分,51%~75%判为3分,75%以上判为4分;阳性细胞染色程度评分:未着色判为0分,棕黄色判为1分,深棕色判为2分。两项评分相乘得到总分,0~3分判为阴性表达,4分及以上判为阳性表达[10]。
1.3 统计学方法采用SPSS25.0统计软件。计量资料以xˉ±s表示,比较采用t检验;计数资料以例或百分率表示,比较采用χ2检验或Fisher's精确检验。采用Spearman分析EMs患者异位病灶组织中FoxM1、CDK6表达相关性。P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组组织中FoxM1、CDK6表达比较观察组FoxM1、CDK6阳性分别为7、11例,对照组分别为34、37例,与对照组相比,观察组异位病灶组织中FoxM1、CDK6阳性表达率高(χ2值分别为22.094、18.256,P均<0.01)。观察组异位病灶组织中FoxM1、CDK6表达见图1、图2。

图1 观察组异位病灶组织中FoxM1表达(免疫组织化学染色,400×)
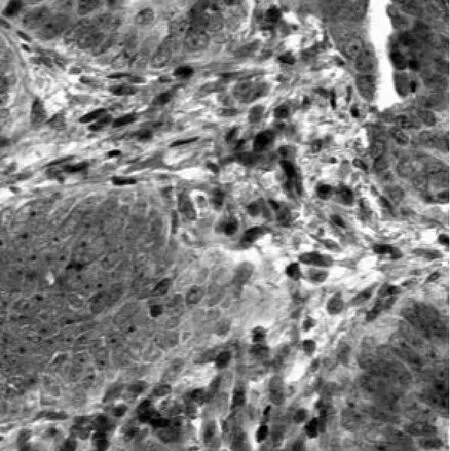
图2 观察组异位病灶组织中CDK6表达(免疫组织化学染色,400×)
2.2 EMs异位病灶组织中FoxM1、CDK6表达与患者临床分期、病理分型的关系Ⅰ、Ⅱ、Ⅲ、Ⅳ期EMs患者异位病灶组织中FoxM1阳性分别为2(18.18%)、6(22.22%)、19(32.76%)、7例(77.78%),CDK6阳 性 分 别 为2(18.18%)、7(25.93%)、21(36.21%)、7例(77.78%),不同分期EMs患者异位病灶组织中FoxM1阳性表达率相比,χ2=9.658,P=0.017;CDK6阳 性 表 达 率 相 比,χ2=8.806,P=0.028。卵巢型、深部浸润型患者异位病灶组织中FoxM1阳性分别为23(26.74%)、11例(57.89%),CDK6阳性分别为24(27.91%)、13例(68.42%),不同分型EMs患者异位病灶组织中FoxM1阳性表达率相比,χ2=6.897,P=0.000;CDK6阳性表达率相比,χ2=11.193,P=0.001。
2.3 EMs患者异位病灶组织中FoxM1、CDK6表达相关性EMs患者异位病灶组织中FoxM1、CDK6表达呈正相关(r=0.512,P=0.000)。
3 讨论
EMs依据异位病灶部位可分为卵巢型、深部浸润型、腹膜型等,其中卵巢最易被侵犯,是EMs最为典型的分型,深部浸润型指病灶浸润深度在5 mm及以上的特殊类型,可累及盆腔[11]。部分EMs患者无典型临床症状,加之目前缺乏有效的特异性生物标志物,故临床诊断需依靠腹腔镜检查,EMs患者手术治疗费用高昂且术后存在复发风险。目前尚无确切有效的根治方法,以上因素导致EMs的诊疗极具临床挑战性,探究EMs的发生机制显得尤为关键[12-13]。
细胞周期包括DNA合成前期的G1期、DNA合成期的S期、DNA合成后期的G2期,有丝分裂期的M期,细胞过度增殖是肿瘤的主要发生原因之一,其分子机制为细胞周期调控失常,异位的子宫内膜能够在宫腔外种植、转移,依赖于细胞增殖能力的增强[14-15]。在衰老及正常终末分化组织中FoxM1呈低表达或不表达,在多种恶性肿瘤中FoxM1呈高表达,参与肿瘤的侵袭、转移,是近年来恶性肿瘤领域的热点研究分子[16-17]。研究发现,FoxM1在细胞有丝分裂过程中发挥重要作用,其异常表达可引起纺锤体缺陷,进而使有丝分裂过程延迟,最终参与宫颈癌细胞增殖过程[18]。CDK6是G1期重要调控因子,可促进细胞周期从G1期向S期转变,其基因定位于人染色体7q21[19]。研究发现,CDK6与子宫内膜相关疾病密切相关;子宫内膜癌病灶组织中CDK6表达较子宫肌瘤病灶组织高,CDK6可通过影响肿瘤细胞增殖过程参与子宫内膜癌的病情演变[20-21]。本研究发现,与对照组相比,观察组异位病灶组织中FoxM1、CDK6阳性表达率较高,且不同分期、分型EMs患者异位病灶组织中FoxM1、CDK6阳性表达率存在差异,提示FoxM1、CDK6参与EMs的发生、发展,随着EMs患者病情加重,FoxM1、CDK6表达升高,分析原因是,高表达的FoxM1可破坏细胞骨架结构完整性,促进子宫内膜细胞发生迁移、浸润,进而增强异位子宫内膜的增殖能力,使得子宫内膜细胞能够在肌层种植及增殖,最终导致EMs的发生[22];CDK6可能通过影响细胞增殖过程参与EMs的发生及演变。新近研究显示,CDK6能够稳定并激活FoxM1,进而维持G1~S期基因的正常表达,使活性氧维持低水平,从而对细胞衰老发挥抑制作用[23]。本研究发现,EMs患者异位病灶组织中FoxM1、CDK6表达呈正相关,提示FoxM1、CDK6可能共同损伤子宫内膜基底层的防御功能,促使子宫内膜细胞侵袭肌层,导致EMs发生,并参与病情的发生发展。
综上所述,FoxM1、CDK6在EMs患者异位病灶组织中阳性表达率较高,两者共同参与EMs的发生及病情演变,且具正相关关系,可能为EMs的临床诊治工作提供一定参考依据。本研究也存在一定局限性,未对FoxM1、CDK6影响EMs患者病情的具体机制进行深入探究,且为小样本研究,可能存在一定结果偏差,有待进一步研究工作的开展。

