特发性肺动脉高压患者外周血单核细胞差异表达基因分析
郭海森,张炜岱,倪楚民,周琳洁,蔡志雄,朱稚丹
汕头市中心医院 中山大学附属汕头医院 心血管内科,广东 汕头 515031
特发性肺动脉高压(IPAH)是由于不明原因引起肺小动脉收缩、增生和重塑导致肺血管阻力增加,平均肺动脉压在静息状态下≥25mmHg,且排除其他病因所致的肺高压[1]。目前IPAH的基因表达特点仍未研究透彻。此外,系统性硬化病所致肺动脉高压(SSc-PAH)在临床上较为常见,但由于病因不同,IPAH和SSc-PAH在治疗和预后等方面存在明显差异,探究两者的基因表达差异,有助于鉴别诊断和个体化治疗[2]。因此,本研究借助基因芯片数据,分别探究IPAH与健康人群、系统性硬化病相关肺动脉高压的基因表达差异,为进一步临床研究提供方向和思路。
1 资料与方法
1.1 资料来源与分组
美国国立生物技术信息中心的GEO数据库(www.ncbi.nlm.nih.gov/geo)收录了大量基因芯片检测信息。本研究基于该数据库中收录的GSE33463数据集进行分析,该数据集为病例对照研究设计,包含140例病例(其中特发性肺动脉高压病例30例,系统性硬化病相关肺动脉高压42例,系统性硬化病相关肺高压伴间质性肺病8例,系统性硬化病不伴有肺动脉高压19例)和41例健康对照,病例基线信息详见原始研究[3]。该数据集分析外周血标本,Ficoll密度梯度法分离外周血单核细胞,提取和纯化RNA,应用Illumina HumanHT-12 V3.0 expression beadchip芯片平台进行基因表达谱分析[3]。根据DNA转录为RNA过程中的转录水平高低,筛选转录水平上调基因和转录水平下调基因,以供进一步分析。
在原始研究的基础上,本研究进一步将特发性肺动脉高压(IPAH)组与系统性硬化病相关肺动脉高压(SSc-PAH)组进行比较分析,探究其基因和信号通路的差异(原始研究和本研究的分组方式,见图1 )。此外,本研究再次对IPAH组与对照组的差异基因进行分析(采用最新基因注释信息、最新GO数据库、最新KEGG数据库和蛋白质相互作用数据库进行分析,以获取比原始研究更全面的结果)。

特发性肺动脉高压(IPAH,n=30)硬皮病伴肺动脉高压(SSc-PAH,n=42)硬皮病伴肺动脉高压伴间质肺炎(SSc-PH-ILD,n=8)硬皮病不伴有肺动脉高压(n=19)对照组(n=41)
1.2 方法
本研究使用R软件对基因数据进行标准化和去批次效应,应用Limma程序包和GEO2R平台对差异表达基因进行筛选。差异基因的判断阈值根据两组样本差异情况而定。对于IPAH病例组与对照组的分析,差异基因筛选条件为校正后P值(Adjusted P)<0.05且差异倍数(FC) >2;对于IPAH组与SSc-PAH组的分析,差异基因筛选条件为P<0.05且差异倍数(FC) >1.5[4, 5]。
为了更好地评估目标基因的生物学效应,应用DAVID平台的GO基因本体和KEGG通路分析工具以及ClusterProfiler程序包对差异基因进行功能和信号通路分析[4, 5]。为筛选枢纽基因(Hub gene),使用STRING平台和Cytoscape 3.7.0软件进行蛋白质相互作用分析,以筛选枢纽基因[6, 7]。
2 结 果
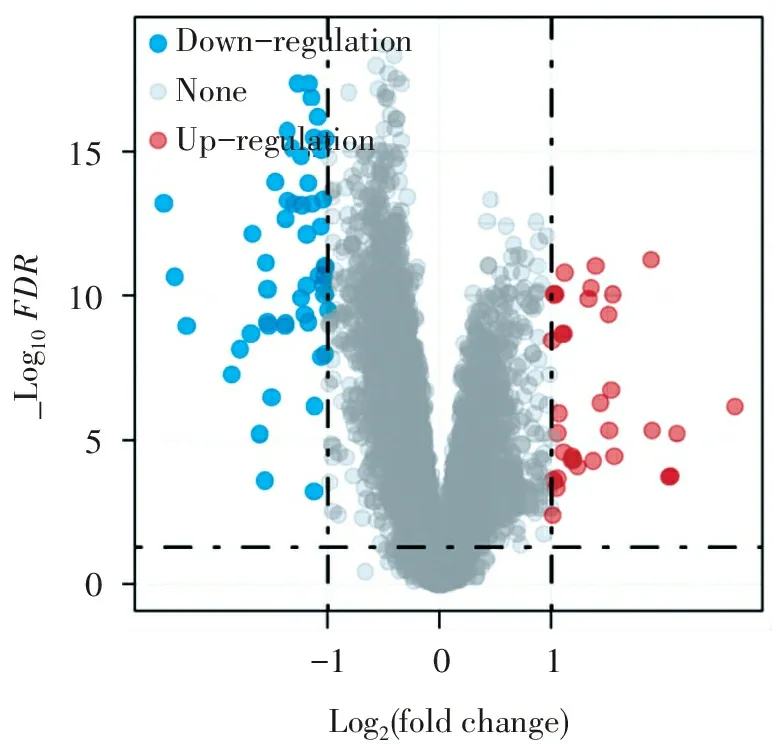
2.1.1IPAH与对照组的差异表达基因筛选及富集分析 特发性肺动脉高压病例(IPAH组)与对照组相比,IPAH组共筛选出33个转录上调基因和51个转录下调基因(详见表1,图2)。上调基因的GO富集分析,在细胞组分方面,主要涉及血红蛋白组成;在分子功能方面,主要涉及活性氧代谢过程、过氧化氢代谢过程、氧运输、气体转运等功能;在生物过程方面,主要涉及氧运输(图3B),上调基因的KEGG分析未发现相关通路(FDR<0.05,即-log10(P)>1.3,详见图3A)。下调基因的GO富集分析,在细胞组分方面,主要涉及转录因子复合体;在分子功能方面,主要涉及DNA结合转录因子活性的调控、细胞因子产生的负调控等;在生物过程方面,主要涉及细胞对生物刺激的反应、转录因子的调控等(图3D);KEGG信号通路分析提示下调基因主要涉及IL-17信号通路、破骨细胞分化、NOD样受体信号通路、Toll样受体信号通路、TNF信号通路等(图3C)。

表1 特发性肺动脉高压病例(IPAH组)与对照组差异表达基因(前10个)
15105001-1Log2(foldchange)_Log10FDRDown-regulationNoneUp-regulation

CBAD
2.1.2IPAH组与对照组的差异表达基因的蛋白相互作用分析 将IPAH组转录上调的33个基因进行蛋白质相互作用分析,发现HBD、NFE2、HBE1、HBG1、EPB42、SELENBP1、AHSP、SNCA、ALAS2、HBG2、HBQ1和HBM共12个基因所编码的蛋白存在广泛的相互作用,考虑为枢纽基因(图4A),将枢纽基因进行富集分析,发现其主要参与血红蛋白复合体组成、氧转运蛋白活性调节、氧输送、氧结合、铁离子结合和凝血等生物学过程。将IPAH组转录下调的51个基因进行蛋白质相互作用分析,发现JUNB、JUN、NFKBIA和FOSB为枢纽基因(图4B),其主要参与转录因子结合、对激素刺激反应、对cAMP反应和对机械刺激反应等生物学过程。

AB
2.2 IPAH与SSc-PAH组的差异基因分析
特发性肺动脉高压组(IPAH组)与系统性硬化病相关肺动脉高压组(SSc-PAH组)相比,IPAH组共筛选出1个转录上调基因(RBPMS2)和18个转录下调基因。从下调基因中筛选枢纽基因并进行富集分析,结果发现OAS2、OAS3、IFI6和IFITM3共4个基因作为枢纽基因参与免疫反应过程。
3 讨 论
基因芯片可以高通量分析目标基因的表达情况,信息量巨大。因此,往往一项研究仅能利用其中的部分数据,仍有大量数据尚未被充分挖掘使用。本论文所采用的数据集首次分析于2012年,现今相关数据分析手段已有明显进步。生物信息学发展速度极快,随着注释文库数据的完善,重注释基因可以得到更多差异表达基因。此外,随着基因相互作用机制的进一步研究,基因富集分析(如GO分析、KEGG分析和蛋白质相互作用分析)数据库也逐渐成熟和全面。因此,本研究使用最新的基因注释信息库、最新的富集分析数据库和蛋白质相关作用数据,将已有研究的基因芯片进行二次分析,以得到更全面和可靠的研究结果[8]。同时,基于不同的研究目的,采用与原始研究不同的分组方式进行分析,可以得到全新临床意义的研究结果,是当前基因研究的热门手段。本研究通过GEO数据库获取特发性肺动脉高压数据集(GSE33463),该数据集已于2012年进行初次分析,但随着基因芯片注释技术和生物信息学技术的发展,可用于该数据集的基因注释信息和基因富集分析信息已进一步完善[3]。因此,本研究应用最新的注释信息和功能富集信息,分析IPAH组和对照组的差异表达基因并进行功能富集和蛋白质相互作用分析。此外,本研究在原始研究的基础上,增加新的比较组(IPAH 组vs. SSc-PAH组),以分析IPAH相较其他病因所致肺动脉高压的基因表达差异,从而为IPAH的诊疗和研究提供更多的信息。
本研究利用当前最新的基因芯片注释文库进行分析,IPAH组与对照组相比,共筛选12个上调的枢纽基因和4个下调的枢纽基因。IPAH上调的枢纽基因,主要参与血红蛋白复合体组成、氧转运蛋白活性调节、氧气输送、氧结合、血红素结合和凝血等生物学过程。其中HBD、HBE1、HBG1、HBG2、HBQ1、HBM 、NFE2基因的表达产物为胚胎、胎儿或成年的血红蛋白或红系组织的组成成分。HBE1为胚胎血红蛋白的重要组成成分[9];HBG1和HBG2所编码的γ珠蛋白通常在胎儿肝脏、脾脏和骨髓中表达[10];EPB42为红细胞膜蛋白带。此外,AHSP编码α血红蛋白稳定蛋白,特异性结合游离的α-珠蛋白并参与血红蛋白的组装[11];ALAS2编码的蛋白质催化血红素生物合成途径的第一步,Chris等人的研究已证实,ALAS2与IPAH疾病严重程度正相关,与肺动脉血氧饱和度和心脏指数呈负相关[3]。综上,在IPAH患者的外周血单核细胞中,红细胞系基因表达明显上调,尤其是不成熟的胚胎和胎儿期的红系基因上调,可能是由于低氧等原因诱发的表达上调。有研究表明,红细胞系基因的表达水平与IPAH的血流动力学指标密切相关,包括平均右心房压、心脏指数、肺血管阻力指数和肺动脉血氧饱和度[3]。在未来研究中可进一步探究上述基因与IPAH的严重程度和预后的相关性,探究其作为生物标志物的价值[3, 12]。
在IPAH的低表达基因中,发现JUNB、JUN、FOSB、NFKBIA为枢纽基因,富集分析发现上述4个基因主要参与转录因子结合、对激素刺激反应、对cAMP反应、对钙离子反应和对机械刺激反应等生物学过程。Diana等研究发现JUN参与肺动脉纤维化过程[13];Rothman等研究发现JUNB参与肺动脉平滑肌细胞的肥大和增生,但其具体机制仍未有研究[13-15]。JUNB、JUN和FOSB基因构成AP-1转录因子的亚基[16]。AP-1转录复合体几乎参与所有细胞的生理过程,并已发现在多种疾病中发挥重要的作用。Sanjiv 等研究发现JUNB、JUN和FOSB组成的AP-1转录因子可能是肺血管内皮细胞一氧化氮合成酶的重要调节因子[17]。一氧化氮(NO)可促进环磷鸟苷酸(cGMP)扩张肺动脉,针对NO-cGMP途径的药物(如西地那非、他达拉非、利奥西瓜等)是目前治疗IPAH的重要靶向药物[1, 18]。在本研究中,IPAH患者JUNB、JUN和FOSB基因表达明显降低,进一步提示IPAH患者的AP-1活性降低可能参与肺动脉高压的病理过程。因此,研究JUNB、JUN和FOSB基因的表达和调控机制,其潜在价值包括鉴别诊断、靶向药物开发和预后评估等。在未来的研究中,体外进一步验证AP-1转录因子与一氧化氮合成酶、细胞一氧化氮水平的关系可能是重点研究方向。
在本数据集的原始研究中,仅横向分析IPAH组、SSc-PAH组、SSc-PH-ILD组与对照组的差异表达基因。系统性硬化(SSc)是一种累及多系统的自身免疫性结缔组织病,主要以皮肤硬化和内脏器官纤维化为特征[19]。肺动脉高压在系统性硬化病患者中的发生率可达5-12%,严重影响SSc患者的生活质量及生存期限[19]。SSc-PAH的发病机制复杂,临床治疗无统一规范[19]。SSc-PAH治疗需使用糖皮质激素及免疫抑制剂,而针对肺动脉高压的靶向治疗的研究较少,尤其是在基因水平分析SSc-PAH与IPAH的不同靶向药物选择的研究极少。因此,本研究在原始研究的基础上,进一步比较IPAH组与SSc-PAH组的差异表达基因,进一步探讨IPAH与其他类型肺动脉高压的基因表达差异,为不同病因肺动脉高压的精准化治疗提供基因水平的依据。
与SSc-PAH组相比,发现RBPMS2基因在IPAH组中表达上调,RBPMS2是RNA结合蛋白,主要参与消化平滑肌细胞的发育和去分化,与肺动脉高压和SSc的关系尚不明确,可作为候选基因进一步探索其在不同类型肺动脉高压中的作用[20]。而在下调基因中OAS2、OAS3、IFI6和IFITM3共4个基因作为枢纽基因,主要参与免疫应答,其中OAS2、OAS3和IFI6已被证实与SSc的发病和进展相关[21]。SSc作为一种自身免疫性疾病,免疫反应和炎症反应在疾病的发生过程中扮演者更重要的角色。对于诊断困难的病例,OAS2、OAS3和IFI6可能有助于IPAH与SSc-PAH的鉴别诊断。与SSc-PAH-ILD组相比,下调基因中S100A12、CSF3R、FPR1、C5AR1和FPR2共5个基因为枢纽基因,主要参与炎症反应、细胞趋化等生物学过程,现有研究提示上述基因与SSc密切相关[22-23]。
本研究主要利用生物信息学手段,在转录组水平探讨IPAH的基因表达情况,为鉴别诊断、靶向药物筛选、预后评估等方便提供信息。通过分析差异表达基因辅助靶向药物的筛选,目前已有成功的案例。例如,研究发现BMPR2基因和BMPR-II信号通路的异常可导致BMP和TGF-β信号失衡,参与肺动脉高压的进展。近期新英格兰杂志发表的论文表明,Sotatercept作为TGF-β的选择性配体陷阱,可重新平衡BMP信号通路而降低肺血管阻力[18]。Sotatercept的成功筛选,提示针对IPAH的差异表达基因的进行干预是可行的。因此,本论文中所筛选的基因亦可作为潜在的靶点,辅助筛选靶向药物。然而,本研究不足在于仅依据基因芯片数据进行分析,缺乏进一步临床样本分析以验证相关结论的可靠性,未来仍需进一步研究和探讨。

