双金属MOF衍生ZnCo多孔碳骨架电化学分析Hg(Ⅱ)的研究
赵吉星,鲍钱鑫,席 赟,陈 星,王连超*
(1.合肥工业大学 工业与装备技术研究院,安徽 合肥 230009;2.合肥工业大学 材料科学与工程学院,安徽 合肥 230009)
汞被世界卫生组织(World Health Organization,WHO)认定为是十大主要公共卫生关注的化学物质之一,因为即使是少量接触,也可能导致严重的健康和环境问题。汞在自然界广泛存在,但也会通过人类活动特别是工业过程释放出来。它会对神经系统、消化系统、免疫系统以及生物体的其他部分产生严重的毒害作用。美国国家环境署(Environmental Protection Agency,EPA)将居民饮用水中的最大汞含量确定为2 μg/L,与WHO所推荐的数值近似。因此,发展一种精准、快速痕量检测水环境中汞含量的手段对人类健康具有深远影响。
目前,许多光谱技术已经发展并应用于重金属离子的检测,包括原子吸收光谱(AAS)、电感耦合等离子体质谱(ICPS)、冷原子荧光光谱(CVAFS)、原子发射光谱(AES)等。这些方法基本具备准确度高、检测限低的优点,但通常需要复杂的前处理程序、昂贵的设备和训练有素的操作人员,因而限制了现场和实时检测。相反,电化学方法以其检测灵活、响应快速、操作简单、便携、成本低等优点,为研究人员提供了一种极具吸引力的替代方法。电化学分析的本质是汞在修饰电极上发生的氧化还原反应,因此,合理设计电极界面是获得优异电分析性能的关键。与传统的玻碳电极相比,化学修饰电极可以改善目标分析物的富集效果,加快电子转移速率,从而提高电分析的灵敏度,拓宽电化学检测的应用范围。
多孔碳因其成本低、化学稳定性好、导电性好以及在气体吸附/储存、电极材料和催化剂载体等领域的潜在应用,引起了人们极大的兴趣。高比表面积和均匀掺杂被认为是碳材料性能的关键。由金属(或金属簇)和羧酸盐(或含氮配体)组成的金属有机骨架材料(MOF)具有巨大的多样性,因此,理论上是一类理想的前驱体。MOF的长程有序性和高孔隙率可以通过简单的热解部分保留下来,从而获得高比表面积和均匀氮原子掺杂的多孔碳。近年来,大量的MOF被转化成形状、表面掺杂和孔隙率都有很大变化的多孔碳。Zheng等报道了一种MOF衍生氮掺碳产物用作阳极材料提高锂电池性能的方法,将ZIF-8在氮气气氛下800 ℃碳化得到了N掺杂的石墨烯类似物(634 m/g),其中N元素的质量分数为17wt%。结果显示该电池在0.1 A/g下循环50次后容量为2 132 mAh/g,在5 A/g下1 000次循环后容量保持在785 mAh/g。这种优异的性能归功于具有丰富N元素的石墨烯类似结构,它可以很好地被石墨层边缘或六角晶格内的位置接枝,特别是对于吡啶氮或吡咯氮。MOF衍生碳在ORR催化领域也有很大的替代贵金属催化剂的潜力。例如,Wen等曾经报道Zn-MOF-74碳化而成的N掺杂介孔碳具有高活性、耐久性和抗CHOH能力,是一种高效的pH通用型ORR催化剂,在碱性、酸性和中性电解液中表现出与Pt/C相当甚至更好的活性。其中,用富氧的锌基MOF作为前驱体是获得介孔尺寸碳的关键。
沸石咪唑骨架材料(ZIF)是MOF的一个亚类,在本研究中被确定为前驱体,因为它们富含碳、氮和过渡金属,并且可以很容易地以低成本制备。此外,双金属纳米颗粒是一类表现出与两种组成金属有相关性质的组合材料,在许多情况下,由于协同效应,它们的特定物理和化学性质有了很大的提高。鉴于此,制备了基于ZIF-8和ZIF-67的双金属ZIF和衍生ZnCo多孔碳骨架。实验结果证明采用该种材料构建的电化学传感器对Hg(Ⅱ)具备良好的分析性能。
1 实验
1.1 主要试剂
2-甲基咪唑(含量> 98.0%)、Zn(NO)·6HO(含量> 99.0%)、Co(NO)·6HO(含量> 98.5%)、无水甲醇(含量> 99.5%)、硫酸(含量>95%),化学试剂均为分析纯,且没有经过后续处理,所有试剂厂家均为国药集团化学试剂有限公司。
1.2 材料合成
(1)ZIF-8的合成:合成步骤参考之前的文献并作修改。先将Zn(NO)·6HO(1.68 g)溶于80 mL甲醇中搅拌,然后在上述溶液中加入3.70 g的2-甲基咪唑和80 mL甲醇的混合物,接着在350 rpm的转速下搅拌24 h,离心分离产物,用甲醇彻底洗涤两次,在50 ℃下干燥过夜,之后ZIF-8粉末在200 ℃真空下活化24 h后使用。
(2)ZIF-67的合成:与ZIF-8制备过程相似,将Co(NO)·6HO(0.45 g)溶解在3 mL去离子水中,然后将5.5 g的2-甲基咪唑(5.5 g)加入20 mL水中,在室温下以300 rpm的转速搅拌6 h。通过离心收集紫色沉淀物,用水和甲醇依次洗涤至少3次,然后在50 ℃的真空中干燥过夜。ZIF-67粉末使用前在200 ℃真空下进一步活化24 h。
(3)Zn/Co-ZIF的合成:与ZIF-8的合成过程类似,通常将Zn(NO)·6HO和Co(NO)·6HO的摩尔比为1∶1的混合物溶解在80 mL甲醇中,(Zn+Co)的总摩尔数为5.65 mmol。将3.70 g的2-甲基咪唑与80 mL甲醇的混合物加入上述溶液中,在室温下以350 rpm的转速搅拌24 h。固体产物经离心分离,甲醇彻底洗涤两次,在50 ℃下干燥过夜,Zn/Co-ZIF粉末在200 ℃真空下活化24 h后使用。
(4)Zn/Co-ZIF-600的合成:将500 mg活化后的Zn/Co-ZIF在氮气气氛(流速为800 mL·min)下加热到600 ℃(升温速率为5 ℃/min)并保持该温度2 h,之后将产物自然冷却至室温。接着用0.5 M HSO水溶液在80 ℃下尽可能地腐蚀产物中不活跃和不稳定的Co纳米粒子两次,然后用大量的去离子水彻底清洗,得到产物命名为Zn/Co-ZIF-600。最后,产品使用前在120 ℃的真空中干燥24 h。
1.3 修饰电极制备
(1)预处理:分别用 1.0 μm、0.3 μm和0.05 μm的AlO浆料在鹿皮上抛光玻碳电极表面,然后将电极依次放入1∶1硝酸溶液、乙醇和去离子水中连续超声处理3 min,以清除电极表面的杂质。将制备的3 mg样品分散在3 mL去离子水中,超声时间设置为30 min,得到均匀的悬浊液。
(2)滴涂法修饰电极:用液枪取5 μL的悬液滴涂到清洁后的玻碳电极表面,在室温下自然干燥。
1.4 材料表征
采用扫描电子显微镜(SEM,GeminiSEM 300)和透射电子显微镜(TEM-EDS,JEM-2100F)研究了材料的表面形貌和元素组成;采用X射线衍射仪(XRD,XPert PRO)对材料的物相组成和晶体结构进行表征;采用X射线光电子能谱仪(XPS,ESC-ALAB25oXi)研究了材料的元素价态和表面电子状态。
1.5 电化学实验
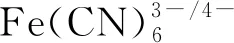
2 结果与讨论
2.1 ZIF及其衍生物的形貌表征
为了验证材料是否合成,采用扫描电镜、透射电镜和能谱(EDS)对材料的形貌和元素组成进行表征如图1所示。由图1可知,合成的ZIF系列(ZIF-8、ZIF-67和Zn/Co-ZIF)均为标准的菱形十二面体,棱角清晰,平均尺寸在1 μm上下,符合先前文献中的报道。混合金属与咪唑配位形成的颗粒形貌与单金属一致,因此,沸石咪唑骨架的金属连接点可能存在两种配位键:Co-Nx和Zn-Nx。

图1 ZIF-8、ZIF-67、Zn/Co-ZIF的扫描电镜图像
采用TEM对Zn/Co-ZIF-600进行了扫描,并用EDS对材料的元素组成和比例进行了初步判断。Zn/Co-ZIF-600的透射电镜图像和X射线能谱分析如图2所示。由图2a可知,经过高温热解,粒径缩小至800 nm左右,并且棱角模糊,接近球状。由图2b~图2e可知,Zn元素和Co元素均匀分布在整个颗粒中,这表明Zn和Co在整个物质中的地位是相同的,没有形成所谓的核壳结构,而是均匀分布占据各个金属连接位。另外,由图2f可知,根据元素含量分布,热解得到的Zn/Co-ZIF-600复合材料中包含C、O、N、Co、Zn等元素,Zn和Co接近1∶1,这与材料合成过程中的金属源比例近乎一致,因此可以推测在实验中Zn和Co在框架中的地位是等同的。

图2 Zn/Co-ZIF-600的透射电镜图像和X射线能谱分析
2.2 ZIF及其衍生物的X射线衍射分析
X射线衍射(XRD)常用来探究纳米材料的物相组成和晶体结构。ZIF-8、ZIF-67、Zn/Co-ZIF和Zn/Co-ZIF-600的X射线衍射图谱(XRD)如图3所示。由图3a可知,合成的前驱体Zn/Co-ZIF与ZIF-8、ZIF-67的衍射峰基本相同,并且与模拟方钠石结构有着很高的吻合度,主要衍射峰对应(011)、(112)和(222)晶面,这表明双金属化合物没有改变沸石咪唑骨架的晶体结构。由图3b可知,焙烧过后的XRD图谱,在2θ=25°附近观察到的衍射峰属于典型的石墨型碳片(002)层间峰。2θ=31.77°、34.42°和36.25°处的3个峰分别对应于ZnO标准衍射图谱(JCPDS NO.36-1451)的(100)、(002)和(101)晶面。此外,在2θ=44.381°(111)、51.601°(200)和75.681°(220)处的3个尖峰归属于金属β-Co(JCPDS NO.15-0806)。
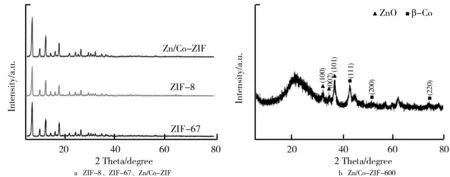
图3 ZIF-8、ZIF-67、Zn/Co-ZIF和Zn/Co-ZIF-600的X射线衍射图谱(XRD)
2.3 Zn/Co-ZIF-600及其衍生物的XPS分析
Zn/Co-ZIF-600的XPS总谱和N1s、Co2p、Zn2p的高分辨率谱如图4所示。X射线光电子能谱(XPS)可以用来表征复合材料的化学组成和元素价态,XPS全谱图(见图4a)清晰地显示C1s(284.78e V)、N1s(398.85 eV)、O1s(531.58 eV)、Co2p(780.68 eV)及Zn2p(1 022.02 eV)峰,表明该材料中包含这5种元素,双金属MOF衍生多孔碳骨架纳米复合材料成功合成。并且从测试数据中可以发现,材料中的元素含量分别为63.4%、10.96%、16.32%、3.94%和5.12%。由图4b可知,高分辨率N1s的XPS谱图中存在着吡啶氮(398.98 eV)、吡咯氮(400.68 eV)和石墨氮(402.18 eV)等3种峰,其中吡啶氮的峰内面积最大,表明在材料中的氮主要以吡啶氮的形式存在。由于砒啶氮易与过渡金属原子形成配位,因此沸石咪唑骨架的金属连接点可能存在两种配位键: Co-Nx和Zn-Nx。由图4c可知,光谱中4个结合能780.83 eV、786.33 eV、797.18 eV、803.08 eV分别对应于Co2p3 Co、Co2p2 Sat、Co2p1和Co2p1 Sat,有趣的是,786.33 eV和803.08 eV的峰是临近峰的震动产生的。由图4d可知,在1 022.18 eV和1 045.18 eV处存在着两个拟合峰Zn2p和Zn2p。两个峰的结合能差值为23 eV,根据ZnO标准参考值可以判断出,锌在材料中以正二价的形式存在。
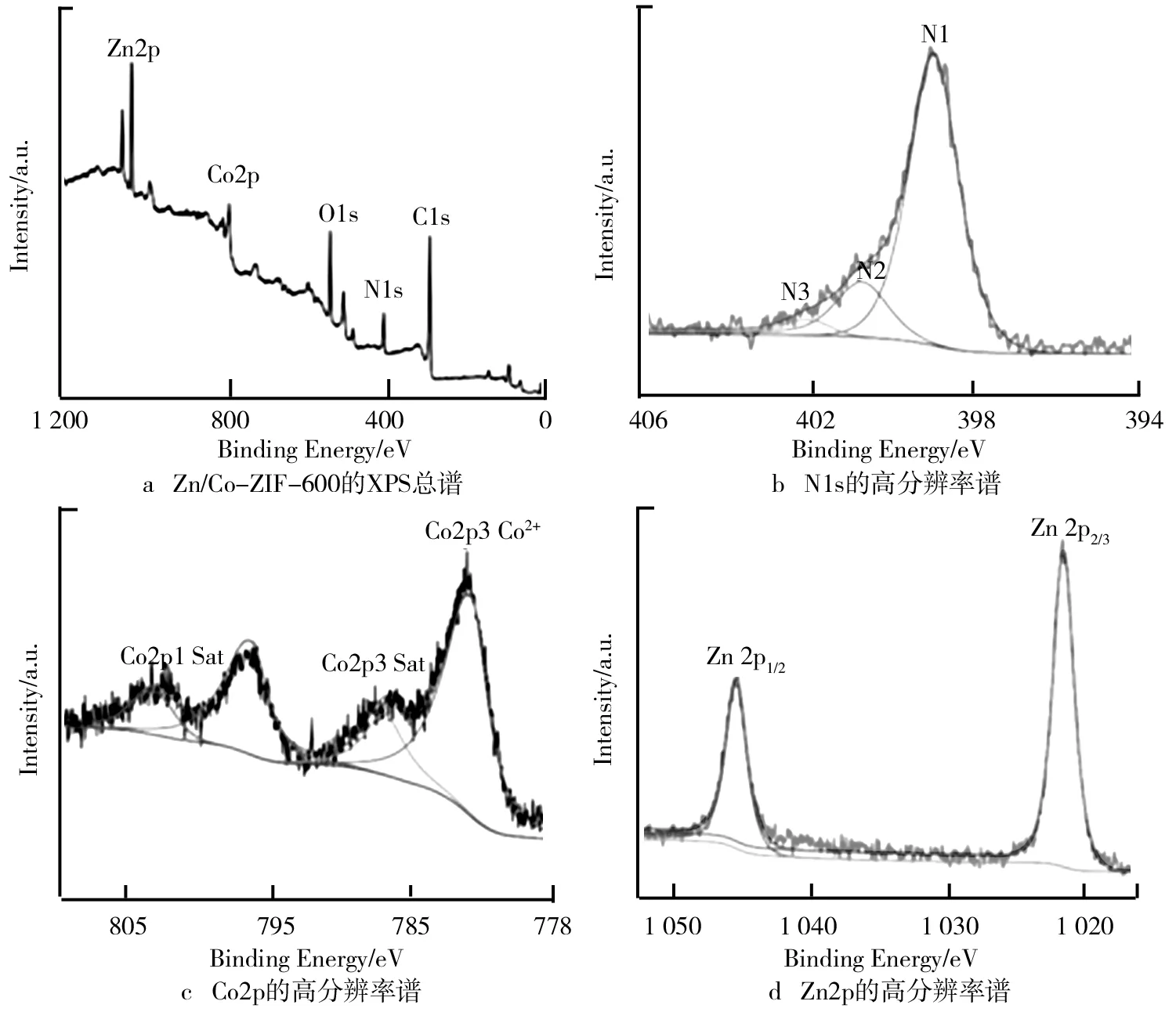
图4 Zn/Co-ZIF-600的XPS总谱和N1s、Co2p、Zn2p的高分辨率谱
2.4 ZIF及其衍生物的电化学性质表征
裸电极、ZIF-8、ZIF-67、Zn/Co-ZIF和Zn/Co-ZIF-600修饰的玻碳电极在含0.1 M KCl的5 mM Fe(CN)溶液中测定CV如图5所示。用循环伏安法(CV)和电化学阻抗谱(EIS)方法均在5 mM Fe(CN)(0.1 M KCl)溶液中进行实验。由图5a可知,裸玻碳、ZIF-8、ZIF-67、Zn/Co-ZIF和Zn/Co-ZIF-600所修饰的GCE的电子转移阻抗谱,都显示为典型的奈奎斯特图,高频下的半圆直径对应于电子转移电阻(Ret),而低频下的线性部分对应于扩散限制过程。模拟等效电路图如图5a的插图所示。其中Rs、CPE、Wo和Ret分别表示溶液电阻、恒相角元、Warburg阻抗和电子转移电阻,拟合后Ret从大到小依次为ZIF-67(458.7 Ω)>ZIF-8(377.4 Ω)>Zn/Co-ZIF(234.4 Ω)> Zn/Co-ZIF-600(113.9 Ω)。双金属ZIF对比单金属ZIF显著地降低了阻抗,这可能归因于双金属颗粒较高的比表面积和层次化的孔隙保证了电解质向催化活性中心的自由扩散以及较短扩散路径长度。在CV模式下循环3次以上,取最后一轮数据进行比较。由图5b可知,观察到与未修饰的玻碳电极相比,所有修饰电极的氧化还原峰所对应的电势差值均有增大的趋势,表明所有修饰材料已成功负载到玻碳电极表面。其中Zn/Co-ZIF-600的峰值电流大于其他材料,表明其较好的导电性。

图5 裸电极、ZIF-8、ZIF-67、Zn/Co-ZIF和Zn/Co-ZIF-600修饰的玻碳电极在含0.1 M KCl的5 mM Fe(CN6)3-/4-溶液中测定CV和EIS
2.5 电化学实验条件优化
为了提升分析效率,对Zn/Co-ZIF-600/GCE分析Hg(Ⅱ)的实验条件进行优化如图6所示。对比了不同的电解质 PBS、NaAc-HAc和NHCl-HCl对0.5 M Hg(Ⅱ)的伏安响应,由图6a可知,在NaAc-HAc溶液中检测效果最好,在Hg的标准溶出电位出现一个清晰锐利的电流峰。因此,醋酸盐缓冲液被证明是适合该电极对Hg(Ⅱ)分析的电解质。设置了pH为3.0、4.0、5.0、6.0的醋酸缓冲液,探索其规律。由图6b可知,溶出电流呈现先增大后减小的趋势,在5.0时达到峰值。因此,在后续的优化实验中,将缓冲溶液的pH设置为5.0。由于沉积电位对溶出信号的影响至关重要,所以在保持上述优化条件下,设置了不同的沉积电位-0.7~-1.2 V。由图6c可知,电流信号随电位的升高而增大,当电位达到-1.0 V时,出现峰值;但当电压超过-1.0 V时,电流信号随之下降。这归因于过大的电压会将溶液中的H转换成H包覆在电极表面,阻碍Hg(Ⅱ)的还原过程;过低的电压则会使溶液中的Hg(Ⅱ)不能充分地还原,降低溶出信号。由图6d可知,沉积时间(50~200 s)对Hg(Ⅱ)溶出信号的影响。峰值电流信号随着沉积时间的增加而保持增加的趋势,当时间超过140 s时,趋势变缓,这归因于改性材料表面活性位点趋于饱和,不能为Hg(Ⅱ)还原提供更多的活性中心,因此,为了在实验时间和实验效率之间取得平衡,选择140 s作为沉积时间。
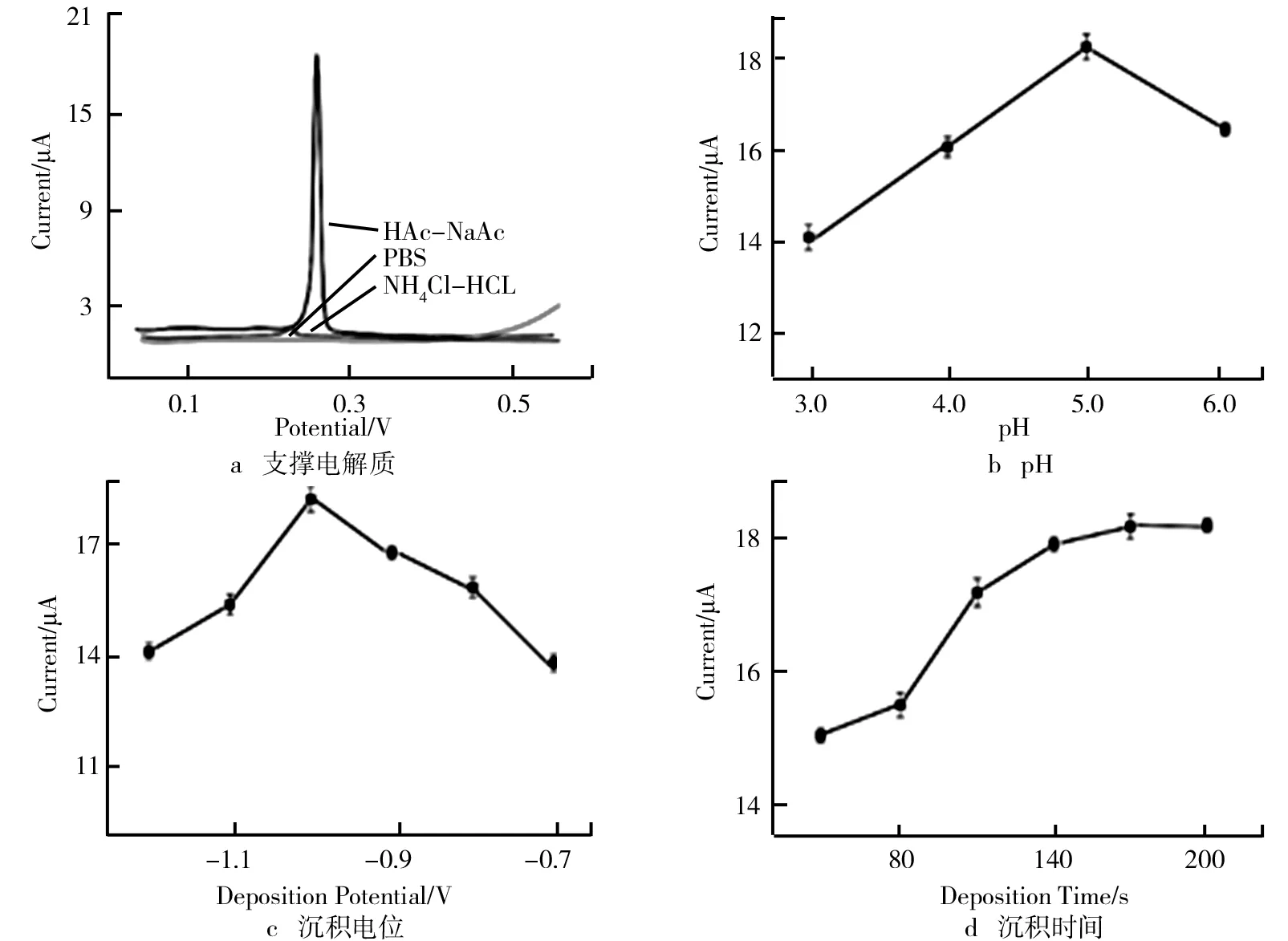
图6 支撑电解质、pH、沉积电位和沉积时间对方波阳极溶出伏安法响应的影响
2.6 修饰电极的溶出伏安响应
在最优实验条件下,4种新型电极(ZIF-67/GCE、ZIF-8/GCE、Zn/Co-ZIF/GCE和Zn/Co-ZIF-600/GCE)被应用于不同浓度的Hg(Ⅱ)分析。SWASV分析结果及拟合曲线如图7所示。由图7可知,4种新型电极传感器均对Hg(Ⅱ)有较好的选择性,随着Hg(Ⅱ)浓度的增加,溶出电位上的溶出峰线性提高。从线性拟合方程可以归纳出4种电极的灵敏度排序依次为Zn/Co-ZIF-600/GCE>Zn/Co-ZIF/GCE>ZIF-8/GCE>ZIF-67/GCE。另外,根据3σ方法计算出电化学电极检测Hg(Ⅱ)的最低检测限(LOD),检测性能数据总结如表1所示。
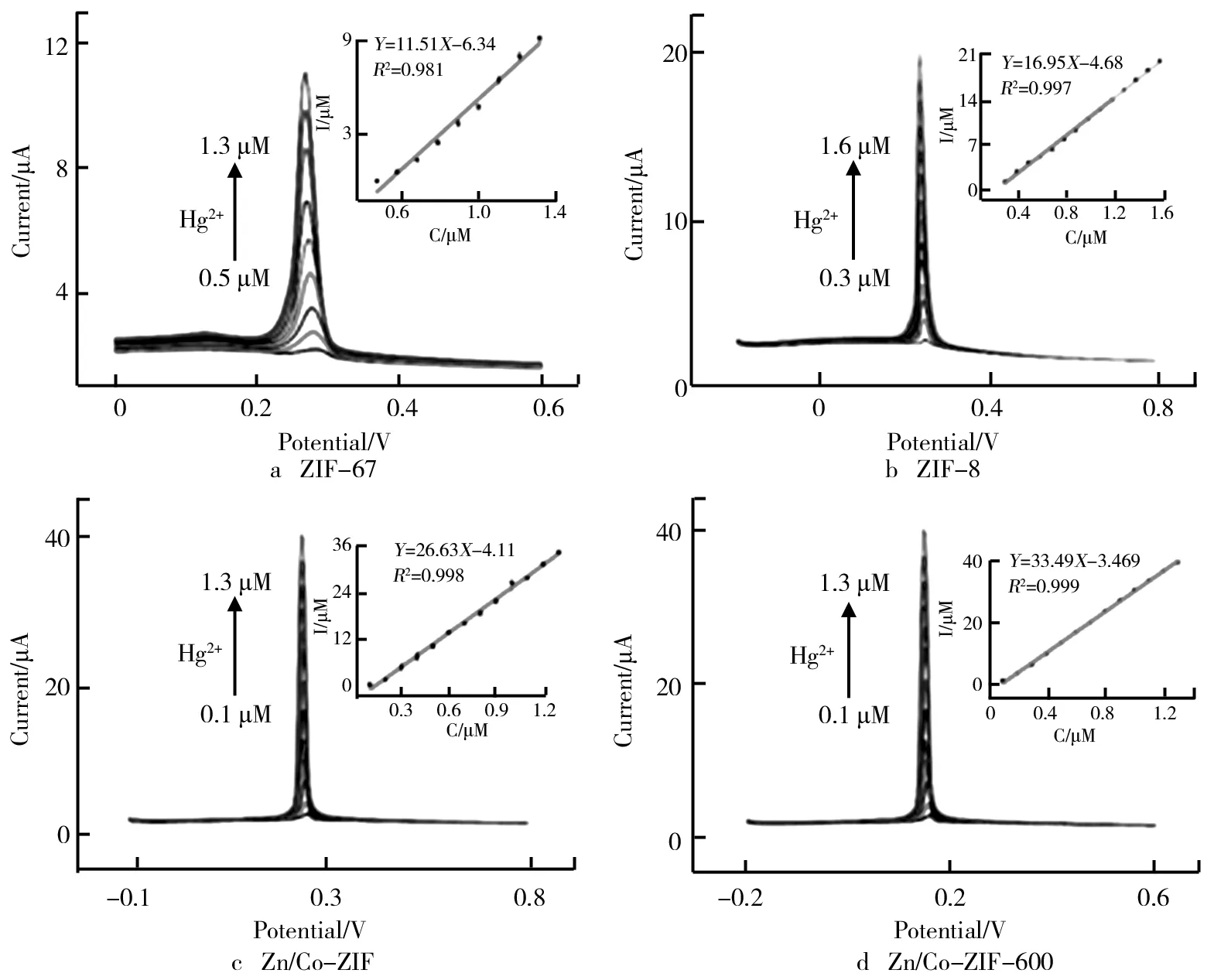
图7 在0.1 M NaAc-HAc缓冲液(pH=5)中,ZIF-67、ZIF-8、Zn/Co-ZIF和 Zn/Co-ZIF-600修饰电极对不同浓度Hg(Ⅱ)的SWASV响应

表1 不同修饰电极电化学检测Hg(Ⅱ)的检测性能数据
综上所述,Zn/Co-ZIF-600/GCE的检测性能要显著好于其他3种电极,这可能归因于以下几点:①Zn/Co-ZIF-600较高的比表面积和层次化的孔隙保证了Hg离子和电解质向催化活性中心的自由扩散,且扩散路径较短;②金属杂原子的均匀分布,特别是N原子的均匀分布是电催化的关键;③Co(Zn)-Nx部分会提供有效的活性中心;④通常在含有过渡金属的催化剂上形成的石墨化氮可以提高导电性。近年来其他电极体系与Zn/Co-ZIF-600修饰电极的对比如表2所示。由表2可见,本电化学电极对重金属Hg(Ⅱ)的分析具有优异的电化学性能。
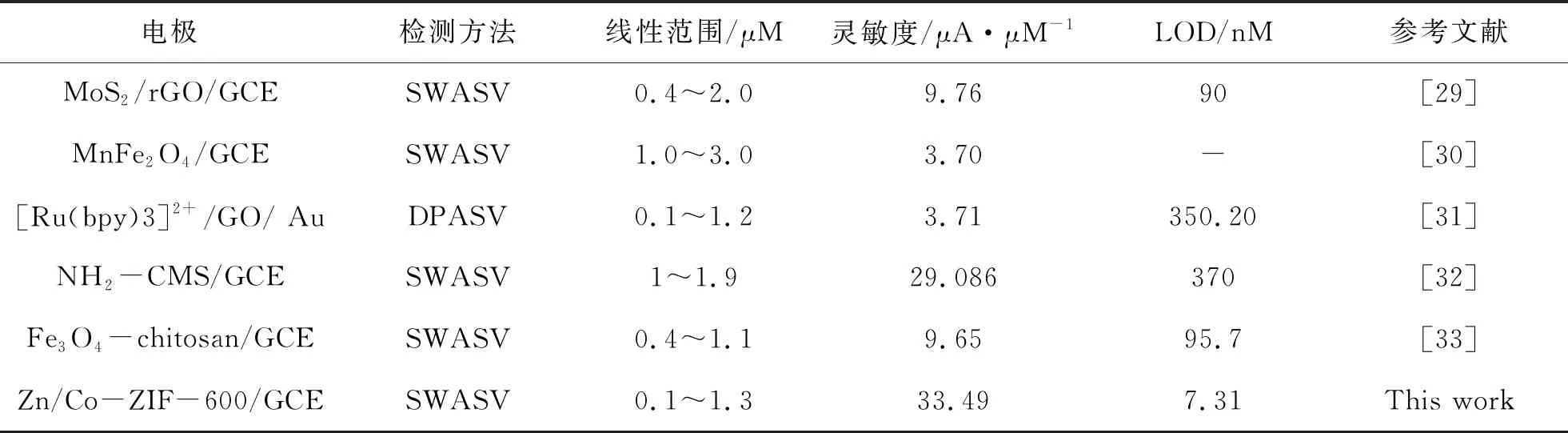
表2 修饰电极对Hg(Ⅱ)的电化学响应性能与其他文献报道的电极体系的对比
2.7 抗干扰能力测试
在分析过程中,电极的抗干扰能力对于实际应用具有重要意义。选取了常见的重金属离子Cd(Ⅱ)、Pb(Ⅲ)、Cu(Ⅱ)、Zn(Ⅱ)和Fe(Ⅱ)对电极的抗干扰能力进行评估。目标Hg(Ⅱ)的浓度设置为0.5 μM,首先单独使用4倍上述干扰重金属离子加入缓冲液,再同时使用8倍上述重金属离子加入缓冲液,最终测得Hg(Ⅱ)的电流峰,结果如图8所示。由图8可知,数据显示被干扰后,Hg(Ⅱ)的电信号与无干扰对比没有明显变化,变化幅度在误差范围之内,因此该电极抗常见干扰离子的能力较好。
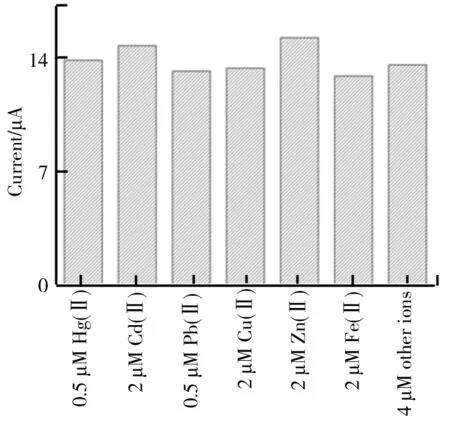
图8 当单独加入4倍Cd(Ⅱ)、Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)、Fe(Ⅱ)和同时加入8倍干扰离子时,Zn/Co-ZIF-600/GCE对0.5μM Hg(Ⅱ)的SWASV溶出分析
2.8 稳定性和重现性
在最优的实验条件下,连续6天用同一电极测定了0.7 μM Hg的溶出电流,考察了新型电极的稳定性。Zn/Co-ZIF-600/GCE对Hg(Ⅱ)检测的稳定性和重现性测试结果如图9所示。由图9可知,溶出电流的变化保持在合理范围内,计算的相对标准偏差(RSD)为1.67%。以上表明Zn/Co-ZIF-600/GCE具有较高的稳定性,可以正常重复使用一周。此外,还评估了新型电极的重现性,并在相同的实验条件下用SWASV测试了5个相同的新型电极(见图9b),计算了5个电极的相对标准偏差为1.81%,表明这种电极具有良好的重现性。

图9 Zn/Co-ZIF-600/GCE对Hg(Ⅱ)检测的稳定性和重现性测试
2.9 模拟实际水样检测
采用新型电化学传感器对合肥工业大学斛兵塘模拟实际水样中的Hg(Ⅱ)含量进行分析。利用乙酸将实际水样的pH标定至5.0。未加入Hg(Ⅱ)时,没有出现Hg(Ⅱ)的电化学剥离响应电流峰,说明该实际水样中不含汞,或者含量极其微少。实际水样中汞的检测分析结果如表3所示。由表3可知,当向溶液中加入一系列标定的Hg(Ⅱ)(0.5~1.0 μM)时,加标水样的回收率在96.7%~105.6%之间,相对标准偏差(RSD)在1.37%~3.57%之间,这表明Zn/Co-ZIF-600纳米材料修饰电极传感器可应用于实际水样中痕量Hg(Ⅱ)的检测。

表3 实际水样中汞的检测分析结果
3 结论
实验设计并成功合成了双金属MOF作为模板/前驱体,通过热解制备了高比表面积、高石墨化程度和均匀N掺杂的多孔碳骨架。将新型纳米材料修饰在电极上,采用SWASV法实现了对Hg(Ⅱ)的分析,宽的检测范围(0.1~1.3 μM),较好的灵敏度(33.49 μA/μM)、线性程度(R
=0.999)和检测限(LOD=7.31 nM)说明该修饰电极对Hg(Ⅱ)具备较强的分析能力。修饰电极的溶出伏安行为表明ZnCo双金属结构和富N多孔碳骨架的协同作用能有效改善传感器表面的吸附能力和导电性。此外,该传感器还具备较强的稳定性、重现性和抗干扰能力,成功实现对模拟实际水样中汞的检测分析。总之,双金属MOF衍生多孔碳骨架纳米复合材料修饰电极可以用于Hg(Ⅱ)的分析,同时这种简单的策略也为电分析材料的开发提供了一种全新思路。
