牛膝多糖调控Wnt/β-catenin通路改善骨质疏松性骨折大鼠骨代谢的研究*
杨豪,曾范慧
驻马店市中心医院,河南 驻马店 463400
骨质疏松是由于骨量低、骨微结构遭破坏而引发的全身性骨骼疾病。老年人群较为常见,绝经后的女性发病率也较高[1]。随着老龄化日益加重,骨质疏松患者发病率也逐年上升[2]。有文献报道,仅骨质疏松所致髋部骨折患者中1年内因并发症致死率约20%,50%左右患者致残,严重影响患者的生活[3]。目前增强骨质的常见药物有雌激素、降钙素、生长激素等,但是长期使用药物引起的不良反应不容忽视[4]。牛膝具有补肝肾、强筋骨、活血化瘀的功效[5]。牛膝多糖为牛膝的主要成分之一。研究表明,牛膝多糖可促进关节软骨细胞增殖,可应用于骨性关节炎[6]。Wnt/β-连环蛋白(β-catenin)通路在骨发育、分化及修复等过程中具有重要调节作用。研究发现,激活Wnt/β-catenin通路可以调节骨代谢,促进骨折愈合[7]。本研究基于Wnt/βcatenin通路探讨牛膝多糖对骨质疏松骨折大鼠骨代谢的调控作用,为临床治疗骨质疏松骨折提供依据。
1 材料
1.1 动物清洁级SD雌鼠60只,体质量270~290 g,购自上海吉辉实验动物饲养有限公司,许可证号:SCXK(沪)2019-0001。饲养条件:12 h光照12 h黑暗,温度(25±2)℃,相对湿度40%~60%,自由饮食和进水。伦理批号:ZMDCH201902-03。
1.2 药物与试剂牛膝多糖(纯度≥98%,兰州沃特莱斯生物科技有限公司,批号:130415);尼尔雌醇(安徽圣鹰药业有限公司,批号:190412)。生理盐水(辽宁民康制药有限公司,批号:20181204);RNA提取试剂盒、反转录试剂盒(北京全式金生物技术有限公司,批号:180316、180520);细胞裂解液(上海李记生物科技有限公司,批号:20180416003);制胶试剂盒(北京德元国际科技有限公司,批号:20180912A);电化学发光(electrochemi luminescence,ECL)试剂盒(上海炎熙生物科技有限公司,批号:181114C);实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)预混体系(SYBR GreenⅠ)(上海联迈生物工程有限公司,货号:RT0416135208);碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(bone gla protein,BGP)、Ⅰ型前胶原氨基端前肽(type Iprocollagen propeptide,PINP)、Ⅰ型胶原蛋白交联N端端肽(N-terminal typeⅠcollagen telopeptide,NTx)酶联免疫(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉云克隆科技股份有限公司,批号:190106、190225、190218、190316);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatage,TRAP)ELISA试剂盒(上海酶联生物科技有限公司,批号:20181013007);苏木精-伊红(hematoxylin eosin,HE)染色试剂盒(武汉博士德生物工程有限公司,批号:1805A);引物合成委托苏州金唯智生物科技有限公司;β-catenin、RUNT相关转录因子2(runt-related transcription factor 2,Runx2)、骨形成转录因子(Osterix)、磷酸化β-连环蛋白(phosphorylationβ-catenin,p-β-catenin)、β-actin单克隆抗体及辣根过氧化物酶(horse radish peroxidase,HRP)二 抗(美 国Abcam公 司,批 号:180611、180425、180326、180107、180922、180715);蛋白定量试剂盒(美国Sigma公司,批号:1904112)。
1.3 仪器HBS-1096A型酶标仪(南京德铁实验设备有限公司);HHQ-3558型组织切片机(杭州艾普仪器设备有限公司);BK-T型摊烤片机(山东博科生物产业有限公司);BX53M型光学显微镜(日本Olympus公司);Mini-PROTEAN Tetra型电泳槽和Trans-Blot Turbo型蛋白转印系统(美国Bio-Rad公司);AriaDNA型RT-qPCR仪(加拿大鲁美科思公司);UltraFocus型双能X射线小动物骨密度仪(美国Faxitron公司)。
2 方法
2.1 动物模型的复制与给药从60只大鼠中随机挑出50只进行去卵巢骨质疏松大鼠模型的制备,打开大鼠腹腔,切除大鼠两侧卵巢并缝合伤口,余下10只仅开腹腔、切除卵巢周围的脂肪组织,不进行卵巢切除并缝合伤口,记作假手术组。正常饲养10周后,使用双能X射线骨密度仪检测60只大鼠骨密度值,当建模大鼠骨密度值低于假手术组大鼠骨密度值平均数2.5个标准差以上为建模成功。然后将大鼠右侧股骨中段切开骨膜,横向锯断股骨,立即使用克氏针将断骨固定后进行伤口缝合。将建模成功的大鼠随机分为5组,分别为模型组、阳性对照组及牛膝多糖高、中、低剂量组。建模术后第2天大鼠进行药物治疗,阳性对照组大鼠灌胃0.21 mg·kg-1尼尔雌醇,牛膝多糖高、中、低剂量组分别灌胃8 g·kg-1、4 g·kg-1、2 g·kg-1牛膝多糖,假手术组和模型组分别灌胃同体积生理盐水,每天1次,连续12周。
2.2 检测大鼠骨密度(bone m ineral density,BMD)水平 分别于给药前和给药12周后通过双能X线吸收测量法检测大鼠股骨BMD水平,将双能X线骨密度仪设置为Hi-red Small animal模式,检测大鼠股骨BMD水平。
2.3 检测大鼠骨代谢指标给药12周后,对大鼠进行尾静脉取血,收集血清,按照ELISA试剂盒说明书检测血清ALP、BGP、PINP、NTx、TRAP水平。
2.4 骨组织病理学检查每组随机选择3只大鼠,脱颈椎法处死后,取大鼠骨折端骨组织,经过甲醛固定过夜后加入10%EDTA溶液中脱钙4周。经过包埋、切片后使用HE染色试剂盒进行染色,操作参考产品说明书。经过中性树脂封片后,在光学显微镜下观察骨组织骨小梁的数量、排列情况、形态及连续性等。
2.5 检测骨质疏松性骨折模型大鼠骨折端骨组织中β-catenin mRNA、Runx2 mRNA、Osterix mRNA水平每组随机选择3只大鼠,颈椎脱臼处死后,取大鼠骨折端骨组织,加入液氮进行研磨,用RNA提取试剂盒提取组织中总RNA,使用反转录试剂盒将总RNA反转录为cDNA。查找目的基因mRNA序列,设计出上下游引物。β-catenin上游引物:5′-TAGTACCGATAGCTAAACTG-3′,下游引物:5′-TAAGTACCTCAATACGTAGA-3′,产物长度为121 bp;Runx2上游引物为:5′-TGACTTACGTCCAGTCAACG-3′,下 游 引 物 为:5′-TGGTACCTAGCTGGTAATAC-3′,产物长度为123 bp;Osterix上游引物:5′-TAACGTGCATCGGCTAACGT-3′,下游引物:5′-GATCCGTGCGGTACCATACT-3′,产物长度为119 bp;β-actin上游引物:5′-TGCACTTGCATGACTCGAAT-3′,下游引物:5′-GATTACCATCGGATCGGATA-3′,产物长度132 bp。按照cDNA 0.5μL,上下游引物各1μL,荧光预混试剂1μL,dNTP 1μL,ddH2O 5.5μL,总体积10μL的体系加入PCR的96孔板中。退火温度设置为58℃,40个循环。反应结束后,使用配套荧光采集系统得到各样品Ct值,以β-actin为持家基因,根据2-ΔΔCt得出目的基因水平。
2.6 W estem Blot法检测骨质疏松性骨折模型大鼠骨折端骨组织中β-catenin、Runx2、Osterixl及p-β-catenin蛋白表达每组随机选择3只大鼠,颈椎脱臼处死后,取大鼠骨折端骨组织,将骨折端骨组织中加入少许液氮,研磨匀浆后,加入细胞裂解液,在4℃摇床中过夜裂解后,10 000×g离心5 min,上清即为细胞总蛋白。用细胞核蛋白提取试剂盒提取细胞核蛋白;加入上样缓冲液并在沸水中煮沸5 min使蛋白变性;用制胶试剂盒制胶并上样进行电泳,电泳结束后转膜,使用5%脱脂牛奶封闭,一抗孵育过夜,更换二抗室温孵育2 h,在暗室中使用ECL发光液显色,经过显影液、定影液处理后,在胶片上显示出目的条带。用扫描仪将胶片上的条带进行灰度值分析,以β-actin为参考,计算目的蛋白相对表达水平。
2.7 统计学方法采用SPSS 20.0软件对实验数据进行统计学分析,实验数据均采用平均数±标准差(±s)表示,多组间比较使用单因素方差分析,两组间比较使用SNK-q检验。P<0.05认为具有统计学意义。
3 结果
3.1 对骨质疏松性骨折模型大鼠股骨BMD水平的影响50只建模大鼠,共48只建模成功。模型组和阳性对照组每组9只,牛膝多糖高、中、低剂量组每组10只。大鼠治疗期间,由于灌胃操作不当导致牛膝多糖高剂量组和中剂量组分别死亡1只。股骨BMD水平检测结果显示:治疗前,与假手术组比较,模型组、阳性对照组和牛膝多糖高、中、低剂量组大鼠BMD水平均显著降低(P<0.05),各组间差异无统计学意义(P>0.05)。治疗后,与假手术组比较,模型组大鼠BMD水平显著降低(P<0.05);与模型组比较,牛膝多糖高、中、低剂量组与阳性对照组大鼠BMD水平显著升高(P<0.05)。见表1。
表1 对骨质疏松性骨折模型大鼠股骨BMD水平的影响 (±s)
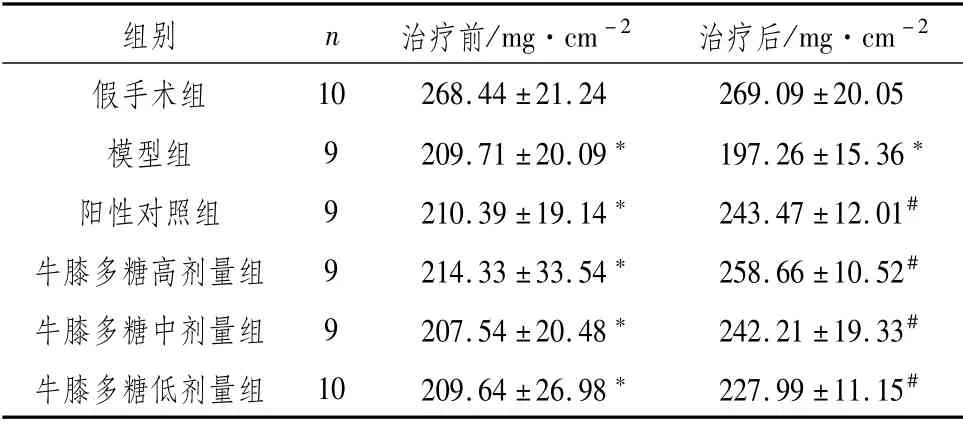
表1 对骨质疏松性骨折模型大鼠股骨BMD水平的影响 (±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 n治疗前/mg·cm-2 治疗后/mg·cm-2 10 268.44±21.24 269.09±20.05模型组 9 209.71±20.09* 197.26±15.36*阳性对照组 9 210.39±19.14* 243.47±12.01#牛膝多糖高剂量组 9 214.33±33.54* 258.66±10.52#牛膝多糖中剂量组 9 207.54±20.48* 242.21±19.33#牛膝多糖低剂量组 10 209.64±26.98* 227.99±11.15假手术组#
3.2 大鼠血清骨代谢指标与假手术组比较,模型组大鼠血清ALP、BGP和PINP水平显著降低(P<0.05),NTx、TRAP水平显著升高(P<0.05);与模型组比较,牛膝多糖高、中、低剂量组与阳性对照组大鼠血清ALP、BGP和PINP水平显著升高(P<0.05),NTx、TRAP水平显著降低(P<0.05)。见表2。
表2 大鼠血清骨代谢指标 (±s)

表2 大鼠血清骨代谢指标 (±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 n ALP/U·L-1 BGP(ρ/μg·L-1) PINP(ρ/μg·L-1)NTx(c/μmol·L-1)TRAP(ρ/μg·L-1)1.65 1.48.±0.34模型组 9 112.33±11.45* 0.91±0.13* 26.44±5.85* 19.35±4.87* 2.85±0.56*阳性对照组 10 156.70±15.05# 1.45±0.25# 62.81±7.12# 13.12±3.06# 2.28±0.16#牛膝多糖高剂量组9 188.45±13.21# 1.71±0.18# 84.33±10.86# 10.01±1.82# 1.77±0.39#牛膝多糖中剂量组9 155.38±18.33# 1.42±0.18# 65.50±7.01# 13.54±1.08# 2.21±0.25#牛膝多糖低剂量组10 125.44±12.08# 1.19±0.12# 51.27±6.24# 16.99±1.39# 2.56±0.17假手术组 10 200.89±22.06 2.05±0.21 93.45±12.98 8.28±#
3.3 大鼠骨折端骨组织病理学变化假手术组大鼠骨小梁粗大致密,粗细均匀且结构连续性好;模型组大鼠骨小梁数量减少,排列凌乱且稀疏,骨小梁连接性差,存在大片无骨小梁骨髓区;阳性对照组大鼠骨小梁连续性较好;牛膝多糖高、中、低剂量组随着剂量的增加,骨小梁逐渐数量增多,形态增粗,连续性增加。见图1。
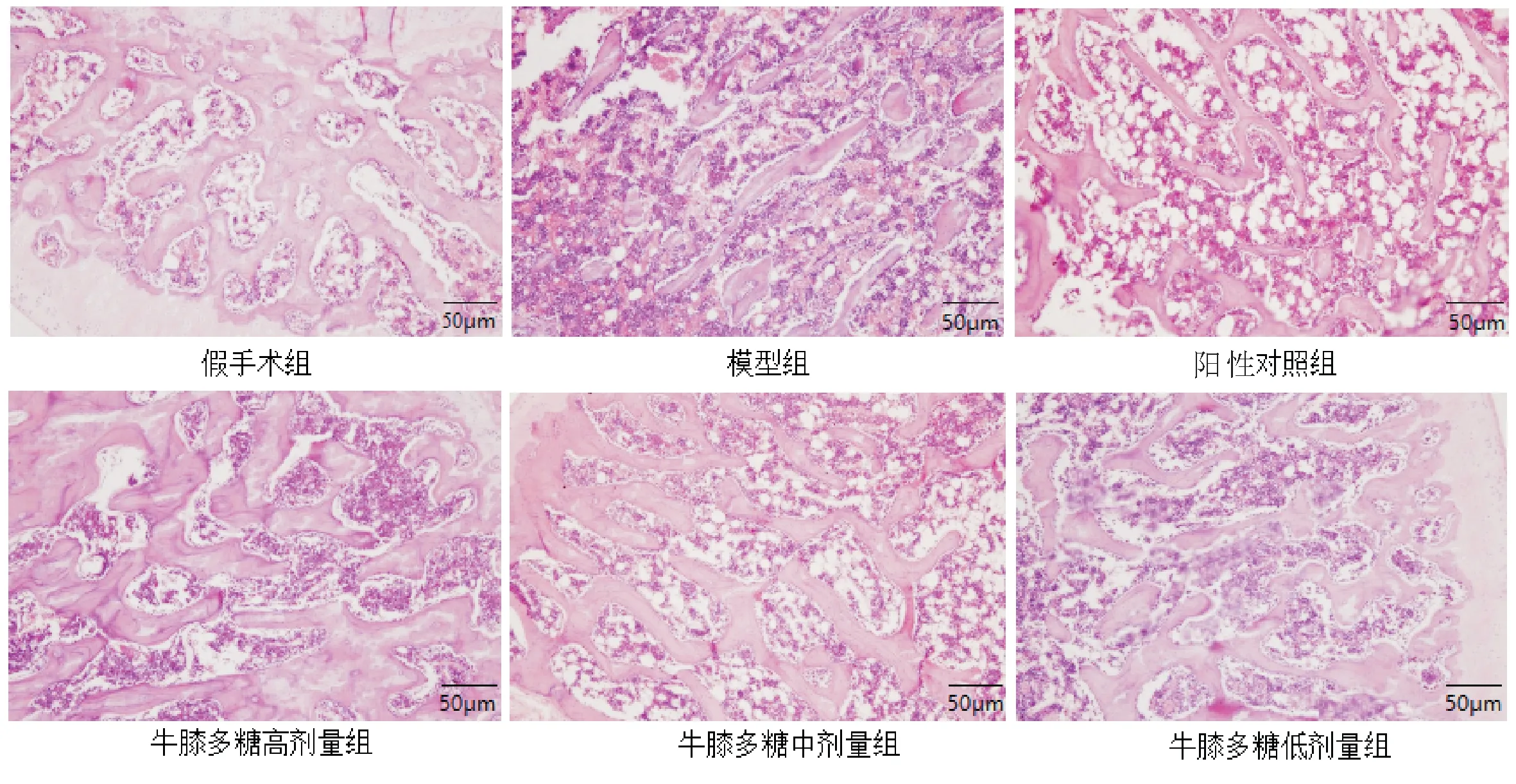
图1 大鼠骨折端骨组织病理学观察(HE染色,×100)
3.4 对骨质疏松性骨折模型大鼠骨折端骨组织中β-catenin m RNA、Runx2 m RNA、Osterix m RNA水平的影响与假手术组比较,模型组大鼠骨折端骨组织β-catenin mRNA、Runx2 mRNA、Osterix mRNA水平显著降低(P<0.05);与模型组比较,牛膝多糖高、中、低剂量组与阳性对照组大鼠骨折端骨组织β-catenin mRNA、Runx2 mRNA、Osterix mRNA水平显著升高(P<0.05)。见表3。
表3 RT-qPCR检测骨折端骨组织中β-catenin m RNA、Runx2 m RNA、Osterix m RNA表达 (±s)

表3 RT-qPCR检测骨折端骨组织中β-catenin m RNA、Runx2 m RNA、Osterix m RNA表达 (±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 n β-catenin mRNA Runx2 mRNA Osterix mRNA假手术组0.88±0.21 1.25±0.45 0.74±0.21模型组 3 0.32±0.09* 0.47±0.06* 0.11±0.02*对照组 3 0.45±0.06# 0.72±0.12# 0.46±0.06#牛膝多糖高剂量组 3 0.67±0.13# 0.95±0.17# 0.63±0.12#牛膝多糖中剂量组 3 0.45±0.05# 0.76±0.12# 0.45±0.08#牛膝多糖低剂量组 3 0.39±0.03# 0.58±0.08# 0.33±0.04 3#
3.5 对骨质疏松性骨折模型大鼠骨折端骨组织中β-catenin、胞核β-catenin、Runx2、Osterixl蛋白及p-β-catenin表达的影响与假手术组比较,模型组大鼠骨折端骨组织β-catenin、胞核β-catenin、Runx2、Osterixl蛋白表达显著下调(P<0.05),p-β-catenin/β-catenin水平显著升高(P<0.05);与模型组比较,牛膝多糖高、中、低剂量组与阳性对照组大鼠骨折端骨组织β-catenin、胞核βcatenin、Runx2、Osterixl蛋白表达显著上调(P<0.05),p-β-catenin/β-catenin水平显著降低(P<0.05)。见图2、表4。
表4 骨折端骨组织中β-catenin、胞核β-catenin、Runx2、Osterixl蛋白及p-β-catenin表达检测 (±s)

表4 骨折端骨组织中β-catenin、胞核β-catenin、Runx2、Osterixl蛋白及p-β-catenin表达检测 (±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
-actin假手术组 3 0.88±0.11 0.62±0.12 0.30±0.07 1.19±0.21 0.组别 n β-catenin/β-actin胞核β-catenin/β-actin p-β-catenin/β-catenin Runx2/β-actin Osterix/β 71±0.12模型组 3 0.34±0.07* 0.15±0.02* 1.05±0.18* 0.45±0.06* 0.21±0.04*阳性对照组 3 0.69±0.10# 0.35±0.06# 0.69±0.12# 0.73±0.12# 0.47±0.06#牛膝多糖高剂量组 3 1.06±0.18# 0.79±0.13# 0.42±0.08# 0.94±0.16# 0.65±0.12#牛膝多糖中剂量组 3 0.75±0.15# 0.36±0.07# 0.55±0.03# 0.77±0.08# 0.44±0.05#牛膝多糖低剂量组 3 0.58±0.11# 0.23±0.03# 0.81±0.11# 0.58±0.08# 0.35±0.05#

图2 骨折端骨组织中β-catenin、胞核β-catenin、Runx2、Osterixl蛋白及p-β-catenin表达检测
4 讨论
由于女性绝经后卵巢功能减退导致骨代谢紊乱、破骨细胞活性增强,使骨小梁吸收加快,成骨细胞活性相对减弱,骨形成速度缓慢,最终导致骨丢失,发生骨质疏松[8-9]。骨质疏松表现为骨量减少、骨微结构破坏、骨脆性增加,增加了骨折的风险。骨质疏松性骨折常见脊柱骨折、尺桡骨骨折、髋部骨折等,严重降低患者的生活质量[10]。尼尔雌醇是雌激素类药物,也是绝经期妇女防治骨质疏松的常用药物,具有吸收好、效果明显的特点[11]。但有研究表明,长期使用雌激素类药物可能会引起头痛、高血压、子宫出血,增加患卵巢癌、子宫肌瘤的风险等不良反应[12]。本研究通过摘除大鼠双侧卵巢后,经双能X线骨密度仪检测BMD水平均降低,骨质疏松大鼠经过右侧股骨骨折后,骨质疏松骨折大鼠模型制备成功。
本研究中牛膝多糖高、中、低剂量组和阳性对照组大鼠经过12周的治疗后,BMD水平显著提高,骨代谢发生改善,提示常规西药和牛膝多糖均能增强骨质疏松症大鼠的骨密度。本研究还发现,经过牛膝多糖治疗后,大鼠血清NTx和TRAP水平较模型组均降低,表明牛膝多糖具有抑制骨吸收的作用。ALP在成骨过程中能水解磷酸酯和焦磷酸盐活性,有利于骨矿化,促进骨形成[13-14]。血清中ALP水平可能来自骨组织及肝脏等其他组织。因此,检测机体骨形成水平还需更具特异性的骨形成指标如BGP来验证。BGP主要由成骨细胞合成,可与骨基质结合,维持骨正常矿化速度,血清中BGP水平的高低可反映成骨细胞活性[15-16]。人体骨基质中约90%的成分为Ⅰ型胶质,PINP是Ⅰ型胶原前体转化为胶原纤维质的过程中裂解的产物之一。当一个胶原分子合成,会产生一个PINP分子,因此,PINP直接反映出Ⅰ型胶原合成速率[17]。本研究结果显示,牛膝多糖组大鼠血清中ALP、BGP和PINP水平均较模型组升高,表明牛膝多糖可促进骨形成。骨质吸收过程中,NTx是骨胶原纤维降解产物。因此,血清中NTx反映了骨吸收水平,是骨吸收的特异性指标[14]。TRAP主要由破骨细胞释放,对骨基质中矿化底物进行降解,反映了破骨细胞活性[15]。牛膝归肝、肾经,有补肝肾、健筋骨、活血化瘀的功效,可用于治疗肝肾亏虚、跌打瘀痛、腰膝酸痛、筋骨无力等[18-19]。牛膝多糖是牛膝的活性成分之一,可用于治疗骨性关节炎[20]。李开言等[21]研究表明,牛膝多糖含药血清应用于损伤的软骨细胞可提高其增殖活性,对改善骨代谢、防治骨质疏松症具有重要意义,与本研究结果相符。
Wnt/β-catenin信号通路不仅在胚胎发育过程中发挥重要调节作用,在骨代谢过程中也十分关键[22-23]。β-catenin是Wnt/β-catenin信号通路中的关键分子,无Wnt信号激活时,β-catenin会被Axin/APC/GSK 3β复合体磷酸化并被溶酶体降解,当Wnt信号被激活时,β-catenin不发生磷酸化,可进入细胞核激活其下游信号因子Runx2[24]。Runx2是Runt家族成员之一,是成骨分化的特异性转录因子。研究表明,Runx2基因缺失可导致成骨细胞分化被抑制,骨膜成骨和软骨内成骨会被抑制[25]。此外,Runx2可促进Ⅰ型胶原合成,提高ALP、BGP、PINP水平,抑制NTx和TRAP水平[26]。Osterix是Runx2下游信号因子,也是骨发育过程中主要调节因子之一。研究表明,Osterix基因敲除小鼠,Runx2表达正常,敲除小鼠Osterix基因无法正常表达,且成骨细胞无法发育为成骨细胞[27]。因此,Osterix与Runx2在成骨细胞增殖分化和骨代谢过程中发挥重要作用。本研究中经过牛膝多糖治疗后β-catenin、胞核β-catenin、Runx2和Osteri蛋白表达增加而p-β-catenin水平下降。郎小琴等[28]对老年骨质疏松大鼠模型灌胃牛膝多糖发现,骨形成指标水平均升高,而骨吸收指标水平降低,与本研究结果一致;此外,还发现大鼠双侧最大应力及断裂吸收能量显著升高,证实牛膝多糖不仅可改善老年骨质疏松大鼠的骨代谢水平,还可降低骨折风险。Li R等[29]研究显示,微小核糖核酸-23b-3p可阻断Wnt/β-catenin信号通路参与绝经后骨质疏松,且发现p-β-catenin表达升高,而该通路下游的Runx2和Osterix表达下降。由此推测,牛膝多糖可提高大鼠骨密度,改善骨代谢水平可能与激活Wnt/β-catenin信号通路有关。
综上所述,牛膝多糖可提高骨质疏松骨折模型大鼠骨密度,改善大鼠骨代谢水平,减轻大鼠骨组织病理损伤,可能与激活Wnt/β-catenin信号通路,上调β-catenin、胞核β-catenin表达,下调p-β-catenin表达,从而促进下游Runx2和Osterix表达有关。本研究为骨质疏松骨折患者治疗提供新思路。由于参与骨形成信号通路较多,是否影响其他信号通路尚未涉及,需进行进一步研究。

