黄芪通过上调缺氧诱导因子-1α表达对大鼠肝缺血再灌注损伤的保护作用
刘明明 殷涛
(赤峰学院附属医院普外二科,内蒙古 赤峰 024000)
肝缺血再灌注损伤(HIRI)常并发于肝部分切除术、肝移植等很多的肝外科手术中,它是各种机制相互作用对肝细胞造成损害,进而导致肝功能受损,最终造成肝衰竭,严重影响患者预后〔1~3〕。缺氧诱导因子(HIF)-1α是一种在低氧条件下发挥作用的重要转录调节因子,在常氧条件下HIF-1α被降解而表达很少,在低氧条件下HIF-1α被激活而大量表达,研究证实,HIF-1α在调整细胞凋亡中起重要作用〔4~6〕。二甲基乙二酰甘氨酸(DMOG)是脯氨酸羟化酶的抑制剂,通常采用此方法来稳定HIF-1α的表达。本研究利用大鼠肝缺血再灌注(HIR)模型,向大鼠体内注入黄芪注射液及DMOG进行预处理,观察大鼠HIRI后生化指标、免疫组化表达、凋亡情况及肝细胞形态变化,进而探讨黄芪对大鼠HIRI的保护作用机制。
1 材料与方法
1.1动物与分组 雄性SD大鼠96只购于赤峰学院实验动物中心,体重(220±20)g,随机分为4组:假手术(Sham)组、缺血再灌注(IR)组、黄芪(AG)组和AG+DMOG组,各组按再灌注1、6、12、24 h分为不同的时间点。
1.2主要试剂 AG注射液生产于成都地奥九泓药业有限公司(批号:Z51021775)。HIF-1α免疫组化试剂盒是由上海市雅吉生物科技提供。HIF-1α引物是由上海生物工程技术服务有限公司提供;逆转录试剂盒购自日本TOYOBO公司。B细胞淋巴瘤(Bcl)-2和Bcl-2相关X蛋白(Bax)酶联免疫吸附试验(ELISA)试剂盒购自南京森贝伽生物科技有限公司。TUNEL细胞凋亡检测试剂盒购自上海前尘生物科技有限公司。
1.3方法
1.3.1建立动物模型 建立大鼠HIRI模型采用Pingle法。实验大鼠术前12 h禁食,不限饮水,称体重。麻醉采用腹腔内注射的方法。IR组:麻醉起效后,常规备皮,消毒铺巾,切口选取上腹部正中切口,分离出Treitz韧带,用血管夹阻断肝门,造成70%HIR模型,40 min后移走血管夹恢复血流,实验前1 w开始每天自尾静脉缓慢注射1次3.0 ml生理盐水;Sham组:游离出肝十二指肠韧带,不阻断肝门;AG组:按10 g/kg比例用生理盐水将AG稀释到3.0 ml,再灌注前1 w开始每日自尾静脉注入1次(注药时间同IR组)。AG+DMOG组:按AG组比例,AG注射液与稳定剂DMOG(40 mg/kg)一起用生理盐水稀释到3.0 ml,再灌注前1 w开始自尾静脉注入1次(注药时间同IR组)。
1.3.2标本取材 各组在再灌注后各时间点分别对各时间点的大鼠心腔采2 ml血,移至离心管静止后离心、提血清,再置于-20℃冰箱保存待测;各组大鼠在HIR6h随机取1只大鼠的1块左叶肝组织约60 mg,立即放入冻存管保存于液氮中;另取2块修成1.0 cm×1.0 cm×0.5 cm大小,迅速置于甲醛溶液中固定;再修成2块约0.1 cm×0.1 cm×0.1 cm大小,并快速固定于3%戊二醛中。
1.4指标检测
1.4.1肝生化指标测定 取血清1 ml用生化分析仪测大鼠谷丙转氨酶(ALT)和谷草转氨酶(AST)水平。
1.4.2免疫组化及结果判定 按HIF-1α免疫组化试剂盒操作说明书步骤操作,阴性对照采用磷酸盐缓冲液(PBS)。HIF-1α的阳性表达为胞核/胞质内呈棕黄色颗粒。应用计算机系统进行图像分析,光镜下每张切片随机取6个视野,分别计各视野中阳性细胞数,并计算阳性细胞率(即阳性细胞数/视野内细胞总数)。
1.4.3RT-PCR检测HIF-1α表达 采用Oligo6 和Primer5.0软件设计PCR引物,HIF-1α上游引物序列:5′-TACTGCAGCAACCAGGTG-3′,下游引物序列:5′-ACAGAAACGAAACCCCAC-3′;β-actin上游引物序列:5′-CTGTCCCTGTATGCCTC-3′,下游引物序列:5′-ATGTCACGCACGATTT-3′。从液氮中取出肝组织块,参照Trizol试剂盒说明书操作,应用分光光度法测总RNA纯度和含量;按Taraka试剂盒说明书进行逆转录反应;扩增;利用Eagle Eye型图像分析系统观察电泳的结果,测HIF-1α扩增带的OD值,用β-actin的OD值作为参照,从而得到HIF-1α和β-actin的OD值相对比值。
1.4.4Bax和Bcl-2蛋白测定 将切取的左肝部分组织加9倍量生理盐水,用匀浆机制成10%肝匀浆,按试剂盒说明书分别采用ELISA测定肝匀浆中Bax和Bcl-2的含量。
1.4.5凋亡检测 采用TUNEL法行肝组织切片细胞凋亡的原位检测,具体步骤按试剂盒说明书操作。阳性结果判定:在光镜下观察到细胞核/细胞质呈棕黄色颗粒的细胞即为凋亡细胞,各标本的组织切片随机选取5个400倍视野,从而算出凋亡细胞在平均每100个细胞中的存在比例,即凋亡指数(AI)。
1.4.6电镜观察 取出固定于戊二醛的小块肝组织,按电镜操作步骤进行,最后观察、摄片。
1.5统计学分析 采用SPSS20.0软件进行方差分析及t检验。
2 结 果
2.1各组血清AST、ALT水平比较 各组AST、ALT水平比较:IR组>AG组>AG+DMOG组>Sham组(均P<0.05)。见表1。

表1 各组灌注后不同时间点血清AST、ALT水平比较
2.2各组HIF-1α mRNA和蛋白表达水平比较 各组肝缺血后再灌注各时间点HIF-1α mRNA及蛋白比较:Sham组 图1 各组肝细胞再灌注6 h HIF-1α的表达(SP法,×200) 表2 各组再灌注后不同时间肝组织HIF-1α mRNA和蛋白表达水平比较 2.3各组Bax和Bcl-2蛋白表达水平比较 各组肝组织Bcl-2、Bax蛋白比较:IR组>AG组>AG+DMOG组>Sham组(均P<0.05)。见表3。 表3 各组再灌注后不同时间肝组织Bcl-2、Bax蛋白表达水平比较 2.4各组肝细胞AI水平比较 肝脏凋亡细胞核被染成棕褐色,各组肝细胞AI水平:IR组>AG组>AG+DMOG组>Sham组(均P<0.05)。见图2,表4。 图2 各组肝细胞再灌注6 h凋亡情况(TUNEL,×400) 表4 各组再灌注后不同时间点肝细胞AI比较 2.5各组肝细胞超微结构变化 HIR 6 h后,在电镜下观察肝细胞超微结构:Sham组细胞内线粒体及内质网排列规则,细胞核结构清楚;IR组细胞内线粒体明显肿胀、嵴结构断裂,且有很大部分空泡变性,有很大一部分细胞核核膜结构消失,还有一部分内质网明显扩张,其上的核糖体有很明显的脱落;AG组有部分线粒体及内质网略肿胀,排列尚可,细胞核核膜结构相对清楚;AG+DMOG 组仅有很少的线粒体及内质网略微肿胀,排列也较规则,核膜结构非常清楚。见图3。 2.6Pearson相关性分析 AG组和AG+DMOG组HIF-1α表达与Bcl-2蛋白表达呈正相关(r=0.784,0.803;均P<0.001)。 图3 各组肝细胞再灌注6 h超微结构(×15 000) 缺血再灌注对大鼠肝脏造成了很大的打击,而AG预处理在大鼠HIRI中发挥了重要的保护作用。从实验数据可看出,HIRI导致大鼠肝酶学指标(ALT、AST)明显升高,且对大鼠肝脏造成的损伤在HIRI早期(6 h)最为严重,本研究结果表明AG对大鼠HIRI有很好的保护作用,另外,因DMOG是HIF-1α的稳定剂,故可推断AG可能通过调节HIF-1α对HIRI起保护作用。HIRI是一个涉及多阶段、多因素的复杂病理生理过程,目前认为它与细胞凋亡密切相关〔7~11〕。Bcl-2是参与HIRI过程中的一个重要的细胞凋亡抑制因子,主要表达产物定位在线粒体、核膜和内质网上,它可通过表达Bcl-2蛋白抑制促凋亡基因的信号传递等发挥抗细胞凋亡作用。Bax/Bcl-2是一对凋亡与抗凋亡的基因表达的蛋白,二者表达的平衡结果将决定细胞的凋亡状态〔12,13〕。诱导细胞凋亡过程的主要分子是Bax二聚体;在Bcl-2存在时,它优先与Bax形成异二聚体,使细胞中游离的Bax形成二聚体从而促进凋亡过程。本研究结果表明细胞凋亡参与了HIRI,AG可以通过抗细胞凋亡对HIRI起保护作用,而AG+DMOG组效果更好,这也说明AG通过抗细胞凋亡来减轻HIRI是通过HIF-1α的参与实现的。 HIF-1是一种能与促红细胞生成素(EPO)基因结合的核转录因子〔14〕。HIF-1由α和β两个亚基组成的DNA结合性蛋白分子。HIF-1α受氧分压的调控,在常氧条件下,HIF-1α在脯氨酸羟化酶作用下被蛋白酶体降解,半衰期约5 min;在低氧条件下,HIF-1α的降解受到抑制,以至于HIF-1α表达增加,进而激活下游多种靶基因而发挥生物学作用。目前研究发现,HIF-1α在轻度低氧(1%~3%)情况下发挥抑制凋亡作用,而当重度低氧(0.0%~0.5%)环境中大量表达而诱导细胞凋亡〔15,16〕。本研究结果表明AG是通过上调HIF-1α表达对早期大鼠HIRI起保护作用。
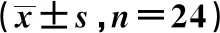


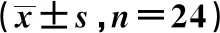

3 讨 论

