乙酰谷酰胺注射液联合吡拉西坦治疗老年重症颅脑损伤术后患者效果观察
刘兴涛,童 英,王天舒,陈俊县
(广东省第二人民医院,广东510317)
颅脑损伤常见于外伤所致,调查显示重症颅脑损伤占15%~25%,由于重症颅脑损伤可造成脑组织受损,具有较高致残率和致死率,严重威胁患者生命[1-2]。重症颅脑损伤病情危重,且患者临床表现复杂,常合并继发性脑损伤,容易形成脑水肿[1,3]。目前,针对重症颅脑损伤主要采用手术治疗,开颅手术是其主要治疗手段,但术后配合药物治疗对改善神经功能和减轻炎性反应尤为重要[4-5]。吡拉西坦是经典的一种神经营养物质,可用于脑血管病和脑外伤的治疗。乙酰谷胺注射液是治疗神经损伤的一种重要药物,可改善神经细胞代谢、维持神经元的应激功能等[6]。本文研究旨在探讨乙酰谷酰胺注射液联合吡拉西坦治疗老年重症颅脑损伤术后患者效果及对血清神经特异性烯醇化酶(NSE)和炎性因子影响。
1 资料与方法
1.1 一般资料 选择本院于2018年6月—2020年6月老年重症颅脑损伤患者92例,均行开颅手术治疗,依据随机数字表法分为观察组46例与对照组46例。观察组男性27例,女性19例;年龄62~74岁,平均(68.92±4.35)岁;平均体质量(65.87±12.13)kg;疾病类型:脑挫伤24例,脑内血肿13例,硬膜外血肿9例。对照组男性26例,女性20例;年龄60~75岁,平均(68.45±4.71)岁;平均体质量(66.23±13.98)kg;疾病类型:脑挫伤25例,颅脑血肿14例,硬膜外血肿7例。两组一般资料无显著性意义(P>0.05)。本研究经患者家属同意且医院伦理委员会批准。
1.2 纳入标准 ①经CT检查证实颅脑损伤,且患者均为重症;②受伤至入院≤8 h;③年龄≥60岁;④既往无颅脑损伤病史;⑤签订知情同意书。
1.3 排除标准 ①合并癫痫、脑部肿瘤等神经系统疾病者;②合并血液系统或重要脏器严重异常者;③开颅手术禁忌者或过敏体质者;④精神疾病者。
1.4 方法 两组患者均行开颅手术治疗,且给予控制颅内压、补液、抗感染、营养支持、维持水电解质和酸碱平衡。对照组给予吡拉西坦注射液(规格:20 ml∶4 g)100 ml静滴,3次/d,8 h/次;观察组在对照组基础上联用乙酰谷酰胺注射液(2 ml∶0.1 g)0.6 g,加入250 ml的5%葡萄糖注射液中,静脉滴注,1次/d。两组治疗疗程14 d。
1.5 观察指标 ①观察两组格拉斯哥昏迷(GCS)评分和急性生理与慢性健康(APACHEⅡ)评分变化;②观察两组神经功能缺损程度评分(NIHSS)和血清NSE水平变化,其中NIHSS评分越低神经功能越好,采集患者外周静脉血,分离血清,采用酶联免疫吸附法测定NSE水平;③观察两组炎性因子变化,采集外周静脉血,分离血清,采用酶联免疫吸附法测定白介素-6(IL-6)、C反应蛋白(CRP)和肿瘤坏死因子-α(TNF-α)水平。
1.6 统计学方法 采用SPSS 23.0软件处理,计量资料检验方法采用t检验;计数资料检验方法采用卡方检验。P<0.05具有显著性意义。
2 结果
2.1 两组治疗前后GCS和APACHEⅡ评分比较 两组治疗前GCS和APACHEⅡ评分比较差异无统计学意义(P>0.05);两组治疗后GCS评分高于治疗前,而APACHEⅡ评分低于治疗前(P<0.05);观察组治疗后GCS评分高于对照组,而APACHEⅡ评分低于对照组(P<0.05)。见表1。
表1 两组治疗前后GCS和APACHEⅡ评分比较(±s) 分
与治疗前同组比较,*P<0.05;与治疗后对照组比较,△P<0.05
组别例数APACHEⅡ评分治疗前 治疗后5.12±1.08 12.06±1.78*△ 18.49±2.63 9.32±1.83*△GCS评分治疗前 治疗后观察组对照组 46 5.08±1.43 9.96±1.96* 18.71±2.70 12.51±2.10*46
2.2 两组治疗前后NIHSS评分和NSE水平比较 两组治疗前NIHSS评分和NSE水平比较差异无统计学意义(P>0.05);两组治疗后NIHSS评分和NSE水平低于治疗前(P<0.05);且观察组低于对照组(P<0.05)。见表2。
表2 两组治疗前后NIHSS评分和NSE水平比较(±s)

表2 两组治疗前后NIHSS评分和NSE水平比较(±s)
与治疗前同组比较,*P<0.05;与治疗后对照组比较,△P<0.05
组别例数NSE水平(μg/L)治疗前 治疗后28.23±4.35 11.68±2.12*△ 48.98±8.93 23.15±4.56*△NIHSS评分(分)治疗前 治疗后观察组对照组 46 28.45±3.90 18.34±3.42* 49.41±9.12 31.92±7.87*46
2.3 两组治疗前后炎性因子变化比较 两组治疗前血清IL-6、CRP和TNF-α水平比较差异无统计学意义(P>0.05);两组治疗后血清IL-6、CRP和TNF-α水平低于治疗前(P<0.05);且观察组低于对照组(P<0.05)。见表3。
表3 两组治疗前后炎性因子变化比较(±s)
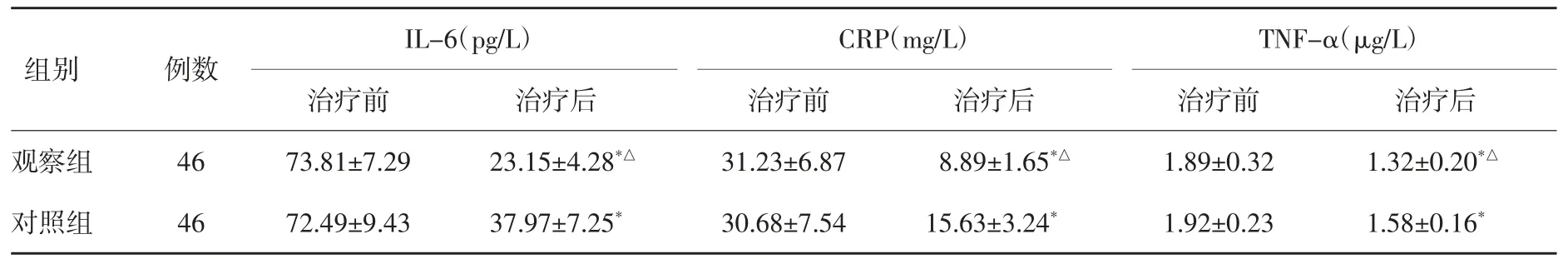
表3 两组治疗前后炎性因子变化比较(±s)
与治疗前同组比较,*P<0.05;与治疗后对照组比较,△P<0.05
组别观察组对照组 46 72.49±9.43 37.97±7.25* 30.68±7.54 TNF-α(μg/L)治疗前 治疗后1.89±0.32 1.32±0.20*△1.92±0.23 1.58±0.16*例数46 IL-6(pg/L)治疗前 治疗后 治疗前73.81±7.29 23.15±4.28*△ 31.23±6.87 CRP(mg/L)治疗后8.89±1.65*△15.63±3.24*
3 讨论
重症颅脑损伤具有病情变化迅速且多样,该疾病可在短时间内恶化为脑疝、昏迷,甚至死亡,受到医学界的广泛关注[7-11]。因此,采取及时有效的治疗重症颅脑损伤方法尤为重要。乙酰谷酰胺在体内可快速通过血脑屏障,并且在脑细胞内镜代谢产生γ-氨基丁酸和谷氨酸,其中γ-氨基丁酸作为抑制性神经递质,与其受体结合后,能够抑制神经纤维突触后模的兴奋性,且能够拮抗过量的兴奋性氨基酸所致的毒性作用[12]。此外,乙酰谷酰胺还可降低血氨,从而改善神经细胞代谢,有利于维持神经细胞应激功能和智力的恢复,以及促进鸟氨酸循环等多种作用[13]。因此,乙酰谷酰胺在脑血管病变、脑损伤等疾病中可作为重要的一种药物。吡拉西坦作为经典的一种神经营养药物,具有一定的改善血液流变学特性,降低血液黏稠度、增加红细胞的变形度及抑制血小板聚集等,具有促进微循环和抗血栓的效应,促进脑功能的恢复[14]。此外,吡拉西坦可提高脑细胞中ATP/ADP的比值,促进乙酰胆碱合成且提高神经兴奋性的传导,增加脑细胞抗缺氧能力,促进脑细胞功能恢复[15]。本文研究表明,观察组治疗后GCS评分高于对照组而APACHEⅡ评分低于对照组,治疗后NIHSS评分低于对照组,提示乙酰谷酰胺注射液联合吡拉西坦治疗效果良好,且可改善患者神经功能。
NSE主要存在于神经内分泌细胞,当出现神经元损伤后,使NSE通过血脑屏障进入血液[16]。研究报道显示,颅脑损伤患者血清NSE水平高于健体检者[17]。本文研究表明,观察组治疗后NSE水平低于对照组,提示乙酰谷酰胺注射液联合吡拉西坦治疗可降低血清NSE水平。炎性反应与颅脑损伤发生、发展密切相关。炎性因子IL-6可刺激神经元产生大量致炎因子,其水平变化参与神经修复过程。当肌体出现感染或创伤时,CRP作为一种急性时相蛋白,其水平迅速上升,病情稳定后水平迅速下降[18]。TNF-α作为启动炎症反应的一种关键细胞因子,可促进黏附因子表达于内皮细胞,从而导致白细胞聚集和黏附且从毛细血管迁移至脑,进一步激活胶质细胞而造成脑损伤[19]。本文研究表明,观察组治疗后血清IL-6、CRP和TNF-α水平低于对照组,提示乙酰谷酰胺注射液联合吡拉西坦可通过降低血清IL-6、CRP和TNF-α水平而减轻炎性反应。
综上所述,乙酰谷酰胺注射液联合吡拉西坦治疗老年重症颅脑损伤术后患者效果良好,可改善患者神经功能,降低血清NSE水平,减轻炎性反应。

