苯并二氢吡喃-4-酮的合成研究进展
郭文彬,王建新,桂琳琳,王晓季,3*,王李平*
(1.江西科技师范大学生命科学学院,江西 南昌 330013;2.江西科技师范大学药学院,江西 南昌 330013;3.东莞理工学院化学工程与能源技术学院,广东 东莞 523808)
苯并二氢吡喃-4-酮广泛存在于天然产物分子和药物分子中[1-3],该类化合物具有多种生物活性,如抗癌[4]、抗HIV[5]、抗氧化[6]、抗烟草花叶病毒[7]、抗菌[8]等,其优良的生物活性吸引了人们的广泛关注。传统合成苯并二氢吡喃-4-酮的方法主要是基于2′-羟基查尔酮的分子内氧杂Michael加成反应[9-10]、邻羟基苯乙酮和醛或酮的缩合环化反应[11]等,然而这些方法存在反应条件苛刻、底物适用范围受限等问题。相较于传统的合成方法而言,以邻烯丙氧基芳醛类底物直接合成苯并二氢吡喃-4-酮化合物的方法就显得更加高效,反应条件更加温和,步骤简短,底物适用范围更广。本文分别从氮杂环卡宾催化、金属催化、光催化及无金属催化4个方面进行了阐述。
1 氮杂环卡宾催化
氮杂环卡宾(NHC)是一类高效的有机催化剂,在有机催化领域有着广泛的应用,其中心碳原子上有一对孤对电子,具有结构多样化、对空气与氧化剂稳定等特征。1995年,Cigenak[12]以噻唑类氮杂环卡宾为催化剂,以2-甲酰基苯氧基丙烯酸酯为底物,合成了多种1,4-二羰基结构的苯并二氢吡喃-4-酮化合物(图1)。该法开创了Stetter反应的先河。1996年,Enders[13]同样以2-甲酰基苯氧基丙烯酸酯为底物,以手性三唑盐氮杂环卡宾为催化剂,制备了一系列具有立体构型的苯并二氢吡喃-4-酮化合物。该法立体选择性良好,对后续进行不对称合成苯并二氢吡喃-4-酮的方法具有指导意义。
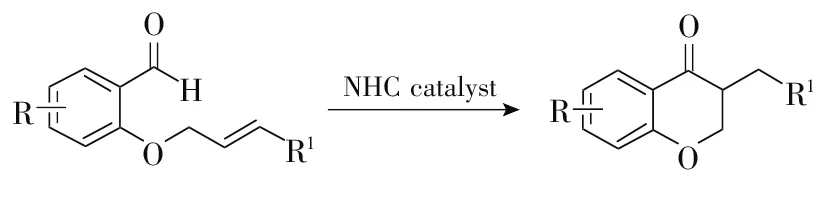
图1 氮杂环卡宾催化合成苯并二氢吡喃-4-酮
2008年,Rovis[14]以三氮唑类氮杂环卡宾为催化剂,利用乙烯基亚磷氧化物和乙烯基磷酸酯在烯烃β位的强亲电性,通过不对称Stetter反应合成了不对称磷酰化的苯并二氢吡喃-4-酮化合物。该法对简单的烯酮和烯酸酯两种亲核受体也有较好的催化作用,收率最高可达99%,ee值高达96%。2009年,Glorius[15]以噻唑类氮杂环卡宾为催化剂,成功合成了苯并二氢吡喃-4-酮化合物。该法官能团兼容性较强,适用于多种类型的邻烯丙氧基芳甲醛类化合物,对含氮杂原子的邻烯丙氮基芳甲醛类化合物也有较好的催化活性,最高收率达96%。然而,该法需要较高的反应温度(120 ℃),能耗较高。2011年,Stefan[16]以手性三氮唑氮杂环卡宾为催化剂,高立体选择性、高收率地合成了一系列苯并二氢吡喃-4-酮化合物,ee值都在99%以上,收率高达99%。但是该法使用的手性氮杂环卡宾催化剂较为昂贵。
氮杂环卡宾作为一类新型的有机催化剂,能高立体选择性、高收率地合成苯并二氢吡喃-4-酮化合物。但是目前仍存在试剂昂贵、制备工艺复杂等问题。
2 过渡金属催化
近年来,金属催化在苯并二氢吡喃-4-酮化合物的合成中应用较为普遍。目前用于该反应的催化剂主要是银盐,该类催化剂具有较高的催化活性,可以有效促进氧杂环的形成,在有机反应中发挥着重要的作用。
李福伟等[17]以亚磷酸酯与邻烯丙氧基芳甲醛进行自由基串联环化,合成了一系列磷酰化苯并二氢吡喃-4-酮化合物(图2a)。他们发现,在过硫酸钾作氧化剂的条件下,六氟锑酸银的催化效果最佳,最高收率为70%。该法提出了两种可能性的反应机理:一种是在氧化剂作用下,亚磷酸酯首先形成磷酰基自由基,然后引发邻烯丙氧基芳甲醛形成芳甲酰基自由基,紧接着进行自由基分子内环化,之后再与磷酰基自由基进行自由基偶联,得到磷酰化的苯并二氢吡喃-4-酮类化合物;另一种是磷酰基自由基首先与邻烯丙氧基芳甲醛的末端双键反应,紧接着进行自由基分子内环化得到烷氧自由基中间体,最后经氧化得到目标产物。
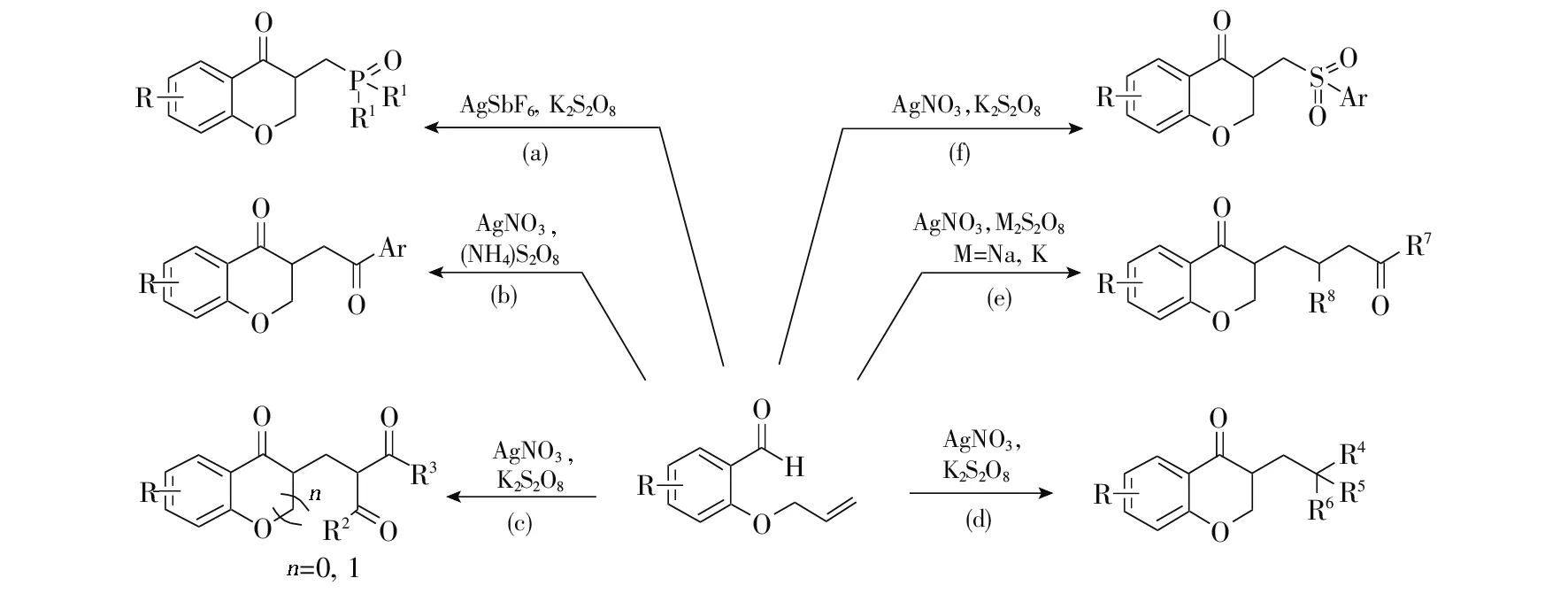
图2 过渡金属催化合成苯并二氢吡喃-4-酮
2017年,吴磊等[18]研究了硝酸银和过二硫酸铵条件下进行α-羰基羧酸与邻烯丙氧基芳甲醛的反应,合成了一系列苯并二氢吡喃-4-酮化合物(图2b)。该法反应收率适中,最高达73%。但是该反应的官能团兼容性有限,对于芳环上有硝基、氰基等缺电子官能团,反应无法进行。2018年,赵玉芬等[19]报道了1,3-二羰基化合物与邻烯丙氧基芳甲醛在银催化剂作用下的反应,用于合成1,5/1,3-二羰基化的苯并二氢吡喃-4-酮化合物(图2c)。该法同时适用于含有缺电子和供电子基团的1,3-二羰基化合物,最高收率达84%。随后,他们以银催化三级羰基酸和邻烯丙氧基芳甲醛进行脱羧及自由基串联环化合成了苯并二氢吡喃-4-酮(图2d)[20]。该法官能团兼容性较强,多种三级羧酸以及不同类型的邻烯丙氧基芳甲醛类化合物都能顺利进行反应,并以中等至较高收率得到一系列的苯并二氢吡喃-4-酮化合物,高效地在C3位引入烷基。该方法对长链脂肪族、环类及桥环类三级羧酸均具有较好的催化效果。
2019年,文献[21-22]报道了以硝酸银为催化剂,在过硫化物为氧化剂的条件下将环丙醇与邻烯丙氧基芳甲醛进行自由基串联环化反应,合成了一系列羰基化的苯并二氢吡喃-4-酮化合物(图2e)。该法适用于脂肪族、芳香族及含杂原子的环丙醇,但是2-烯丙基噻吩醛在该反应条件下不稳定,反应无法进行。2020年,文献[23]报道了芳基亚磺酸钠盐在硝酸银与过硫酸钾作用下合成磺酰化苯并二氢吡喃-4-酮化合物的研究成果(图2f)。该法在考察含有氟、氯、溴、甲基等芳基亚磺酸钠盐的反应时,均能以中等至较高收率得到目标磺酰化苯并二氢吡喃-4-酮产物。但是该法没有考察脂肪族亚磺酸钠盐的反应活性,应用范围有限。
邻烯丙氧基芳甲醛在金属催化剂的作用下能与多类型的自由基前体(如亚磷酸酯、羰基羧酸、二羰基化合物、环丙醇等)反应,构建苯并二氢吡喃-4-酮骨架结构,为后续合成结构更加多样化的苯并二氢吡喃-4-酮化合物提供了借鉴。然而,由于金属催化剂在使用过程中,不利于环保,甚至可能会造成金属残留于产物,因此开发更加经济环保的反应体系仍有待进一步探索。
3 可见光催化
2017年,Hong等[24]在钌光敏剂作用下,将邻烯丙氧基芳甲醛与叔丁基过氧化氢(TBHP)进行分子内自由基环化和环氧化反应,一步直接合成螺环氧基苯并吡喃-4-酮(图3)。该法与文献[25-26]报道的两步操作相比更加快速、便捷。在相同反应条件下,以邻烯丙氧基芳甲醇为底物,加大叔丁基过氧化氢的用量,也能够“一锅法”一步直接合成螺环氧基苯并吡喃-4-酮化合物。该法底物适用范围广,最高收率可达83%,且反应条件温和,在室温下即可进行,该法为后续其他光敏催化剂作用下合成苯并二氢吡喃-4-酮化合物提供了重要的参考依据。
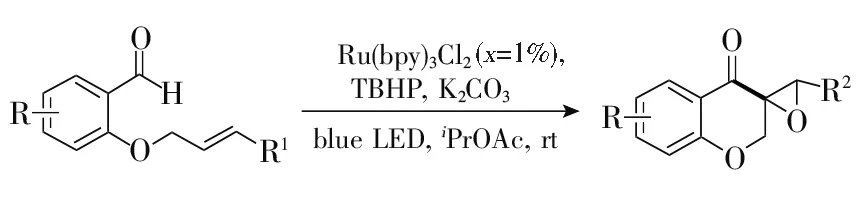
图3 光催化合成螺环氧基苯并吡喃酮化合物
朱刚国等[27]研究了可见光催化邻烯丙氧基芳甲醛和α-溴羰基化合物进行自由基串联环化反应(图4a)。该法同样以三联吡啶氯化钌六水合物(Ru(bpy)3Cl2)为催化剂,合成了一系列环酮化合物,包括茚满酮、环戊烯酮、3,4-二氢萘-1(2H)-酮和苯并吡喃-4-酮等,最高收率达85%。但是该法对亚甲基溴化合物和2-溴丙二腈等底物没有催化效果。此外,该法仅仅局限于缺电子的α-溴羰基化合物的反应,应用范围有限。

图4 光催化合成苯并二氢吡喃-4-酮
2019年,Sarkar等[28]探究了邻烯丙氧基芳甲醛和N-(酰氧基)邻苯二甲酰亚胺的自由基串联环化反应(图4b),发现在N,N-二异丙基乙胺作用下,曙红Y(Eosin Y)的催化效果优于玫瑰红、荧光素、Ru(bpy)3Cl2等光敏催化剂,收率最高为77%。但是该法对有位阻的N-(酰氧基)邻苯二甲酰亚胺催化效果较差。2019年,Hong等[29]再次报道了可见光诱导吡啶鎓盐与醛类化合物进行选择性C—H酰化的策略。在对反应底物进行拓展研究时发现,该法对邻烯丙氧基芳甲醛与吡啶鎓盐的C—H酰化反应同样有较好的催化效果,合成了多种含吡啶结构的苯并二氢吡喃-4-酮化合物(图4c),收率在48%~57%。
宣俊等[30]采用可见光催化酰氯与邻烯丙氧基芳甲醛合成了1,4-二酮苯并二氢吡喃-4-酮化合物(图4d)。该法反应条件温和,在LED灯和太阳光下均有较好的催化效果,能够适用于多种芳酰氯和杂环酰氯与邻烯丙氧基芳甲醛的反应。但是对芳环上有极缺电子的硝基、氰基等基团的芳酰氯,则没有催化活性,反应无法进行。周能能等[31]在研究乙酰化反应合成二氟乙酰化的苯并二氢吡喃-4-酮化合物时发现,三(2-苯基吡啶)合铱(fac-Ir(ppy)3)相比于三(2,2′-联吡啶)钌二(六氟磷酸)盐(Ru(bpy)3(PF6)2)、Eosin Y等光敏催化剂有更好的催化效果(图4e)。该法对芳环上有供电子取代的邻烯丙氧基芳甲醛底物催化效果较好,但是对芳环上有硝基这类缺电子基团的邻烯丙氧基芳甲醛底物同样没有催化效果。
2020年,黄宏丽等[32]在fac-Ir(ppy)3条件下邻烯丙氧基芳甲醛和α-溴羰基化合物进行自由基串联环化反应,合成了一系列C3-烷基化的苯并二氢吡喃-4-酮化合物(图4f)。该法底物适用范围较广,对芳环上有卤素原子、甲基、叔丁基、甲氧基等基团的邻烯丙氧基芳甲醛底物有较好的催化效果,同时也适用于芳环上有硝基这类缺电子邻烯丙氧基芳甲醛底物,最高收率可达91%。利用该方法还能合成二氢喹啉-4-酮化合物以及2,3-二氢萘-4(1H)-酮类化合物。
光催化是合成苯并二氢吡喃-4-酮化合物的有效途径,反应条件较为温和。然而,传统的钌、铱等光敏催化剂较为昂贵,有待进一步发展廉价且高效的光敏催化剂。
4 无金属催化
相较于过渡金属催化反应条件而言,无金属催化的反应因其经济性好、无金属残留、绿色环保等特点而备受青睐。
Lee等[33]探索了叔丁基过氧化氢(TBHP)促进邻烯丙氧基芳甲醛的分子内自由基环化反应(图5),发现叔丁基过氧化氢的反应效果优于二叔丁基过氧化物、过氧化苯甲酸叔丁酯、过氧化二苯甲酰、过氧化二异丙苯氧化剂。该法官能团兼容性较强,对芳环上有卤素原子、甲氧基、叔丁基以及双取代基团的邻烯丙氧基芳甲醛底物均有较好的效果。
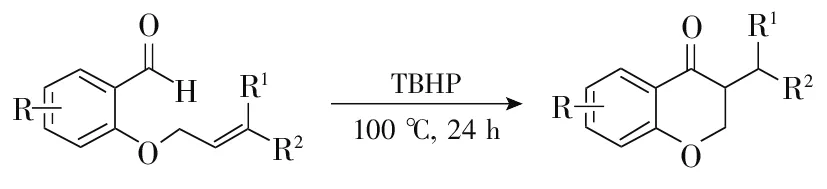
图5 过氧化物条件下合成苯并二氢吡喃-4-酮
唐林等[34]研究了无金属催化条件下三氟甲基亚磺酸钠盐与邻烯丙氧基芳甲醛的反应,合成了一系列三氟甲基化的苯并二氢吡喃-4-酮化合物(图6a)。该法能够合成多种三氟甲基化的苯并二氢吡喃-4-酮化合物,但是收率较低,最高收率为68%,在某种程度上应用有限。
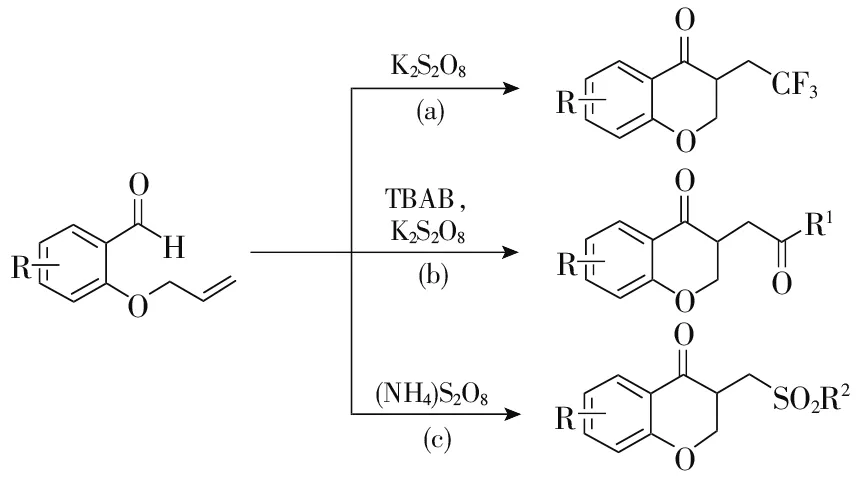
图6 过硫化物条件下合成苯并二氢吡喃-4-酮
2019年,肖咏梅等[35]报道了在四丁基溴化铵(TBAB)和过硫酸钾的共同作用下,醛类化合物与邻烯丙氧基芳甲醛合成苯并二氢吡喃-4-酮化合物的研究成果(图6b)。该法适用于脂肪族、芳香族的醛与邻烯丙氧基芳甲醛的反应,对芳环上有甲基、卤素原子、叔丁基取代的邻烯丙氧基芳甲醛底物也有较好的反应效果,最高收率达80%。但是当甲醛与邻烯丙氧基苯甲醛反应时,反应无法进行。王磊等[36]在过二硫酸铵的作用下,以亚磺酸与邻烯丙氧基芳甲醛为原料合成磺酰化的苯并二氢吡喃-4-酮化合物(图6c)。脂肪族亚磺酸、芳香族亚磺酸与邻烯丙氧基芳甲醛的反应均有较好的效果,最高收率达91%。但是当底物是邻烯丙氮基芳甲醛、邻烯丙硫基芳甲醛时,反应则无法进行。
5 展 望
苯并二氢吡喃-4-酮广泛存在于天然产物分子和药物分子中,且具有优良的生物活性。近年来先后报道了氮杂环卡宾催化、金属催化、光催化及无金属催化邻烯丙氧基苯甲醛合成苯并二氢吡喃-4-酮化合物的研究成果。这些方法适用范围广,官能团兼容性强,收率较高,为后续合成其他苯并二氢吡喃-4-酮化合物提供了参考。但是这些方法存在试剂昂贵、制备工艺复杂等问题,仍需进一步探索更加经济、绿色、环保的反应体系,以满足未来苯并二氢吡喃-4-酮化合物的结构修饰和新药研发的发展需求。

