CDGSH铁硫簇结构域1的生物学功能及其在相关疾病中的作用研究进展
尚画雨 付玉 马穰桂 夏志
1 成都体育学院运动医学与健康学院(四川成都610041)
2 温州大学体育与健康学院(浙江温州325035)
3 井冈山大学体育学院(江西吉安343009)
线粒体对细胞能量稳态的维持具有关键作用,其功能障碍被视为多种疾病的主要发病机制之一[1-4]。其中,全球发病率激增的衰老相关疾病似乎有着共同的线粒体关联[5],例如帕金森病(Parkinson’s disease,PD)[1]等神经退行性疾病,可因线粒体产生的过多活性氧(reactive oxygen species,ROS)及继发氧化应激而进一步介导细胞死亡途径,最终导致组织或器官受损。而代谢性疾病如2 型糖尿病(type Ⅱ diabetes mellitus,T2DM)亦呈现出与其高度相关的生物能量代谢异常变化[2]。就学界关注的心血管疾病如动脉粥样硬化(atherosclerosis)而言[3],线粒体途径靶向作用研究逐渐成为防治细胞损伤或死亡的有效策略;而鉴于高增殖癌细胞比正常体细胞表现出更高的代谢需求,线粒体亦被视为癌症药物开发的重要作用靶点[4]。然而,由于细胞环境与线粒体功能互作影响的复杂性,线粒体在不同疾病中的作用及机制迄今尚未厘清。
近些年研究发现,CDGSH 铁硫簇结构域1(CDGSH iron sulfur domain 1, CISD1/mitoNEET,mitoNEET)作为一种新兴的噻唑烷二酮类药物(thia⁃zolidinediones,TZDs)线粒体靶点,在调节细胞凋亡[6]、线粒体氧化能力[7]及自噬[8]方面具有重要作用,从而可能影响多种组织器官(如脂肪和肝脏)的铁稳态、脂质代谢和炎症反应[3,9-11]。例如,mitoNEET 可通过与电压依赖性阴离子通道1(voltage-dependent anion chan⁃nel 1,VDAC1)互作,诱发抗凋亡效应[6];并可通过降低线粒体膜电位并与E3泛素连接酶Parkin(PARK2)相结合,促进Parkin介导线粒体自噬[8]。鉴于细胞凋亡与自噬机制在运动模型中的研究[12],推测mitoNEET 可能通过与VDAC1、Parkin互作而参与调节运动干预下的凋亡及自噬过程。因此,本研究应用计算机检索Web of Science 和Pubmed 数据库及中国期刊全文数据库2001年1月至2021年2月刊发的mitoNEET 相关文献(中文检索词为“CDGSH 铁硫簇结构域1”,英文检索词为“CISD1,mitoNEET”),梳理并归纳mitoNEET 的生物学功能及其与相关疾病的关系,以期为靶向mitoNEET的药物和/或运动干预手段的开发和应用提供有益参考。
1 mitoNEET概述
线粒体外膜(outer mitochondrial membrane,OMM)蛋白mitoNEET 最初是作为T2DM 治疗药物吡格列酮(Pioglitazone,PGZ)的靶标而被发现,因其来源于线粒体(mitochondrion)且组分中含有独特的“NEET”(Asn-Glu-Glu-Thr)氨基酸序列而被命名为mitoNEET[13]。除mitoNEET 之外,NEET 蛋白家族还包括CISD2(Miner1/NAF-1)和CISD3(Miner2),三者共享CDGSH结构域,且该结构域包含该家族的[Fe-S]铁硫簇特征[14]。对NEET家族的功能研究表明,其三者均参与了簇转移或电子转移[5]。mitoNEET 亦为锌指蛋白家族成员,其并不含锌离子,而是一个含有定位于胞浆的[2Fe-2S]铁硫结合域的二聚体,参与线粒体内外铁硫簇转运[15]。Fe 和S 原子电子离域的能力使铁硫结合域具有执行其介导电子转移的起始功能,因而铁硫中心成为光合作用和电子传递链(electron transport chain,ETC)上的主要组成部分以及移动电子载体铁氧还蛋白的氧化还原活性中心。
基于此,Ferecatu 等[16]指出,mitoNEET 为哺乳动物细胞内首个被发现参与胞浆铁硫蛋白[如铁调节蛋白1(iron regulatory protein 1,IRP1)]修复的线粒体蛋白,可通过引起铁硫簇向胞浆apo-IRP1 蛋白的释放和转移,而促进胞浆内氧化应激损伤的IRP1 修复,但目前仍需进一步研究探明此转移过程的生理功能。近期报道表明,mitoNEET 可能作为线粒体氧化还原反应[17]和/或胞浆pH[18]的感应器而参与调节细胞适应性反应,从而帮助应激敏感性铁硫蛋白从氧化应激损伤中恢复[19],这对于防治诸如癌症和其他相关疾病等细胞内呈现pH失稳态或氧化应激损伤的病症具有重要意义。
2 mitoNEET的生物学功能
2.1 参与调节线粒体功能障碍及自噬
研究证实,mitoNEET 作为机体能量代谢所必需的组分,是调节线粒体功能的关键膜蛋白[7]。Wiley 等[20]报道指出,mitoNEET基因敲除(mitoNEETknock-out,mitoNEETKO)小鼠虽未表现出明显的性状异常,但在提取分离其心肌线粒体后发现呼吸功能解耦联,其中态3呼吸约减少30%,整体呈现出氧化磷酸化和电子传递过程的明显受损。Habener 等[21]离体实验结果显示,利用siRNA 干扰mitoNEET 表达后低氧/复氧模型小鼠心肌细胞凋亡显著增加达1.9 倍,而mitoNEET 过表达则导致细胞凋亡率下调53%,提示mitoNEET 对抑制氧化应激所致的细胞凋亡具有重要作用。Vernay 等[22]和Furihata[23]等近期进一步研究表明,细胞中缺乏mi⁃toNEET 将导致细胞内线粒体总量和嵴密度减少,细胞呼吸作用减弱,表明mitoNEET参与维持线粒体稳态。
此外,不少研究结果[24-26]亦显示了mitoNEET 配体在调节细胞生物能量代谢中的积极作用。Geldenhuys[24]和Saralkar[25]等报道指出,mitoNEET 配体NL-1(mi⁃toNEET Ligand-1)治疗可保护神经元细胞线粒体ETC复合体Ⅰ免受鱼藤酮的毒性损害以及缺血再灌注后脑微血管内皮细胞免受氧化应激损伤。另一mitoNEET配体TT01001 干预对db/db小鼠高血糖症、高脂血症和糖耐量受损以及骨骼肌线粒体ETC复合体Ⅱ和Ⅲ活性均具有明显改善作用[26]。以上研究结果提示,mi⁃toNEET 在维持线粒体能量代谢功能中具有关键作用。未来旨在探索mitoNEET 配体作用的研究对于防治PD、糖尿病(diabetes mellitus,DM)等线粒体功能障碍相关疾病可能具有重要意义。
Lipper等[6]近期的报道指出,mitoNEET在细胞内以氧化还原依赖的方式调节OMM蛋白VDAC1,后者能在膜上形成亲水性通道,调控阴、阳离子和三磷酸腺苷(adenosine triphosphate,ATP)及其它代谢物(如Cyt C)进出线粒体。该研究发现,被氧化的mitoNEET可与VDAC1 互作,介导线粒体通透性转换孔的闭合,使得Cyt C 等VDACs 代谢物的流动受限从而抑制细胞凋亡。此外,Purnell 等[27]在人神经母细胞瘤细胞(SHSY5Y)中利用mitoNEET 标记线粒体则观察到线粒体自噬现象。Kusminski 等[8]近期研究发现,mitoNEET 亦可能作为Parkin 泛素化作用底物而参与Parkin 途径介导线粒体自噬过程,从而对细胞存活发挥关键作用,但具体机制仍有待后续研究予以确认。
Yokokawa 等[28]报道小鼠在4 周转轮运动后跖肌和附睾白色脂肪组织(white adipose tissue,WAT)中的mitoNEET 和线粒体ETC复合体Ⅰ-Ⅳ的亚基蛋白表达均显著上调,且mitoNEET 表达与5 个ETC 复合体亚基之间呈显著正相关,提示耐力运动诱导的跖肌和附睾WAT中线粒体生物发生与mitoNEET协同表达,这可能是维持线粒体完整性的关键所在。在后续的研究过程中,还需考虑采用siRNA干扰和/或敲除mitoNEET基因探明其是否调控运动诱导的线粒体生物发生,并通过大规模随机试验对肥胖/胰岛素抵抗(insulin resis⁃tance,IR)被试实施标准化运动干预,从线粒体质量控制(生物发生、自噬、融合/分裂)角度探究可能的影响机制。
2.2 参与调节脂代谢和胰岛素敏感性
mitoNEET 蛋白在脂肪等胰岛素(insulin,INS)敏感组织中广泛存在,其表达在前体脂肪细胞内处于较低水平,而在分化成熟的脂肪细胞内则显著增加[29]。Kusminski 团队[30]观察到mitoNEET 过表达的ob/ob小鼠呈现脂肪良性形成而致体重明显增加,ROS 生成显著减少,但胰岛素敏感性(insulin sensitivity,ISI)无明显变化;相反,肥胖小鼠mitoNEETKO后,ISI显著下调而线粒体ROS水平上调,提示mitoNEET可能在调节细胞能量利用、脂代谢以及ISI 方面具有关键作用。Kus⁃minski 等[30]指出,铁是ETC 活性的限速成分,mitoNEET作为铁硫簇转移蛋白可通过抑制线粒体将铁转运到胞浆进而减弱呼吸作用和脂肪酸氧化,从而引起脂肪组织扩张。Roberts 等[31]分析,mitoNEET 可能是通过与调节INS的关键酶GDH1互作,进而在INS调控中发挥重要作用,但其具体作用机制目前仍不清楚。
另外,Pihan-Le 等[32]报道指出,肥胖可能与皮下脂肪(subcutaneous adipose tissue,SAT)和内脏脂肪组织(visceral adipose tissue,VAT)内铁超载有关。Moreno-Navarrete 等[9]后续研究表明,肥胖患者SAT 和VAT中mitoNEET 的mRNA和蛋白表达均显著降低,且与患者BMI 水平、铁聚集和氧化损伤相关基因(FTL、CYBA)呈明显负相关,与线粒体生物合成基因(PPARGC1A、TFAM、MT-CO3)、脂肪棕色化基因(PRDM16、UCP1)和铁稳态相关基因(TF,ACO1,IS⁃CA2)表达呈显著正相关;此外,他们还发现,在SAT 和VAT 分化过程中mitoNEET基因表达均明显上调且与成脂基因(ADIPOQ、FASN、ACO1)水平呈显著正相关。总之,脂肪组织中mitoNEET基因表达与脂肪生成、WAT 棕色化以及铁稳态基因标志物的表达显著正相关,由此说明mitoNEET 参与介导WAT 棕色化和正性调节铁稳态。未来可进一步开展脂肪组织功能的离体研究,以明确mitoNEET在人体脂肪生成中的作用机理以及脂肪组织中铁硫蛋白与mitoNEET之间的关系。
最近Segrestin 等[33]还发现,健康成年男性经8周过量饮食摄入引起体重适度增长伴SAT 增加,但并未导致肥胖,这与血清铁蛋白(ferritin,FT)表达明显下调有关;而被试SAT 中脂质储存相关基因(mitoNEET、SCD、DGAT2、SREBF1)表达上调,其中mitoNEET上调与铁聚集基因FTL表达下调呈负线性相关,这与More⁃no-Navarrete 等[9]报道的结果一致,表明SAT 中铁代谢与脂质储存基因(如mitoNEET)之间存在密切联系,但仍有待进一步研究确认。
3 mitoNEET在相关疾病中的作用
3.1 T2DM
T2DM 治疗药物TZDs 是一类INS 增敏剂,其通过与胞核中的过氧化物酶体增殖物激活受体γ(peroxi⁃some proliferators-activated receptor γ,PPARγ)结合,激活下游基因转录,从而改善IR、高血糖、高胰岛素血症以及脂质代谢紊乱等病理改变,其代表性药物为PGZ 和罗格列酮(rosiglitazone,RGZ)[34]。然而,PGZ 和RGZ 易诱发水肿、体重增加、骨质疏松、低血压等一些不良反应,阻碍了其在临床中的广泛应用,而引起上述副作用的原因则在于其对体内PPARγ完全而又强烈的激活作用[34]。近些年来,学者们研发了一些不与PPARã 结合的新型TZDs,例 如MSDC-0160(PNU-91325)和MSDC-0602,旨在通过与mitoNEET和线粒体丙酮酸转运载体(mitochondrial pyruvate carrier,MPC/mTOT)两个线粒体靶点互作而发挥作用[29]。
一方面,Bolten 等[35]观察到MSDC-0160 与mi⁃toNEET及线粒体的结合方式与PGZ、RGZ相似,每日口服给药MSDC-0160 可引起mitoNEET基因和PPARγ辅激活因子1α(PPARγ coactivator-1α,PGC-1α)蛋白表达明显上调,故推测mitoNEET可能参与调节线粒体生物能量代谢的信号通路变化。Colca 等[36]还发现,为期12周MSDC-0160治疗的降血糖效果与PGZ相同,且水肿发生率较PGZ 降低达50%。另一个临床候选药物MSDC-0602也得到了类似结果:其在增强ISI方面的积极作用与MSDC-0160相同,而肝内糖异生和脂肪生成几率更低,且PPARγ-/-基因修饰的小鼠亦呈现出相同的代谢特点,表明MSDC-0602作用效应与PPARγ无关,因而选择该药物治疗T2DM将有助于降低PPARγ介导的副作用[37]。由此可见,TZDs(包括PGZ和RGZ在内)的药效在一定程度上归因于其与mitoNEET的互作。
另一方面,MSDC-0160、MSDC-0602 和PGZ 被证明均可与位于线粒体内膜(inner mitochondrial mem⁃brane,IMM)上的转运蛋白MPC 组分互作,促进小鼠棕色脂肪(brown adipose tissue,BAT)形成并增强ISI,而MPC基因缺失则将导致BAT 形成明显受阻[38,39]。鉴于糖酵解生成的丙酮酸由MPC跨过IMM运输并最终被氧化生成ATP,以维持糖异生和脂肪生成过程,因此特异性靶向MPC 对于治疗DM 可能具有巨大潜力。上述研究将选择性PPARγ调节剂理论引入了DM治疗药物设计中,有利于避免TZDs 由于完全激动PPARγ而带来的副作用,为TZDs广泛的临床引用开启了新的篇章。在未来的研究中,还应对所合成的衍生物进行DM-PPARγ模型的活性比较及相关副作用的评价,以期开发出理想的选择性PPARγ调节剂。
3.2 脂肪肝
Hu 等[10]利用mitoNEETKO 小鼠建立实验性脂肪肝(steatohepatitis)模型并发现:mitoNEETKO 对照小鼠呈现出肝脂肪变性减少,但其炎性损伤加重,然而脂肪肝成模的mitoNEETKO 小鼠血清脂联素和回肠成纤维细胞生长因子15(fibroblast growth factor 15,Fgf15)表达均显著升高,二者协同作用进而下调肝内氧化应激和核因子-κB 信号转导,致使肝脂肪和ROS含量显著减少,从而有效减轻脂肪肝小鼠炎性损伤。上述研究结果表明,脂联素和Fgf15 作为关键的脂肪-肠-肝代谢协调物参与介导mitoNEET缺失对脂肪肝的保护作用,提示药理性抑制mitoNEET可能有助于防治脂肪肝。
3.3 癌症
近些年大量研究结果表明,多种癌症的发生发展均伴随着mitoNEET基因突变和/或蛋白表达变化,而mitoNEET 蛋白参与维持癌细胞存活、促进癌细胞增殖和转移[40-47]。Salem 等[40]最初在乳腺癌(breast cancer,BCa)细胞中观察到mitoNEET 过表达可上调线粒体ETC复合物活性,并抑制饥饿诱导的细胞自噬,促进肿瘤生长。与Salem 等[40]过表达mitoNEET 的研究策略相反,Sohn等[41]在BCa细胞中抑制mitoNEET表达,并观察到线粒体铁超载和ROS 大量生成进而激活细胞自噬,明显阻止肿瘤生长。尽管尚未明确mitoNEET 与癌细胞过度增殖之间的具体联系,但Salem[40]和Sohn[41]等一致认为mitoNEET 及其密切相关的线粒体ETC 复合体可能在BCa 细胞增殖和转移过程中起着重要作用,但其作用机制目前尚未厘清。
Ge 研究组[42]主要关注前列腺癌(prostate cancer,PCa)早期诊断指标前列腺特异性抗原(prostate-specif⁃ic antigen,PSA),他们在mitoNEET基因的DNA 调控区确认了调控血清PSA 水平的单核苷酸多态性,提示mitoNEET基因参与了PCa 的发生发展,但其具体关联仍不清楚。Dongsoo 等[43,44]和Meram 等[45]分别报道了1例口腔腺样囊性癌(adenoid cystic carcinoma,ACC)、1 例黏液表皮样癌(mucoepidermoid carcinoma,MEC)和15 例鳞状细胞癌(oral squamous cell carcinoma,OSCC)病例,与肿瘤术中切除的良性癌旁组织相比,三类口腔恶性肿瘤中mitoNEET蛋白表达均明显增加,他们推测这一变化降低了线粒体铁浓度,因而肿瘤相关的线粒体改变可能继发于mitoNEET 表达上调及其它影响因素。Yuan 等[46]为探讨铁死亡在肝细胞癌(hepa⁃tocellular carcinoma,HCC)中的作用,选取铁死亡诱导剂爱拉斯汀处理人HCC 细胞,结果显示爱拉斯汀可诱导mitoNEET 呈现铁依赖性的表达上调;而使用siRNA干扰mitoNEET表达后,HCC细胞内铁介导的线粒体脂质过氧化(lipid peroxidation,LP)反应增强,加剧爱拉斯汀诱导的铁死亡;相反,施加mitoNEET 的铁硫簇稳定剂PGZ 处理则有效抑制HCC 细胞内线粒体铁吸收、LP 和铁死亡。上述结果表明mitoNEET 缺失会引起线粒体铁超载,进而铁离子介导芬顿反应并由LP诱导铁死亡,mitoNEET 可通过减少线粒体铁聚集以预防线粒体受损,从而对铁死亡诱导HCC 发挥负性调节作用。Chen等[47]还发现,对A375恶性黑色素瘤(melanoma)细胞施加异甘草素(isoliquiritigenin,ISL)处理可明显下调癌细胞mitoNEET 蛋白表达和线粒体膜电位并上调ROS 水平和细胞凋亡率,而A375 癌细胞mitoNEET 过表达则可有效逆转上述反应,提示ISL 诱导A375 癌细胞凋亡和线粒体功能障碍是通过抑制mitoNEET 表达而实现,同时亦再次表明mitoNEET是癌症治疗的线粒体潜在靶点。
3.4 神经退行性疾病
如前所述,mitoNEET 参与维持线粒体稳态,而纹状体多巴胺的丢失与线粒体功能障碍有关,后者进而参与介导PD 发生发展[48]。Geldenhuys 等的研究[1]进一步证实了这一观点,他们观察到mitoNEETKO 小鼠呈现出的ROS 增多、纹状体多巴胺和酪氨酸羟化酶阳性表达进行性下降以及行为缺陷均与纹状体线粒体完整性丧失有关,且纹状体内出现铁异常聚集,推测可能是mitoNEETKO引起ROS和超氧化物大量生成导致线粒体功能障碍,从而致使6月龄小鼠表现出诸多早期PD相关神经退行性变(neurodegeneration)。因此,mi⁃toNEET可能是治疗神经退行性疾病的关键潜在靶点。
3.5 动脉粥样硬化
有研究发现,炎性刺激可通过诱导mitoNEET 活化而引起凋亡等信号的应答[2,10,49]。近年Xiong 等[2]指出,与其它主动脉层和WAT相比,mitoNEET优先在BAT和血管周围脂肪组织(perivascular adipose tissue,PVAT)表达,且PVAT 的产热、代谢能力等生理功能与mitoNEET 密切相关;PVAT 中mitoNEET 过表达可增强PVAT功能并减轻局部炎症,抑制动脉粥样硬化病变形成。此外,Chang 等[49]亦发现老年小鼠缺乏PVAT 会导致动脉硬度明显增加,而老年小鼠饲喂高脂膳食可显著诱导PVAT 肥大和mitoNEET 蛋白表达下调,同样引起动脉硬度增加;然而通过给予PGZ治疗显著上调mi⁃toNEET 表达和/或PVAT 内mitoNEET 过表达均能明显下调炎症基因表达,有效改善动脉硬度,表明mi⁃toNEET 可能通过参与维持和/或增强PVAT 的正常生理功能以及炎症稳态而防治动脉粥样硬化。因此,深入研究mitoNEET 在炎症中的调控机制对于延缓衰老进程、防治衰老相关疾病可能具有重要意义。
综上所述,可归纳OMM 蛋白mitoNEET 的生物学功能如图1所示。
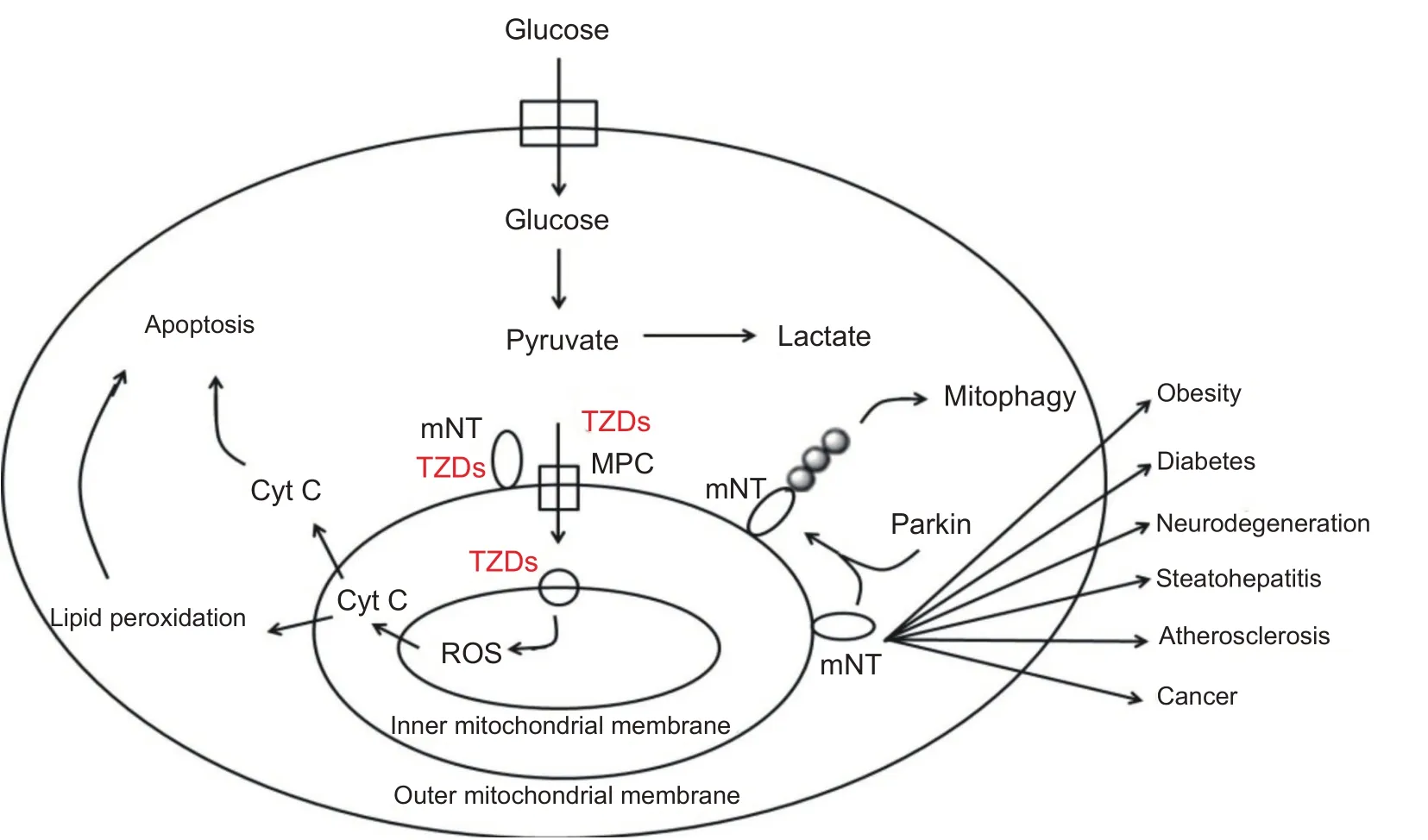
图1 线粒体外膜蛋白mitoNEET的生物学功能
4 结语
作为一种多功能蛋白,mitoNEET 在多种信号通路中均不可或缺。其不仅具有抗凋亡活性,且参与介导线粒体自噬和WAT棕色化的发生,并作为PGZ的靶标而发挥抗IR、炎症和肿瘤侵袭的功能,在正性调节铁稳态过程中亦有重要贡献。但是,目前学界对于该蛋白的研究仍有待继续深入,后续应考虑在体内或体外不同应激状态下,或在肥胖、肿瘤等不同模型中,深入探究mitoNEET 与TZDs 药物结合、与其它相关通路以及调节因子的相互作用,以期探明mitoNEET在调节凋亡信号、成脂基因和线粒体自噬等过程中的不同作用究竟如何整合至协调反应之中。尽管mitoNEET 发挥上述功能的分子机制尚有待未来研究进一步阐明,但这一特殊的NEET家族蛋白可能成为药物和/或运动干预等诸多独立生物进程中的共同靶点。

