三重四极杆液质联用技术建立检测血清中胰岛素样生长因子1的定量方法研究
河春姬 申利
1 北京体育大学(北京100084)
2 国家体育总局反兴奋剂中心(北京100029)
生长激素(growth hormone,GH)和胰岛素样生长因子1(insulin-like growth factor 1,IGF-Ⅰ)因具有蛋白同化作用,被列入世界反兴奋剂机构(World Anti-Doping Agency,WADA)禁用清单[1]。WADA颁布的体育项目特殊检测技术文件(technical document for sport specific analysis,TDSSA)[2]明确了GH 将作为运动员生物护照(athlete biological passport ,ABP)内分泌模块的检测项目,IGF-Ⅰ作为GH 检测的一个重要间接指标,成为ABP 内分泌模块的检测指标之一被长期监测。目前对IGF-Ⅰ的检测,普遍采用WADA实验室生长激素间接法指南(laboratory guidelines human growth hormone(hGH)biomarkers test,GH Biomark⁃ers)[3]指定的酶免化学发光自动检测平台系统。但由于检测过程自动化和商品化程度较高,一旦国际标准物质发生更迭,而生产厂家不能及时推出替换产品,原有检测系统将无法继续使用,既易造成巨大浪费,又影响该项目兴奋剂检测的持续开展。
质谱方法检测因其指纹式识别特性一直是反兴奋剂研究中的重要检测手段。指纹式识别,即将待测样品与已知标准品的特征离子(对)质荷比进行对照来确认样品中是否存在该物质。近些年来随着仪器检测技术的不断革新,质谱法检测肽类物质的研究和应用也不断增多。由于质谱方法可用于多种物质的检测,降低单个物质的检测成本,同时检测方案更加灵活,检测结果稳定可靠,更适合作为兴奋剂常规检测方法进行开发和应用,其中三重四极杆液质联用( liquid chro⁃matography triple-quadrupole mass spectrometry,LCQQQ)技术是目前广泛采用的定量检测生物大分子的技术之一。
兴奋剂IGF-Ⅰ的质谱检测方法国内尚无报道。国际兴奋剂检测领域对于IGF-Ⅰ的LC-QQQ方法研究一般采用自下而上的策略[4-8],即对水解后的IGF-Ⅰ特征片段进行质谱定量分析。该策略的前提是假设对蛋白酶水解产生的肽段的浓度计量能够迁移并代表水解前的完整IGF-Ⅰ。这一策略解决了当时由于质谱检测水平所限,而无法直接对大分子蛋白进行质谱检测的困难,基于这一策略的IGF-Ⅰ质谱检测方法于2015年被WADA 正式认可。但是此方法水解过程耗时,一般在十几个小时,同时水解过程产生大量片段,对于水解效率的监控和信号肽段的选择以及肽段的纯化等都影响定量结果的准确性。随着样品制备和质谱检测水平的发展,通过增加大分子蛋白质带电荷数来减小其质荷比的方式,使对全链蛋白进行直接检测成为可能。近年来兴奋剂检测领域开始更多地关注自上而下的策略并开发相应的检测方法[9-10]。自上而下的策略,即对全链IGF-Ⅰ进行质谱定量分析,直接对目标蛋白进行提取、纯化和分析,步骤更简化,使其结果可能产生更小的偏差。与自下而上的策略相比,自上而下的策略在检测方法简便性和结果准确性等方面更具优势。本研究采用自上而下的策略,使用LC-QQQ 技术建立检测运动员血清全链IGF-Ⅰ的检测方法,并根据WADA GH Biomarkers指导文件要求,充分利用实验室现有仪器设备,完成了LC-QQQ 检测血清IGF-Ⅰ方法的建立及验证工作。定量限(limit of quantification,LOQ)、重复性(repeatability,Sr)、中间精密度(intermediate preci⁃sion,Sw)、线性范围、携带污染和稳定性等指标均达到兴奋剂检测要求,可用于常规兴奋剂检测。
1 实验部分
1.1 仪器设备
美国安捷伦公司LC1290 液相分析仪连接ABI 公司QTRAP® 5500 质谱仪,ESI 接口;台式高速制冷离心机为美国Sigma公司生产;涡旋混匀器为美国Vortex公司生产;恒温自动氮气吹干仪(Techne)为国产设备。
1.2 试剂与耗材
色谱柱采用美国Waters 公司生产ACQUITY UPLC Peptide BEH C18 Column,300Å,1.7 μm,2.1 mm × 100 mm;色谱保护预柱为美国Waters 公司生产ACQUITY UPLC Peptide BEH C18 VanGuard Pre-column,300Å,1.7 μm,2.1 mm × 5 mm;在线过滤器、低吸附进样瓶套管为美国安捷伦公司生产。
大鼠血清购自南京生航生物技术有限公司;色谱纯级甲酸、乙酸、甲醇、乙腈等化学试剂购自DIKMA公司;BSA 购自Sigma 公司。血清IGF-Ⅰ外部质控样品由WADA提供。
标准物质IGF-Ⅰ(02/254)为重组的人源IGF-Ⅰ,购自NIBSC实验室;15N稳定同位素标记的IGF-Ⅰ(15NIGF-Ⅰ)和胰岛素样生长因子2(insulin-like growth factor 2,IGF-Ⅱ)为重组的人源标准物质,购自ProSpec公司。标准物质信息见表1。
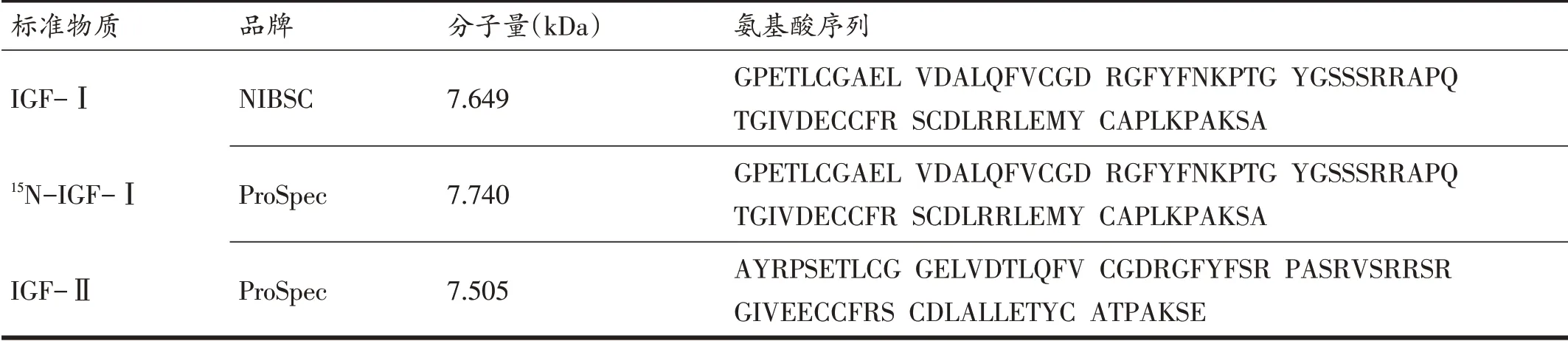
表1 标准物质信息
1.3 试剂制备
10 mM 乙酸水溶液:乙酸6 μL 加纯水10 mL(室温保存1个月)。
10 ng/μL IGF-Ⅰ溶液:IGF-Ⅰ(02/254)标准物质8.5 μg加10 mM乙酸850 μL(分装后-80℃保存)。
100 ng/μL15N-IGF-Ⅰ母液:15N-IGF-Ⅰ标准物质25 μg加纯水250 μL(分装后-80℃保存)。
5 ng/μL15N-IGF-Ⅰ工作液:100 ng/μL15N-IGF-Ⅰ母液5 μL加纯水95 μL(分装后-80℃保存)。
40 ng/μL IGF-Ⅱ工作液:IGF-Ⅱ标准物质50 μg加纯水1250 μL(分装后-80℃保存)。
1%乙酸水溶液:乙酸200 μL加纯水19.8 mL。
2%甲酸水溶液:甲酸200 μL加纯水9.8 mL。
1.4 实验方法
1.4.1 样品前处理
在大鼠血清基质中添加10 ng/μL IGF-Ⅰ溶液配制浓度为50 ng/mL、100 ng/mL、200 ng/mL、400 ng/mL、800 ng/mL、1200 ng/mL 的系列标准曲线工作液和浓度为50 ng/mL、200 ng/mL、500 ng/mL 的质控样品。在1.5 mL 离心管中加入100 μL 标准曲线工作液、质控样品、待测样品,加入5 ng/μL15N-IGF-Ⅰ和40 ng/μL IGF-Ⅱ标准品溶液,使其终浓度分别为200 ng/mL 和2000 ng/mL。加入200 μL 浓度为1%的乙酸溶液,涡旋振荡30秒钟,充分混匀。加入400 μL乙腈,振荡器室温下振荡,转速900 rpm,振荡15 分钟,使用高速离心机,14000 g,离心10 分钟。将上清液取出600 μL转移至1.5 mL低吸附离心管中,40℃下氮气吹干。加入50 μL2%甲酸溶液复溶,振荡器室温下振荡,转速900 rpm,振荡1 分钟,充分混匀。使用低吸附移液器吸头将离心管中的溶液全部转移至低吸附进样瓶套管中,拧紧瓶盖。将进样瓶排放在液相质谱联用仪自动进样盘上,在工作站编辑样品信息后进行样品检测。
1.4.2 色谱条件
使用ACQUITY UPLC Peptide BEH C18(300Å,1.7 μm,2.1 mm ×100 mm)色谱柱,前端接ACQUI⁃TY UPLC Peptide BEH C18 VanGuard Pre-column(300Å,1.7 μm,2.1 mm × 5 mm,1K - 30K)色谱保护预柱,并安装安捷伦在线过滤器,柱温45℃,流动相A 为0.1% 甲酸水溶液,流动相B 为0.1% 甲酸乙腈溶液,梯度洗脱程序共9分钟,初始比例为流动相A∶B体积比为90∶10,到5 分钟时为55∶45,6 分钟时为0∶100,保持到8 分钟,之后立即恢复为90∶10,直到9分钟结束程序。进样体积5 μL,流速0.3 mL/min。
1.4.3 质谱条件
扫描方式采用多反应监控模式(multiple reaction monitoring,MRM),离子模式为电喷雾正离子源ESI+,离子喷雾电压为5500 V,离子源温度550℃。IGF-Ⅰ和15N 标记的IGF-Ⅰ(15N-IGF-Ⅰ)定量离子对的质谱条件见表2。
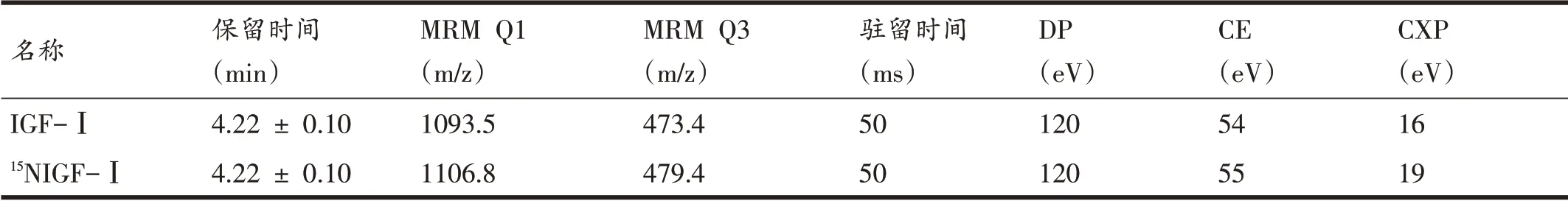
表2 质谱条件
1.4.4 方法验证
应用1.4.1、1.4.2、1.4.3 的方法配制标准曲线和质控样品,依据WADA 对检测方法验证的相关要求对该方法的Sr、Sw、LOQ、线性范围、携带污染和稳定性进行验证。对同一操作人员同一天内配制的质控样品进行6次检测,其相对标准偏差为Sr。对一周内两个不同操作者分别配制的质控样品各进行6 次检测,其相对标准偏差为Sw。以能够满足Sr 和Sw 要求的最低浓度作为LOQ。以大鼠血清提取液作为空白,在1200 ng/mL浓度样品后进行空白样品的检测,重复12 次,以空白样品与1200 ng/mL 浓度样品中目标离子对在相同保留时间处峰面积百分比作为携带污染率。将一年内质控样品数据绘制成质控图,以平均值± 3 倍标准差作为可控范围来监控方法的稳定性。
2 结果与讨论
2.1 质谱条件的选择
根据IGF-Ⅰ的结构特征,选择正离子模式,对IGF-Ⅰ和15N-IGF-Ⅰ标准工作液进行一级质谱扫描。用MRM 模式优化去簇电压(declustering potential,DP)、碰撞能量(collision energy,CE)、碰撞室射出电压(collision cell exit potential,CXP)等参数,对IGF-Ⅰ和15N-IGF-Ⅰ离子对进行优化。其中IGF-Ⅰ带7个正电荷的分子离子峰的质荷比为1093,带8 个正电荷的分子离子峰质荷比为957,在碰撞池碎裂产生的碎片离子质荷比为473,故选择1093→473 和957→473 作为IGF-Ⅰ的定性离子对。在15N-IGF-Ⅰ中只发现带7个正电荷的分子离子峰,质荷比为1107,经碰撞碎裂为质荷 比 为479 和1211的子离子,选择1107→479 和1107→1211作为15N-IGF-Ⅰ的定性离子对。经过对定性离子对的比较,本实验选择分子离子峰质荷比为1093→473 和1107→479 的离子对分别作为IGF-Ⅰ和15N-IGF-Ⅰ的定量离子对(见图1)。
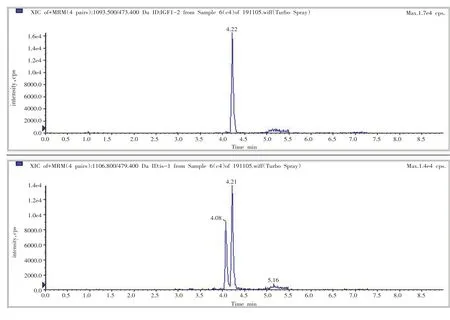
图1 IGF-Ⅰ和15N-IGF-Ⅰ定量离子对MRM图
2.2 色谱条件的选择
本实验比较了几种不同品牌和规格型号的适用于多肽分析的反向C18色谱柱,与2.6 μm×50 mm色谱柱相比,使用2.1 μm×100 mm 的色谱柱进行分离,由于粒径减小、色谱柱长度长,基质干扰减少,IGF-Ⅰ和内标的离子对的色谱峰峰形均得到明显改善。为防止目标物质因管路非特异性结合而损失,在更换新的液相色谱柱时,用乙腈进行活化后,使用含有0.5%大鼠血清的纯水,20 μL进样20针,对液相色谱柱和整个管路系统进行饱和处理。在乙腈/水作为流动相的体系中添加乙酸,可以调节系统pH 值,控制目标物质的保留时间。为了更适合常规批量检测,在保证得到稳定峰形的前提下进行优化,最终将样品检测时间从15分钟缩短至9分钟,节省了检测时间。
2.3 提取条件的选择
IGF-Ⅰ为人体自身分泌的激素,主要通过肝脏释放进入循环血液输送至人体靶组织,因此能够在人血清中检测到IGF-Ⅰ。由于血清中绝大部分IGF-Ⅰ与胰岛素样生长因子结合蛋白(insulin-like growth fac⁃tor-binding protein,IGFBP)和酸不稳定性亚单位(ac⁃id-labile subunit,ALS)结合形成复合物,需在酸性条件下使IGF-Ⅰ游离出来,因此本实验采用加入1% 乙酸的方式游离IGF-Ⅰ。同时IGF-Ⅱ能够与IGF-Ⅰ竞争结合IGFBP,因此加入过量IGF-Ⅱ,能够防止游离的IGF-Ⅰ再次被IGFBP 结合[11]。本研究比较了人血清、羊血清和大鼠血清基质,发现在相同保留时间位置,大鼠血清中未检测到IGF-Ⅰ的定性离子对信号,说明大鼠血清中不含人IGF-Ⅰ,因此选择大鼠血清作为配制标准曲线的基质。
2.4 方法验证
2.4.1 重复性(Sr)
由同一操作人员使用大鼠血清添加10 ng/μL IGF-Ⅰ标准溶液分别配制浓度为50 ng/mL、200 ng/mL、500 ng/mL的质控样品,经前处理采用同一条定量工作曲线,在相同仪器上对样品进行多次检测,计算相对标准偏差。结果显示,对低、中、高三个浓度的样品分别进行6次重复检测得到的相对标准偏差Sr均小于10%,分别为5.0%、2.9%和3.6%,符合WADA技术文件的要求。
2.4.2 中间精密度(Sw)
一周内由两个不同操作者分别使用10 ng/μL IGF-Ⅰ标准溶液添加到大鼠血清中,配制成50 ng/mL、200 ng/mL、500 ng/mL的IGF-Ⅰ工作液各6份,并对每次配制的样品进行检测。计算低、中、高三个浓度样品的相对标准偏差均小于15%,分别为14.00%、6.10%和6.11%,符合WADA技术文件要求。
2.4.3 定量限(LOQ)
WADA实验室国际标准对定量限的定义是能够满足Sr 和Sw 要求的最低浓度。本实验定量限浓度为50 ng/mL,Sr和Sw的相对标准偏差分别为5.0%和14.0%。
2.4.4 线性范围
在100 μL大鼠血清中加入10 ng/μL IGF-Ⅰ标准溶液,配制浓度为1200 ng/mL 标准工作液,采用逐级稀释的方式,得到系列标准工作液浓度分别为50 ng/mL、100 ng/mL、200 ng/mL、400 ng/mL、800 ng/mL、1200 ng/mL。标准工作液与样品一同经过前处理过程并上机检测,采用1093→473 的IGF-Ⅰ定量离子对和1107→479 的15N-IGF-Ⅰ定量离子对采集数据,用ABI MultiQuant 3.0.2 软件对数据进行分析,以15NIGF-Ⅰ为内标,以1/x 为权重做线性回归生成标准曲线,r>0.99。见图2。
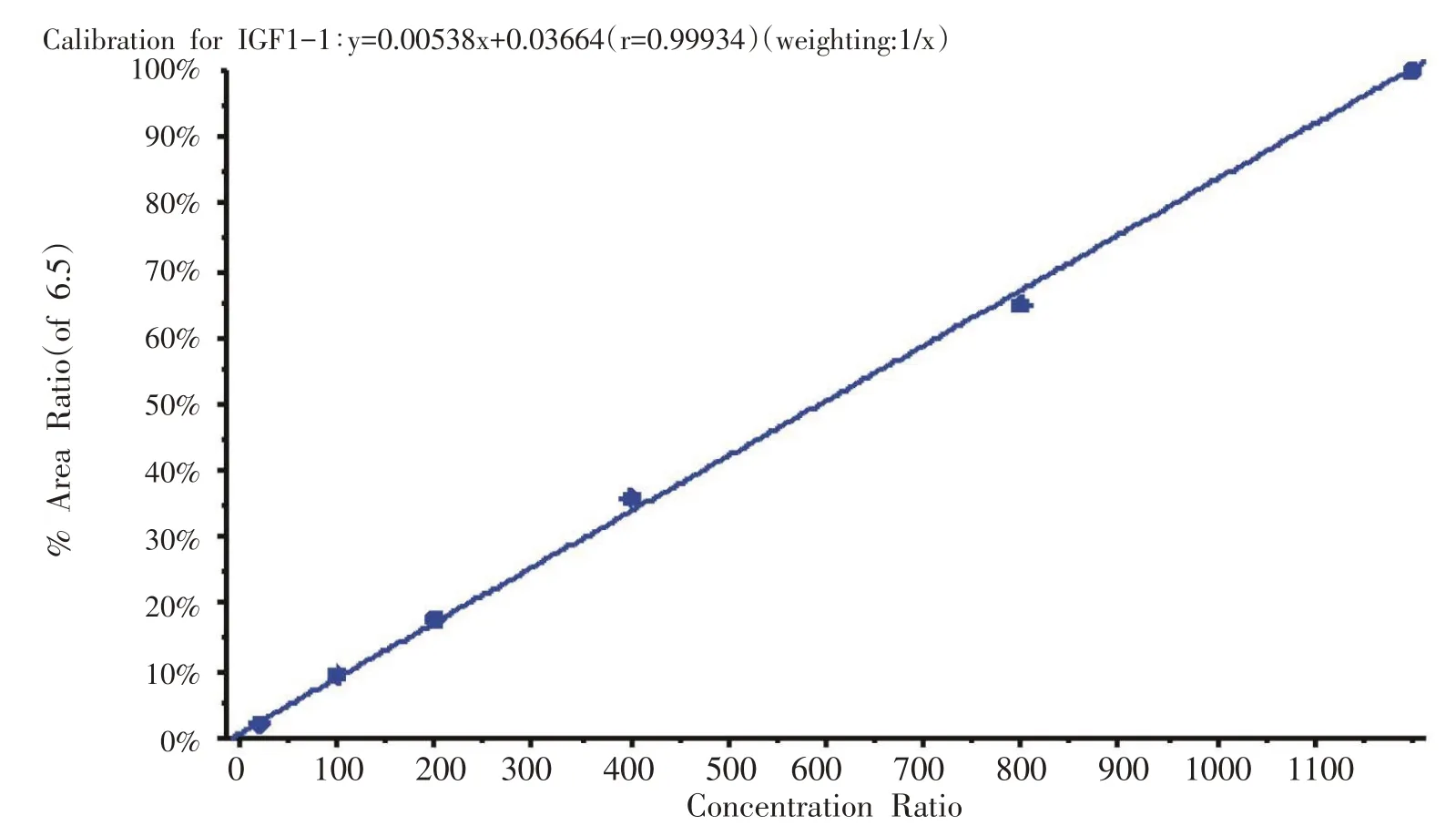
图2 IGF-Ⅰ定量曲线
2.4.5 携带污染
为了避免在实际检测工作中由于前一个样品在系统中的残留而导致影响下一个样品定量结果的准确,需要对携带污染进行验证。本实验中,以大鼠血清提取液作为空白,在1200 ng/mL 浓度样品后进行空白样品的检测,重复检测12 次,观察目标离子对在相同保留时间处是否有信号响应。12 次检测结果显示,空白样品中相应保留时间处无明显信号响应,未见携带污染。
方法验证指标的结果汇总于表3。
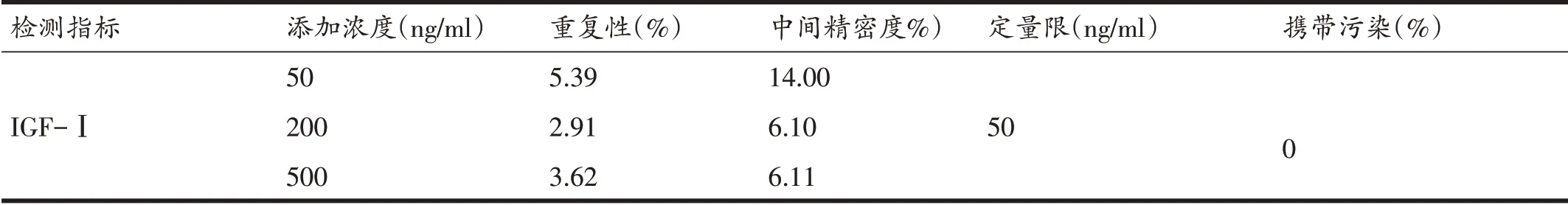
表3 LC-QQQ检测血清IGF-Ⅰ方法验证汇总
2.4.6 稳定性
本研究分别使用两支IGF-Ⅰ(02/254)标准物质配制两套10 ng/μL IGF-Ⅰ标准溶液,其中一套标准溶液用来配制标准曲线,另一套标准溶液用来配制质控样品。质控样品作为内部质控监控每批次检测样品,使用WADA 提供的血清IGF-Ⅰ样品作为外部质控监控每天检测样品,以平均值±3倍标准差作为可控范围绘制质控图,如图3。一年内质控数值均在平均值±3 倍标准差范围内,说明检测方法长期稳定性好。
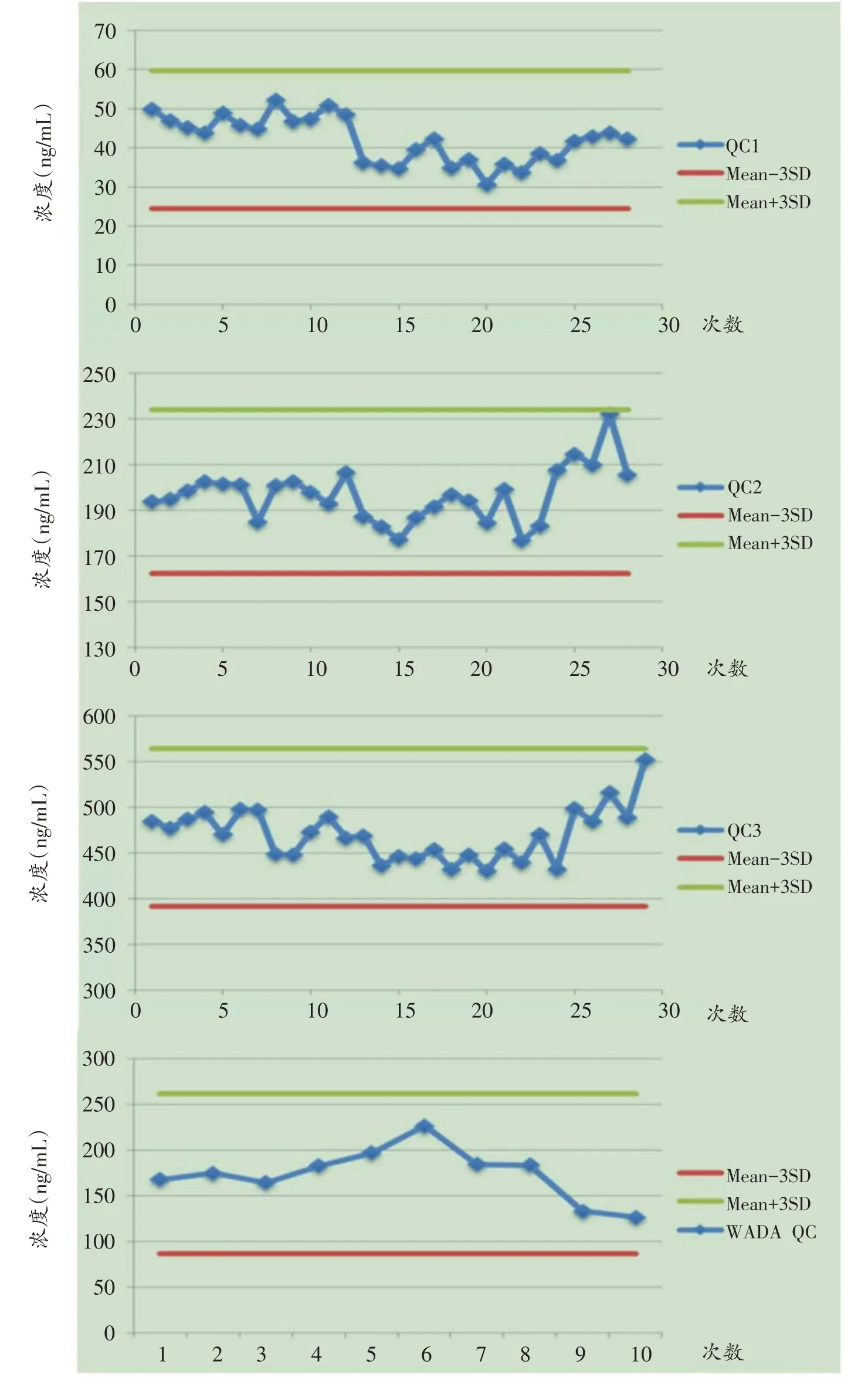
图3 低中高三水平浓度质控样品图
3 结论
采用LC-QQQ技术建立了检测人血清中全链IGF-Ⅰ的检测方法。经方法验证,该方法检测选择性好,稳定性良好,能够满足WADA 指导文件要求。该方法已对实际运动员血清样品进行检测,经与IGF-Ⅰ常规免疫检测方法比对,高度相关,可作为检测运动员血清IGF-Ⅰ的常规质谱检测方法。

