运动与肌肉因子IL-15代谢调控作用研究进展
贾杰 周杨 于晶晶 张缨
1 北京体育大学运动人体科学学院(北京100084)
2 北京市芦城体育运动技术学校(北京102612)
3 北京体育大学中国运动与健康学院(北京100084)
骨骼肌是机体中重要的运动器官,同时还是人体最大的内分泌器官。它可通过离心、向心和等长等不同形式的收缩,分泌多种肌肉因子和其他多肽类物质,这些物质被称为肌肉因子[1]。肌肉因子可以通过自分泌、旁分泌和内分泌等途径作用于机体的各个组织,从而调节机体的代谢[2]。IL-15 是一种细胞因子,于2007年正式被纳入肌肉因子的范畴[3]。在运动过程中,血浆中增加的IL-15主要由骨骼肌分泌,它能够作用于机体中多个组织,在调节骨骼肌脂肪酸代谢、促进骨骼肌葡萄糖摄取和增强脂肪组织脂解等方面具有重要作用。
1 IL-15及其受体
IL-15在多种细胞和组织中广泛表达,起初被认为是自然杀伤(natural killer,NK)细胞的激活剂,在抗肿瘤的炎症反应中起重要作用[4]。随后的研究发现,IL-15 可以增加肌细胞和肌纤维中蛋白质的合成,促进肌球蛋白重链的积累[5]。此外,IL-15 在骨骼肌中高度表达,它作为肌肉因子主要参与调控骨骼肌和脂肪组织的物质代谢[6-8]。
IL-15 属于4α螺旋细胞因子家族[9]。IL-15 受体(interleukin-15 receptor,IL-15R),由三个亚基构成,分别为α、β和γ三种亚基,这三种亚基构成一个复杂的异源三聚体形式。其中β和γ亚基为IL-15 和IL-2 所共用,故IL-15和IL-2可发挥相似的信号转导功能。IL-15的α亚基基因具有复杂的生物化学特征,其编码可以产生两种不同的α亚基蛋白。其中一种是IL-15 膜受体α亚基(IL-15Rα),一般认为,膜受体IL-15Rα不直接参与IL-15 的信号转导,其主要功能是与IL-15 结合,促进IL-15进一步与β和γ亚基作用,完成IL-15信号的转导;另一种α亚基为IL-15 可溶性受体α亚基(sIL-15Rα),主要存在于体液中。sIL-15Rα与膜受体IL-15Rα结构相似,可以竞争性地结合IL-15,阻止IL-15与膜受体IL-15Rα结合,对IL-15的活性产生抑制作用[10](图1)。
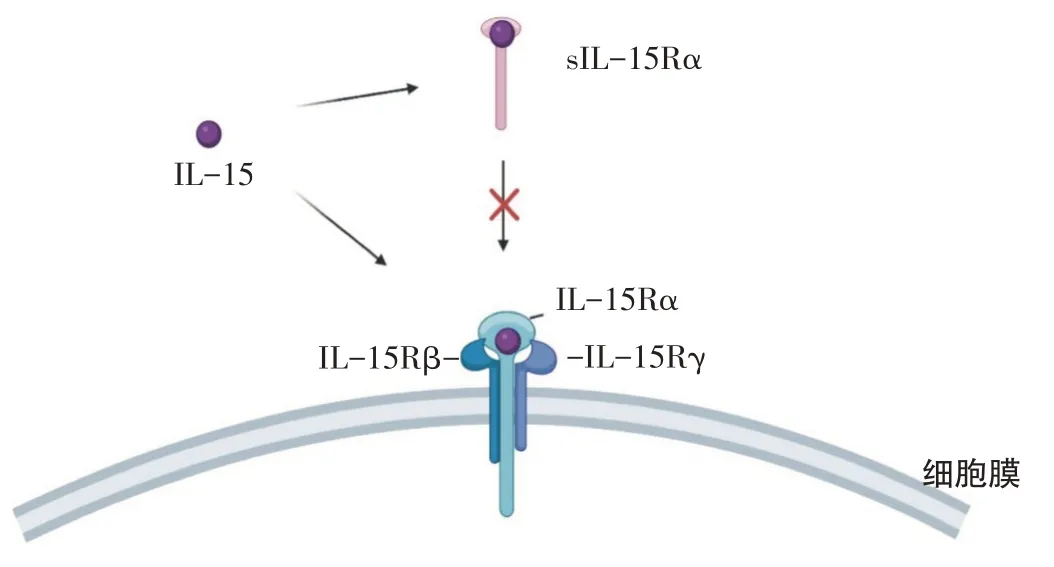
图1 IL-15受体示意图
2 运动对骨骼肌IL-15 及血液含量的影响
2.1 急性运动的影响
小鼠进行急性跑台运动后,骨骼肌和血浆中IL-15含量均迅速升高[11]。9 名健康男性急性短跑运动可促进骨骼肌IL-15 表达[12]。健康的青年男女进行急性抗阻运动以及13名未经运动训练的男性采用70%最大心率对应的跑速在跑台上运动30 分钟后,血浆中IL-15蛋白含量显著增加[13,14]。肥胖受试者在进行1 小时有氧运动后,血浆中IL-15 水平也显著升高[15]。另外,14名运动员和14 名非运动员分别进行离心和向心两种大强度抗阻运动,非运动员在两种抗阻运动后血浆IL-15含量均显著增加,而运动员仅在离心收缩后血浆IL-15 含量出现显著增加[16]。以上表明,无论是训练者还是未经运动训练者,急性运动(有氧运动或抗阻运动)均可引起骨骼肌和/或血液IL-15 含量的变化,而对非训练者的作用可能更加显著。
IL-15在血浆中有两种存在形式,一种是游离态的IL-15,另一种是形成IL-15+sIL-15Rα复合体的结合态IL-15。结合态IL-15 不能与膜上的IL-15Rα结合,从而无法发挥生物学活性。研究进一步发现,14 名有运动训练经验的年轻受试者,采用75% 1RM 强度进行4组举腿和伸膝运动后血清中IL-15含量显著增加,并且sIL-15Rα降低了75%[17]。动物实验中小鼠在进行递增负荷至力竭的跑台运动后,血浆中sIL-15Rα水平也显著降低[18]。以上研究结果提示,急性运动能够提高血浆IL-15含量,同时降低血sIL-15Rα水平,这样可导致更多的游离态IL-15与膜受体结合,促进IL-15生物效应的发挥。
2.2 长期运动训练的影响
有文献报道,肥胖大鼠进行为期8 周的跑台训练后,比目鱼肌和腓肠肌中IL-15 含量显著增加,但是血浆中IL-15 的含量并没有明显变化[19]。15 名健康青年男性在12 周的耐力训练后,静息状态下骨骼肌中IL-15 蛋白含量增加了40%,但血浆中IL-15 含量变化不大[20]。健康的青年男女进行为期10周的抗阻运动和健康成年男性进行8 周的中等和高强度抗阻训练,并没有引起静息状态血浆中IL-15含量显著性变化[12,13]。这表明长期运动训练可能通过增加骨骼肌IL-15含量,实现IL-15 介导的对骨骼肌代谢的调控作用。而IL-15含量变化可能主要受急性运动的影响,以及其他组织器官对运动后血液IL-15 的摄取增加和运动训练的强度、时间等因素的影响。另外,值得注意的是,在以上研究中所测量的血浆中的IL-15,既包括游离态的IL-15,又包括与sIL-15Rα结合的结合态IL-15。研究已证明,经常进行运动训练的人群血浆中sIL-15Rα的含量显著低于静坐少动的人群[21]。这提示长期运动训练后,即使血液总IL-15含量没有变化,但sIL-15Rα含量的增加或减少,可直接影响血游离态IL-15对其他组织的调节作用。
3 运动介导肌肉因子IL-15的代谢调控作用
3.1 IL-15与骨骼肌脂肪酸代谢
IL-15能够提升骨骼肌脂肪酸代谢能力,可能是通过调控过氧化物酶体增殖物激活受体δ(peroxisome proliferator activated receptor δ,PPARδ)实现的。研究发现,肌管细胞转染IL-15后,分别在1和3小时后可检测到较高的PPARδ和过氧化物酶体增殖物激活受体γ协同刺激因子1α(PGC-1α)mRNA 水平[22]。采用胃插管给药的方式,连续7 天向大鼠体内注入100μg/kg 的IL-15,发现大鼠趾长伸肌中PPARδ mRNA 表达增加了2.5 倍[23]。肌肉特异性IL-15 过表达鼠的骨骼肌中PPARδ蛋白表达显著增加,对IL-15敲除小鼠腹腔注射150 ng外源性IL-15后也可检测到PPARδ蛋白表达的显著增加[18,24]。
PPARδ是一种在骨骼肌中高表达的核激素受体,是PPAR 的一个亚型[25]。肌肉组织中特异性过表达PPARδ可使肌纤维向有氧氧化型转变、增加骨骼肌线粒体含量、氧化酶活性和脂肪酸氧化水平[26]。PPARδ调节骨骼肌脂肪酸代谢,一方面通过上调脂肪酸转运蛋白(fatty acid transport proteins,FATPs)表达,促进骨骼肌对血液中长链脂肪酸的摄取和转运。另一方面,PPARδ能够促进肉毒碱棕榈酰基转移酶1(carnitine palmitoyltransferase-1,CPT-1)、肉毒碱棕榈酰基转移酶2(carnitine palmitoyltransferase-2,CPT-2)和酰基辅酶A 合成酶4(acyl-CoA synthetase 4,ACS4)的蛋白表达[27]。CPT1 是长链脂肪酸进入线粒体进行脂肪酸β氧化的限速酶,而ACS4是催化脂肪酸活化(脂肪酸β氧化前需活化生成脂酰辅酶A)的酶,这些酶在脂肪酸代谢过程中起关键调控作用[7]。
3.2 IL-15与骨骼肌葡萄糖摄取
IL-15 可以促进骨骼肌的葡萄糖摄取利用。向C2C12 细胞中加入1 ng/ml 的IL-15 后,C2C12 细胞葡萄糖摄取能力增加,并且该细胞对胰岛素的敏感性增强[28,29]。采用IL-15(100 ng/ml)孵育大鼠离体趾长伸肌2 小时后,发现该肌肉组织对葡萄糖的摄取能力明显提高[30]。通过腺病毒载体在C2C12 细胞中过表达IL-15,结果表明该细胞对葡萄糖的摄取能力也显著增加[31]。在动物实验中也观察到了同样的情况。大鼠静脉注射IL-15(100 μg/kg 体重)后,其骨骼肌的葡萄糖摄取能力增加[32]。在肥胖小鼠中通过腺病毒载体过表达IL-15,能够明显改善肥胖小鼠全身的糖代谢水平,并且增加其胰岛素敏感性[33]。肥胖小鼠骨骼肌特异性过表达IL-15 后,空腹血糖水平明显降低,并显著改善糖耐量和胰岛素敏感性[34]。
目前,IL-15调控骨骼肌胰岛素敏感性的分子机制尚不完全清楚。但研究已发现,在免疫系统的NK和T细胞中IL-15 可以通过Janus 激酶1/3(janus kinase 1/3,JAK1/3)调控胰岛素信号转导通路[35]。JAK1和JAK3属于Janus激酶家族成员,是一种受体酪氨酸激酶。它们既是受体,又是酶,能够同配体结合,并将靶蛋白的酪氨酸残基磷酸化[36]。JAK1和JAK3可被IL-15激活,使胰岛素受体底物1/2(insulin receptor substrate 1/2,IRS1/2)蛋白上的酪氨酸磷酸化(phosphorylated insu⁃lin receptor substrate,p-IRS1/2)[37]。在骨骼肌中p-IRS1/2 与磷脂酰肌醇3 激酶(phosphatidylinositol 3 ki⁃nase,PI3K)结合,进一步使其下游蛋白激酶B(protein kinase B,PKB or AKT)磷酸化[38]。p-AKT 进一步激活Ras相关蛋白8A(Rab8A)和Rab13,两者可以促进葡萄糖转运蛋白4(glucose transporters 4,GLUT4)从细胞质转运至细胞膜,增加骨骼肌对血中葡萄糖的吸收,提高胰岛素敏感性[39]。另有研究证实,使用5 ng/ml IL-15 孵育C2C12 细胞后,细胞中JAK3 被激活,同时GLUT4 从细胞质向细胞膜转位增加,该细胞的胰岛素敏感性显著提升[7]。因此,在骨骼肌中IL-15 可能通过JAK1/3 介导激活IRS1/2 信号转导通路(IRS1/2-PI3KAKT-GLUT4),促进骨骼肌葡萄糖的摄取利用。
3.3 IL-15与脂肪组织的脂解作用
IL-15 与脂肪组织的脂解作用关系密切。研究表明,分化的3T3-L1脂肪细胞中加入外源性IL-15,该细胞中脂质蓄积明显降低[40]。离体培养的猪脂肪组织中加入IL-15,其脂肪分解的速率快速升高,并且脂解速率依IL-15 剂量增加而上升[41]。持续7 天,向大鼠皮下注射100 μg/kg 的IL-15,发现大鼠体内白色脂肪量减少了33%[42]。IL-15过表达小鼠与野生鼠相比,体重明显减轻,而IL-15 基因敲除鼠体内脂肪量则显著增加,且外源性补充IL-15能够改善这一现象[43]。以上说明,IL-15能够提升机体中脂肪的分解速率,从而降低脂肪在组织中的堆积。进而,IL-15能够促进脂肪组织的脂肪酸氧化。
IL-15 调控脂肪组织脂解的机制可能通过PPARα实现。已有研究表明IL-15 能够促进脂肪组织中PPARα的表达[10]。解偶联蛋白1(uncoupling protein 1,UCP1)是存在于棕色脂肪和米色脂肪细胞中的一种特殊的蛋白质,能够增加脂肪组织中脂质动员和脂肪酸的消耗,从而降低机体中脂肪的堆积[44],并且在脂肪细胞的产热功能中发挥重要作用[45]。PPARα可直接调控UCP1的表达[46]。
3.4 运动介导IL-15代谢调控作用的可能机制
运动促进骨骼肌分泌IL-15,引起血浆中IL-15 含量的上调,同时使sIL-15Rα含量降低,造成血游离态IL-15 水平升高。游离态IL-15 可以通过血液运输作用于全身,与细胞膜上的IL-15 受体结合,发挥生物学功效。在骨骼肌中,IL-15可能通过运动后自分泌和旁分泌方式,以PPARδ依赖途径提高骨骼肌脂肪酸有氧代谢能力,以及IL-15介导IRS1/2-PI3K-GLUT4通路改善骨骼肌胰岛素敏感性。运动骨骼肌释放入血的IL-15也可通过内分泌方式,在脂肪组织介导PPARα转录因子,促进下游脂代谢靶基因的转录活性,从而增强脂肪酸代谢水平,增加脂肪组织中脂肪的分解(图2)。

图2 运动介导IL-15调控代谢作用的可能机制
4 小结与展望
本文综述了运动、肌肉因子IL-15与代谢调控作用的最新研究进展。综上可见,IL-15是影响骨骼肌和脂肪组织代谢的重要肌肉因子。运动可增加血液游离IL-15 含量。运动介导的肌肉因子IL-15 的代谢调控作用,可能是骨骼肌和脂肪组织间调节的关键“桥梁”,在预防和改善2 型糖尿病、肥胖和心血管疾病等代谢性疾病方面有着积极影响和重要研究意义。目前,IL-15及其受体对机体能量代谢调控的分子机制仍需要进一步深入探究。

