促甲状腺激素抑制方案改善甲状腺癌患者存活率效果研究
刘丽亚 刘 洋 唐艺峰
甲状腺癌作为内分泌系统最为常见的恶性肿瘤之一[1]。目前对于该病治疗以外科手术治疗联合放射性碘和长期外源性甲状腺激素替代疗法为主,但近年来研究发现术后甲状腺激素替代疗法虽能为患者提供生理剂量甲状腺激素,但无法有效抑制甲状腺激素,致甲状腺激素在甲状腺癌细胞表面受体上产生变化而引起甲状腺特异性蛋白高表达水平,造成甲状腺肿瘤细胞再次生长、增加,由此导致甲状腺癌复发与转移,生存率低下[2-3]。本文通过观察促甲状腺激素抑制疗法对甲状腺癌患者近远期生存率的影响,旨在抑制甲状腺复发、转移、延长患者生存期。
1 资料与方法
1.1 一般资料
选取2012年3月至2015年2月医院甲状腺癌患者118例,纳入标准:①符合美国国家癌症综合治疗联盟(NCCN)分化型甲状腺癌诊治指南标准[4]且经术后病理确诊。②术后病理确诊为分化型甲状腺癌,包括滤泡状和乳头状。③依从性良好。④患者状况良好,白细胞计数>3.0×109/L。⑤心肺肝肾功能正常。⑥手术为甲状腺全切或次全切除术,切口愈合且手术记录完整。⑦签署研究知情同意书,自愿参加。排除标准:①精神疾病、认知功能下降以及沟通障碍。②经手术、放化疗等治疗复发。③合并其他恶性肿瘤。④长期服用免疫抑制剂。⑤失访等事件退出本研究。男性58、女性60例,年龄38~65岁、平均年龄(51.20±3.00)岁,病理类型:滤泡状25例、乳头状93例,分期:Ⅰ期15例、Ⅱ期29例、Ⅲ期48例、Ⅳ期26例,手术方法:全切102例、次全切16例。按照单双号抽签方法,设为观察组和对照组(各59例)。两组患者相关资料比较,P>0.05,可比性强,见表1。
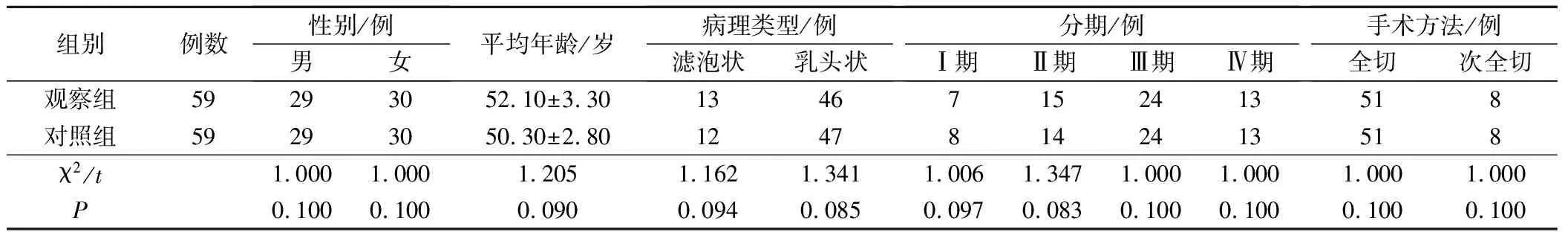
表1 两组患者相关资料分布/例
1.2 方法
两组患者采用同样的手术方法,包括甲状腺全切除手术或次全切除手术,进行个体化颈部淋巴结清扫。术后30~45 d,通过放射性131I对残留甲状腺组织进行清除且杀灭残余肿瘤,放射性碘治疗剂量按照患者清甲、淋巴结和肺脏、骨骼转移等具体情况而定,通常在100~150 mCi、平均剂量109.8 mCi,治疗周期7天左右。经颈部CT检查和颈部彩超检查未见残余甲状腺组织时,说明清甲成功。
经131I全身扫描颈部无放射性浓聚灶和无转移灶后,观察组患者采用促甲状腺激素抑制疗法,选用左旋甲状腺素钠(生产厂家:Merck kGaA,规格50 μg/片,批准文号H20100523),1.5~2.5 μg/(kg·d)作为推荐剂量清晨空腹口服,根据肿瘤分期控制血浆促甲状腺激素质量水平,其中I期≤正常值极限(0.1~0.3 mU/L)、Ⅱ~Ⅲ期浓度0.05~0.1 mU/L、Ⅳ期≤0.05 mU/L,服药期间密切观察监测血浆促甲状腺激素质量水平,2~3次/年,根据期间监测结果随时调整左旋甲状腺素钠剂量。对照组采用甲状腺素替代疗法,定期复查血清甲状腺素水平。
1.3 观察指标
服药前、服药3年、5年行甲状腺球蛋白监测(采用放射免疫法,试剂盒由罗氏公司提供,操作严格按照说明书)和颈部超声检查(采用飞利浦IU22超声诊断仪,高频线阵探头,探头频率5.0~12.0 MHz)、放射性131I全身扫描检查(采用高能量准直仪扫描器,扫描速度8~10 cm/min),观察和记录血清学指标(包括血清可溶性白细胞介素-2受体、白细胞分化抗原44变异型6和肿瘤特异性生长因子)、甲状腺癌复发、转移、患者生存情况以及抑郁焦虑状况。血清学指标检测,于空腹12 h后采集静脉血5 ml,分离血清待测,利用上海旦鼎国际贸易有限公司提供Thermo Scientific Multiskan FC酶标仪,采用酶联免疫分析法检测。
1.4 评价标准
焦虑症状评价参考汉密尔顿焦虑量表(HAMA),包括14个项目,分为严重焦虑症状:>29分,明显焦虑症状:21~29分,肯定焦虑症状:14~20分,疑似焦虑症状:7~13分,无焦虑症状:<7分。
抑郁症状评价参考汉密尔顿抑郁量表(HAMD),包括24个项目,分为严重抑郁症状:≥35分,轻中度抑郁症状:20~34分,疑似抑郁症状:8~19分,无抑郁症状:<8分。
1.5 统计学分析
2 结果
2.1 两组患者近远期生存状况分布比较
观察组3年、5年复发率、颈部淋巴及转移率均低于对照组,差异有统计学意义(P<0.05)。3年生存率与对照组比较,差异无统计学意义(P>0.05),5年生存率高于对照组,差异有统计学意义(P<0.05)。且观察组3年与5年生存率比较,差异无统计学意义(P>0.05),见表2。

表2 两组患者近远期生存状况分布比较(例,%)
2.2 两组患者近远期血清指标水平比较
两组患者服药3年、5年可溶性白细胞介素-2受体、白细胞分化抗原44变异型6和肿瘤特异性生长因子水平低于服药前,差异有统计学意义(P<0.05)。服药3年、5年低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者近远期血清指标水平比较
2.3 两组患者近期焦虑抑郁发生率比较
两组患者5年与3年焦虑抑郁未发生率比较,差异无统计学意义(P>0.05)。观察组3年、5年焦虑抑郁未发生率与对照组比较,差异无统计学意义(P>0.05)。见表4。
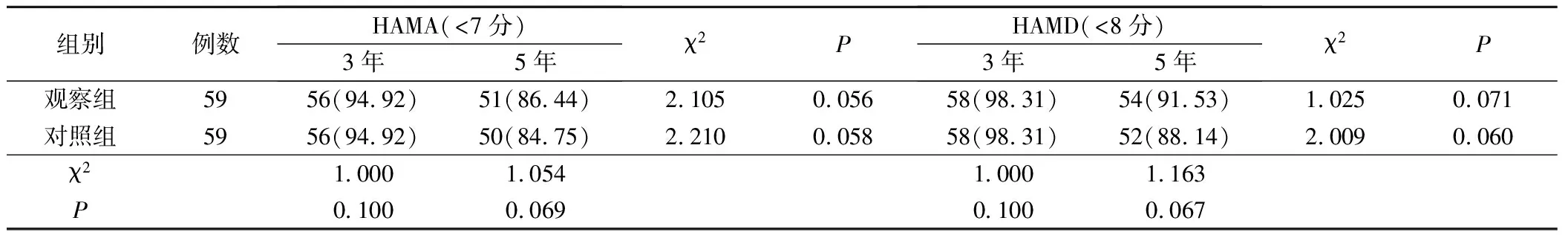
表4 两组患者近期焦虑抑郁发生率比较(例,%)
3 讨论
研究显示甲状腺作为机体重要的组织器官,其分泌的甲状腺激素有助于婴幼儿生长发育以及维持成人新陈代谢、蛋白质合成、产热等,且与人体认知功能、情绪状态具有一定关联性[5]。而对于甲状腺癌患者而言,多数采取手术全切或次全切除术后,血清甲状腺激素水平呈低位状态,所以通常情况下需服用一定剂量甲状腺激素制剂以维持机体正常功能。但近年来研究表明采用生理剂量甲状腺激素制剂替代干预时,无法有效抑制促甲状腺激素而致其作用于甲状腺癌细胞膜表面促甲状腺激素受体,从而引起一系列变化,反而促进了甲状腺肿瘤增殖、复发和转移,结果适得其反[6]。而促甲状腺激素抑制疗法基于下丘脑-垂体-甲状腺轴反馈系统,通过给予相应的促进甲状腺激素抑制剂能反馈性的抑制促甲状腺素分泌,降低血中促甲状腺激素水平,从而有助于减弱对残余甲状腺组织促甲状腺激素受体的刺激作用,进而起到抑制其增长及向去分化的发展,为该方法的临床应用提供了一定理论依据,但仍无法形成系统性理论体系,不利于该疗法推广[7-8]。且研究表明此种抑制疗法主要作用对象为分化良好的甲状腺癌,而对于未分癌而言,因其分化程度较低而对下丘脑-垂体-甲状腺轴依赖性过低,所以不建议行促甲状腺激素抑制疗法[9]。
基于上述认知,本文进一步观察和比较促甲状腺激素抑制疗法和甲状腺替代方案改善甲状腺癌患者存活率效果。结果显示促甲状腺激素抑制疗法能明显减少甲状腺癌复发、转移、提高患者远期生存率(尤其5年存活率高达98.31%),且优于甲状腺激素替代疗法,说明促甲状腺激素抑制疗法作用显著、疗效确切。并且通过比较两组患者可溶性白细胞介素-2受体、白细胞分化抗原44变异型6和肿瘤特异性生长因子水平,结果显示三种血清指标下降显著,且在远期时也低于甲状腺激素替代疗法,差异有统计学意义(P<0.05),所以该组客观数据进一步印证了促甲状腺激素抑制疗法提高甲状腺癌患者近远期生存率可行且有效。因为可溶性白细胞介素-2受体作为1种活化性T细胞糖蛋白,通过与白细胞介素-2竞争性结合而具有抑制白介素-2生物效应的作用(白介素-2是1种T细胞生长因子,能促进T细胞生长增殖而具有调节免疫应答的作用),且甲状腺癌患者血清中可溶性白细胞介素-2受体水平是甲状腺良性疾病中的2倍,所以被临床视为甲状腺癌标志物,其水平高低能反映甲状腺癌肿瘤发展状况[10]。白细胞分化抗原44变异型6作为CD44变异型,能降低肿瘤细胞粘附性、促进肿瘤细胞运动,所以该指标与肿瘤侵袭、转移密切相关;肿瘤特异性生长因子可通过生长的肿瘤组织释放入血而加速肿瘤组织毛细血管形成,从而促进了肿瘤细胞增殖,所以也能在一定程度上反映甲状腺癌病情、评价预后[11-12]。另外,通过评定促甲状腺激素抑制疗法安全性,结果显示该方法未能造成患者严重焦虑抑郁状态,所以有助于最大限度提高患者生存质量、促进其身心健康,利用患者日后康复。
总之,促甲状腺激素抑制疗法能有效降低甲状腺癌手术后肿瘤复发、转移,提高生存率、延长生存期,且相对安全,优于单纯甲状腺激素替代疗法。且加强甲状腺激素水平监测,有助于及时调整用药剂量,保证用药安全。

