VMAT旋转调强多中心照射技术在全脑全中枢放疗中的应用
张怀文 钟晓鸣 胡海芹 洪 潮
全脑全脊髓放射治疗或全脑全中枢放射治疗主要适用于恶性程度高、易发生脑脊液播散的中枢神经系统肿瘤的治疗[1]。其适应症主要包括髓母细胞瘤、生殖细胞瘤、分化差的恶性室管膜母细胞瘤、中枢神经系统恶性淋巴瘤、中枢神经系统白血病等[2]。此类病变好发于儿童及青少年,大多对放射线敏感,全脑全脊髓放疗常作为其标准治疗方案[3]。常规和静态调强放疗技术主要弊端为患者靶区剂量均匀性差、照射野长度不够且射野衔接处易出现剂量冷、热点[4]。本研究将VMAT旋转调强多中心照射技术应用于我院全脑全中枢放疗中,从患者的靶区剂量分布适形度和均匀性及心脏、肺、晶体等重要危及器官受量等方面探讨其治疗计划优缺点,希望为临床选择最佳治疗计划进行推广提供科学参考依据。现将主要的结果报告如下。
1 资料与方法
1.1 病例选择
随机选取2018年1月至2020年12月我院放疗中心收治全脑全中枢放疗患者10例,其中男性9例,女性1例,年龄6~21岁,中位年龄13岁。所有患者无精神障碍和精神疾病,有较好的自控能力,心肺功能基本正常,均无放疗禁忌症。
1.2 体位固定和CT扫描
患者取仰卧位平躺于科莱瑞迪卡条式放疗多功能一体架后确保患者呼吸通畅,首先在瓦里安常规Acuity模拟定位机下进行透视和调整,使两侧外耳孔重合,整个脊髓、头颅矢状面保持在同一体中线上。患者头颈部使用热塑面罩固定,体部予以热塑性U型体罩固定,双手自然垂放身体两侧,下肢伸直自然平放,体中线与床长轴一致。由于照射范围过长,所以采用多个中心的定位方法,在头部“十”字及脊髓野各中心贴铅珠标记。同时,按照仰卧位三个等中心定位方法,确定三组标记点,并贴铅珠标记。患者平静呼吸下经西门子SOMATOM Definition AS20排大孔径螺旋4DCT进行CT定位图像扫描,扫描范围从头顶上方1 cm开始至腰椎S4下缘截止。头部扫描层厚为3 mm,其余位置扫描层厚为5 mm,扫描层间距设为3 mm,扫描结束后将CT模拟机患者定位图像资料通过医院专用放疗局域网传至瓦里安Ecalipse13.5放疗计划系统。
1.3 靶体积与危及器官勾画
为了保持靶区勾画的一致性,由同一资深专业放疗医师在放疗计划系统的医生工作站根据ICRU第50、62号报告勾画放射治疗靶区。靶区范围包括全颅腔和全椎管,然后立体外放5 mm边界作为肿瘤计划靶区体积(PTV),靶区长度一般约为60~80 cm。危及器官主要包括晶体、性腺、心脏、结肠、双肺、双肾、膀胱、肝脏、甲状腺等。
1.4 计划的设计和实施
物理师在三维放疗计划系统工作站根据放疗医师确认的总计划靶区进行不同照射计划设计。针对每位患者分别设计3套计划,分别是3DCRT技术(Ⅰ)、3DCRT+IMRT技术(Ⅱ)与VMAT旋转调强多中心照射技术(Ⅲ)。采用瓦里安TrueBeam直线加速器6MV光子。每位患者3种治疗计划处方剂量为3600 cGy/18次,200 cGy/天,5次/周。3种治疗计划都将患者整个疗程分为三段,每段都不改变射野中心位置,只改变射野照射范围上下界,使得在每一个疗程中,上下射野衔接位置发生变化,更好减少患者摆位误差带来的剂量影响。
3D-CRT计划:全脑及上颈第六椎体以上部分采用等中心近水平对穿射野并旋转小机头方式消除高量设计计划,而第六颈椎以下所有脊髓射野采用等中心1前2后野方式进行计划设计。照射全脑的射野与照射脊髓上段射野利用照射半野锁野技术进行交接位置衔接,为更好的消除射野衔接处剂量冷热点的出现,在脊髓上段射野和脊髓中段射野、脊髓中段射野和脊髓下端射野的射野衔接处利用正向设置小子野方式来防止衔接处剂量过高或过低。
3D-CRT+IMRT调强计划:患者全脑靶区的照射野仍采用和3D-CRT计划相近的平行对穿照射野设计,上脊髓段射野与全脑靶区照射野共用一个等中心,脊髓上段靶区射野长度设置为不超过15 cm,其余所有脊髓靶区根据靶区长度分2段,每段靶区射野长度设为35 cm以内,两段脊髓段射野都采用4个野调强,机架角度分别设为0°、210°、150°和180°。各调强射野间交叠区范围设为5 cm,且所有射野都不需旋转治疗床和准直器角度。
VMAT旋转调强多中心照射计划:整个多中心VMAT旋转调强计划共运用6个全弧进行计划设计,头部全脑靶区和两段脊髓,三个部位各采用等中心设计两道全弧,均采用Jaw跟随模式,其中逆时针方向机架角度为179°~181°,准直器角度设置为0°~10°;顺时针方向机架角度为181°~179°,准直器角度设置为0°~350°。射野交叠区范围大小仍设置为5 cm左右。
1.5 剂量参数的获取
利用3D剂量体积直方图的相关剂量学数据,评估三种计划在靶区总PTV及各危及器官的剂量参数值。
1.6 观察指标及计划评估
根据体积剂量直方图DVH比较3种照射计划均匀性指数、适形度指数、靶区和相关正常组织体积剂量差异。头部肿瘤靶区+全脊髓总计划靶区的评价参数:①靶区平均剂量Dmean、最大剂量Dmax、最小剂量Dmin;②均匀性指数(HI)为最大剂量与处方剂量的比值,HI反应靶区内剂量的均匀性。计算公式为[5]:HI=D95%/D95%,其中、,分别表示5%、95%体积的肿瘤靶区所接受照射的最低剂量,其值越大表明PTV内部剂量分布越不均匀。③适形度指数(CI)用来评价靶区与参考等剂量曲面的适形程度,计算公式为[6]:CI=(Vt,ref/Vt) ×(Vt,ref/Vref),Vt,ref为95%的处方剂量所覆盖计划靶体积,Vt为总计划靶体积,Vref为95%的剂量所覆盖的所有体积,CI值为0~1,值越接近1,适形度越好。危及器官评价参数:串行危及器官主要分析最大剂量Dmax,并行危及器官比较其平均剂量及受到特定剂量水平照射的体积VD。[VX表示接受XGy照射的体积占整个体积的比例(%)]。
1.7 统计学方法
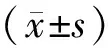
2 结果
2.1 靶区内剂量分布、HI、CI的比较
三种治疗计划的靶区平均剂量Dmean、最大剂量Dmax、最小剂量Dmin、靶区的均匀性指数(HI)和适形度指数(CI)见表l。从表1中可见,在满足95%等剂量曲线对PTV的剂量覆盖的前提下,常规CRT计划靶区的最大剂量、最小剂量及平均剂量都显著高于CRT+IMRT与VMAT计划。VMAT计划的靶区的均匀性指数HI(1.04±0.02)和适形度指数CI(0.89±0.03)最优,而常规CRT计划和CRT+IMRT两者基本相当,差别无统计学意义。

表1 3种计划总靶区的剂量参数、均匀性指数和适形度指数情况
2.2 危及器官受照剂量和体积比较
晶体、视神经、小肠等串行危及器官受照剂量对比:3种治疗计划的晶体、视神经、小肠等串行危及器官的最大剂量受量见表2。VMAT计划组晶体受量略高于3DCRT和CRT+IMRT组,差异具有统计学意义(P<0.05)。计划Ⅰ的小肠所受照射的最大剂量要显著高于计划Ⅱ和Ⅲ。其余照射处三者间差异无统计学意义。

表2 3种治疗计划串行危及器官受照剂量及剂量体积对比
甲状腺、眼睛、肝脏、腮腺等并行危及器官受照平均剂量对比:3种治疗计划的甲状腺、眼睛、肝脏、腮腺等并行危及器官的平均剂量受量见表3。计划Ⅲ中甲状腺平均剂量仅为(1939.47±778.34),显著低于计划Ⅰ和计划Ⅱ,腮腺的平均剂量计划Ⅰ(2385.53±684.51)最大,肝脏的平均剂量计划Ⅱ(644.01±94.72)最低,眼睛平均受量三者之间差别没有统计学意义。

表3 3种治疗计划甲状腺、眼睛、肝脏、腮腺受照剂量及剂量体积对比
肾脏受照剂量体积对比:3种治疗计划肾脏接受照射剂量和受照体积参数如表4所示。计划Ⅲ的肾脏所受照射的平均剂量略高于计划Ⅰ和Ⅱ,计划Ⅰ的肾脏在低剂量处V10接受的受照体积显著高于计划Ⅱ和Ⅲ,差异具有统计学意义(P<0.05)。而在V20照射体积处三者间差异则没有统计学意义。

表4 3种治疗计划肾脏受照剂量及剂量体积对比
肺受照剂量体积对比: 患者的3种治疗计划肺的剂量和受照体积参数见表5。计划Ⅱ的肺受照平均剂量Dmean(521.96±141.92)较计划Ⅰ和计划Ⅲ略高;但肺接受的低剂量照射体积V10计Ⅱ(15.03±8.32)和Ⅲ(21.15±8.53)则明显小于计划I,而肺的最大剂量、最小剂量及高剂量照射体积V20、V30处三者之间差异均无统计学意义(P>0.05)。

表5 3种治疗计划肺受照剂量及剂量体积对比
心脏受照剂量体积对比:患者的3种治疗计划肺
的剂量和受照体积参数见表6。计划Ⅲ的心脏受照最大剂量(2305.01±395.45)和平均剂量(1000.37±364.59)显著低于计划Ⅰ和计划Ⅱ。计划Ⅲ的心脏高剂量区域V20(1.39±2.51)接受的受照体积也大幅低于计划Ⅰ和Ⅱ,差异具有统计学意义(Z值分别为:-2.402,-2.046,-2.491;P均<0.05)。而在心脏接受的最小剂量和低剂量照射区域V10处三者差异不明显,没有统计学意义(P>0.05)。

表6 3种治疗计划心脏受照剂量及剂量体积对比
3 讨论
全脑全中枢的放疗技术已从二维放疗发展到三维适形放疗技术、静态调强放疗技术,直到现在更为先进的容积旋转调强技术和螺旋断层放疗技术。但放射治疗的照射剂量不够或者照射野范围不足是造成其复发的主要原因[7]。怎样设计照射野剂量计算点位置、各个照射野衔接方式及如何大幅减轻全脑全中枢放疗远期不良反应发生风险一直是研究的热点难点问题。
庄小勇等对65例中枢神经系统肿瘤患者应用三维适形计划进行全脑全中枢计划设计,研究发现与传统二维照射模式相比三维计划可在一定程度上降低患者的剂量冷热点[8]。杨海芳等采用全身定位体架配合头颈肩模和体膜固定的IMRT技术设计全脑全脊髓放疗计划显示可明显改善射野衔接处的剂量分布[9]。徐韬等将全脑野与胸脊髓野以半束野与全束野进行衔接,避免了冷热点问题[10]。杨波等对12例全脑全脊髓照射患者采用腰骶射野转床90°+全脑野半野照射技术进行患者计划设计[11]。张伟等应用3DCRT与3野、5野sIMRT计划进行比较研究,结果显示调强计划肿瘤靶区剂量分布均匀性、危及器官保护等方面均好于3DCRT计划[12]。褚俊峰等比较固定野调强放疗与三维适形放疗在全中枢神经系统放疗中的剂量学差异发现IMRT 计划明显提高了靶区的剂量学指标,正常组织和危及器官的高剂量受照体积大大减少[13]。杨玉刚等研究发现3DCRT+IMRT射野衔接技术的计划设计可以很好地应用于儿童CSI,并在正常组织的保护上有独特的优点[14]。谢秋英等研究显示采用调强射野叠加优化技术可明显改善靶区剂量适形度和均匀性,并能有效减小摆位误差对衔接区域剂量的影响[15]。向东华等对儿童颅内高分级室管膜瘤的术后患者进行全中枢神经系统放疗研究发现可显著提高患儿生存率[16]。YOM等通过手工设置多个“野中野”正向调强方式羽化衔接线法,有效地降低衔接区域脊髓的分次高量[17]。Lee等比较容积旋转调强技术与传统放射治疗在全脑全中枢放射治疗中的剂量一致性和计划靶体积均匀性、危及器官剂量发现VMAT计划具有显著优势,但同时也会相应增加患者低剂量照射区域范围[18]。Fogliata等报道了多个治疗中心运用VMAT旋转调强技术治疗全脑全中枢患者的情况,总结分析后发现VMAT计划适形度更好,患者总治疗时间更短,且对危及器官保护更理想[19]。
本研究将VMAT旋转调强多中心照射技术与传统3D-CRT、3D-CRT+静态调强照射技术相比较,确定VMAT计划的临床剂量学优势。研究结果表明:在满足95%等剂量曲线对患者整个PTV靶区剂量覆盖的前提下,三种治疗计划均能够很好的满足临床治疗计划的需要。但常规CRT计划靶区的最大剂量、最小剂量及平均剂量都显著高于CRT+IMRT与VMAT计划,常规三维适形计划由于射野衔接困难,虽解决部分剂量冷热点问题,但整体靶区剂量均匀性及适形度仍较差,尤其是眼球中间筛窦区剂量欠量严重。VMAT计划的靶区均匀性指数和适形度指数显著优于常规CRT计划和CRT+IMRT计划。对危及器官受照剂量保护上来说:VMAT计划组晶体受量略高于3DCRT和CRT+IMRT组,但总体剂量完全满足临床需要,而这可能是由于旋转照射射野角度相对较多造成一定散射、漏射导致。3DCRT计划小肠所受照射最大剂量显著高于计划Ⅱ和Ⅲ。VMAT计划甲状腺平均剂量(1939.47±778.34)显著低于计划Ⅰ和计划Ⅱ,因为是左右对穿照射,故CRT计划对患者腮腺保护不够理想。VMAT计划肾脏所受照射平均剂量(619.36±181.40)略高于计划Ⅰ(595.39±112.20)和Ⅱ(355.57±87.80)。计划Ⅱ肺受照平均剂量Dmean(521.96±141.92)较计划Ⅰ和计划Ⅲ略高;但肺接受低剂量照射体积V10计划Ⅱ(15.03±8.32)和Ⅲ(21.15±8.53)则明显小于计划Ⅰ。计划Ⅲ心脏受照最大剂量(2305.01±395.45)、平均剂量(1000.37±364.59)及高剂量区域V20(1.39±2.51)都显著低于计划Ⅰ和计划Ⅱ。
综上,容积旋转调强多中心全脑全脊髓放疗技术
可完美解决靶区剂量冷热点问题,大幅提高整个靶区内剂量分布均匀性和适形度,并可有效解决常规3D-CRT或者静态IMRT计划危及器官超量、剂量验证通过率低、机器执行时间漫长等导致剂量不精确问题。但VMAT技术也相对更加复杂相关研究仍比较欠缺,同时如何更好降低周围正常组织低剂量受照剂量和体积,避免由于低剂量照射引起的二次致癌,还需要临床放疗进一步研究[20]。

