miR-34、miR-221在多发性骨髓瘤患者外周血中的表达水平及临床意义
李仙松 李 丹 李 博
多发性骨髓瘤(multiple myeloma,MM)是一种由浆细胞恶性增殖引起的常见血液系统恶性肿瘤[1],其发病率仅次于淋巴瘤,约占血液系统肿瘤的10%[2]。早期MM发病隐匿,晚期MM多见广泛骨质破坏、贫血、反复感染、多脏器功能不全等临床表现[3]。现阶段常使用放、化疗,移植造血干细胞等手段治疗MM[4],但大多数患者无法治愈,易复发。因此尽早确诊,及早为患者制定合适的治疗方案尤为重要。研究表明微小RNA(mircoRNA,miRNA)参与基因表达的调控,通过调节细胞自噬、增殖及凋亡等方式调控细胞生命活动[5],此过程与多种肿瘤的发生发展相关。miR-34家族是一种肿瘤抑制分子[6],通过调控EMT转录因子和P53基因抑制细胞上皮-间充质转化抑制肿瘤生长。而miR-221在多种肿瘤细胞中表达升高,发挥促瘤作用,其高表达常与肿瘤患者预后不良相关[7]。但miR-34、miR-221在MM中的表达水平及意义尚不明确。本研究采用RT-PCR技术检测MM患者外周血中miR-34、miR-221水平,旨在为MM的早期诊断及预后评估提供相关依据。
1 材料与方法
1.1 一般资料
选取2012年8月至2016年8月本院血液科收治的41例MM患者作为研究组,经血常规检查、骨髓形态学检查、分子生物学诊断均符合中国多发性骨髓瘤诊治指南 (2011年修订)[8]。研究组中男性23例、女性18例,中位年龄58(47~77)岁。依据DS分期[9]分为Ⅰ期14例、Ⅱ期11例、Ⅲ期16例。另选取同期我院收治的骨髓穿刺无异常的健康人50例作为对照组,其中男性24例、女性26例,中位年龄60(48~75)岁。2组对象年龄、性别、BMI指数等一般资料无统计学差异(P>0.05),具有可比性。所有研究对象及家属均已签署研究知情同意书。本研究经医院医学伦理委员会审核通过。
1.2 RT-PCR技术检测患者外周血miR-34、miR-221水平
研究组于入组时无菌采集静脉血3 ml于真空管中,对照组于体检时空腹采集静脉血3 ml。分离上清保存于RNAse-free的EP管中,-80 ℃低温保存。采用SuperScript Ⅳ Reverse Transcriptase逆转录试剂盒(美国Thermo Fisher公司)合成cDNA模板,使用紫外分光光度计检测,A260/A280在1.8~2.0说明样本合格可用于后续试验,cDNA模板保存于-80 ℃。使用Primer Premier 6.0软件设计引物序列,采用SYBR Green qPCR MasterTM试剂盒(美国Thermo Fisher公司)进行PCR检测。包括上、下游引物各0.5 μl、10 μl Mixima SYBR Green qPCR Master Mix(2×)、模板cDNA 1 μl,加入ddH2O至总反应体系为20 μl。反应条件为95 ℃预变性30 s,95 ℃ 30 s、54 ℃ 60 s、72 ℃退火延伸60 s,共40个循环。以U6为内参,采用2-∆∆Ct法测定计算miR-34、miR-221的相对表达量。所有引物均委托上海生工生物公司合成,引物序列为miR-34:F:5’-GCCCTGGCAGTGTCTTAA-3’,R:5’-CAGTGCGTCGTGGAGT-3’;miR-221:F:5’-GCTCATCAGCTGACTCACAG-3’,R:5’-ACATGCGAAGAATATTAG-3’。
1.3 统计分析
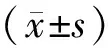
2 结果
2.1 2组外周血miR-34、miR-221水平比较
研究组外周血中miR-34水平明显低于对照组(P<0.001),而外周血中miR-221水平较对照组相比明显升高,差异具有统计学意义(P<0.001),见表1。

表1 2组外周血miR-34、miR-221水平比较
2.2 外周血miR-34、miR-221水平与MM病理资料的关系
MM患者外周血中miR-34、miR-221水平与患者性别、肿瘤病理类型无关(P>0.05),但和患者年龄、肿瘤分期、有无淋巴结转移及肿瘤分化程度相关(P<0.05),见表2。

表2 外周血miR-34、miR-221水平与MM患者临床病理资料的关系
2.3 外周血miR-34、miR-221水平对多发性骨髓瘤的诊断价值
外周血中miR-34水平诊断MM的AUC为0.784(95%CI:0.588~0.863),而外周血中miR-221水平诊断MM的AUC为0.852(95%CI:0.694~0.915),而联合诊断AUC为0.915(95%CI:0.815~0.999),明显高于单项,差异具有统计学意义(P<0.001),见表3。

表3 外周血miR-34、miR-221水平对多发性骨髓瘤的诊断效能评估
2.4 外周血miR-34、miR-221水平与MM患者预后的关系
采用门诊、电话、微信等方式对MM患者进行随访,患者出现死亡或随访时间截止2019年8月终止随访,随访间隔3个月,所有死亡患者死因均为MM进展、转移或并发症。41例MM患者存活22例,死亡18例,失访1例,36个月生存率为53.66%。采用Kaplan-Meier生存曲线对患者预后进行分析,发现外周血中miR-34高表达患者生存率高于低表达患者(P<0.05),而外周血中miR-221高表达患者生存率低于低表达患者(P<0.05),见图1。
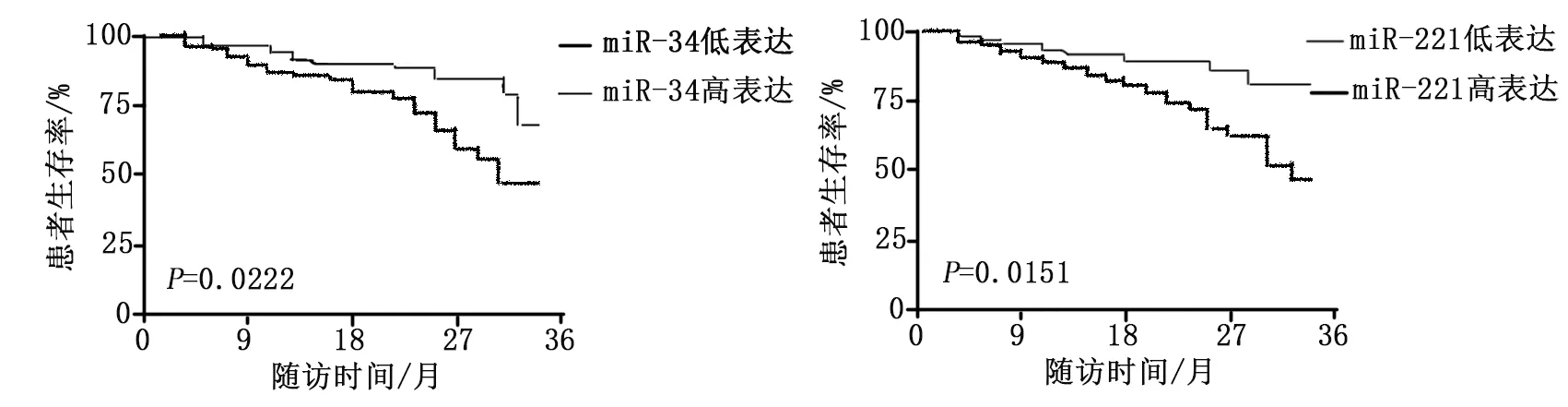
图1 外周血miR-34、miR-221水平与患者生存率的关系
3 讨论
miR-34是最早被发现的一种抑瘤miRNA,是p53抑癌基因的直接转录靶点[10],其表达异常与多种肿瘤疾病相关。本研究结果显示MM患者外周血中miR-34表达水平明显降低,且miR-34水平与患者肿瘤病理分期、肿瘤分化程度和有无淋巴结转移相关,外周血中miR-34高表达患者生存率高于低表达患者。miR-34低表达MM患者常为肿瘤低分化、恶性程度高且伴随肿瘤转移,这可能与患者预后不良相关。许多恶性肿瘤的发生伴随miR-34表达水平下降[11],如乳腺癌患者肿瘤细胞中miR-34表达水平降低与患者发生化疗耐药相关,而转染miR-34后的乳腺癌细胞对多柔比星、多西他赛、环磷酰胺等化疗药物敏感性升高[12];前列腺癌患者血清miR-34水平下降通常预示患者疾病进展和预后不良的发生[13];而miR-34高表达能够抑制老年鼻咽癌患者肿瘤的生长和浸润[14]。研究发现miR-34能够通过抑制Bcl-2基因的表达、抑制高迁徙率族蛋白-1(HMGB-1)、调控肿瘤干细胞的更新增殖能力等方式增强肿瘤对化疗药物的敏感性[15-16]。miR-34还可以促进周期蛋白依赖性激酶(Cyclin dependent kinase,CDK)4/6的表达,调控细胞周期的稳定[17],同时miR-34通过调控AXL、PDGFR-α/β等基因抑制肿瘤细胞的转移和侵袭[18]。最近的研究指出miR-34参与调控糖代谢途径,通过作用于乳酸脱氢酶A(lactate dehydrogenase A,LDHA)抑制肿瘤生长[15]。而miR-34表达水平降低使其对肿瘤的抑制作用减弱,有利于肿瘤疾病的进展,与本研究得出的结果一致。
miR-221在肝癌、结肠癌、卵巢癌等多种肿瘤表达水平升高[19],研究表明miR-221通过调控p27、CDKN1C/p57基因调控肿瘤的发生发展[20]。已有研究证实卵巢癌患者组织中miR-221表达水平升高,且与患者肿瘤分期和疾病进展有关[21],而乳腺癌细胞在乏氧条件下细胞内miR-221高表达有利于肿瘤的转移和侵袭[22],而国内学者的研究发现miR-221通过下调抑癌基因PTEN的表达促进肿瘤耐药的发生[23]。本研究结果显示MM患者外周血中miR-221表达水平明显升高,且与患者肿瘤分期、分化程度和有无转移相关,外周血中miR-221高表达的患者死亡率较高,研究结果与文献报道相符。有研究报道miR-221通过靶向抑制p53基因促进肿瘤的生长[24],但相关机制尚不明确。
本研究还发现外周血中miR-34水平诊断MM的AUC为0.784,而miR-221水平诊断MM的AUC为0.852,联合诊断AUC为0.915,提示miR-34、miR-221水平均对MM具有诊断价值,而联合诊断效能最高。研究表明多种miRNA水平的变化与疾病相关[25],故外周血中miR-34、miR-221水平可能作为MM诊断和预后的相关指标发挥临床作用。
综上所述miR-34在MM患者外周血表达下降,低表达的MM患者生存率较低;而miR-221在MM患者外周血表达上升,高表达的MM患者生存率较低。外周血miR-34、miR-221水平对早期诊断MM具有一定价值,联合诊断效果最佳。但由于本研究样本量较少,且仅对外周血中miRNA水平进行研究,结果可能存在一定的偏倚,需要在后续的研究中加以补足。

