蚯蚓匀浆上清液对猪场常见有害菌的抗菌效果
杨悦妍,莫奕豪,田佳敏,金翔,贾立明,蒲蕾,通信作者
蚯蚓匀浆上清液对猪场常见有害菌的抗菌效果
杨悦妍1,莫奕豪1,田佳敏1,金翔1,贾立明2,蒲蕾1,通信作者
(1.天津农学院 动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300392;2.天津贾立明蚯蚓养殖有限公司,天津 301500)
随着无抗生素饲料添加剂时代的到来,无抗饲料或替代抗生素饲料的研发成为了目前研究的热点。蚯蚓本身即为优质的蛋白质饲料,而且中医认为蚯蚓具有多项治疗疾病的功效。为确定蚯蚓匀浆液上清液对猪场分离的大肠杆菌、金黄色葡萄球菌、链球菌以及副猪嗜血杆菌这几种常见有害菌的抗菌效果,运用纸片扩散法(K-B法)与紫外分光光度法研究蚯蚓体匀浆处理液的抗菌性能。经纸片扩散法研究发现蚯蚓匀浆液上清对大肠杆菌、金黄色葡萄球菌、链球菌以及副猪嗜血杆菌均有不同程度的抗菌效果;最浓的蚯蚓匀浆液上清(蚯蚓与水的比例为2∶1)对大肠杆菌具有抗菌效果;蚯蚓匀浆液上清液对金黄色葡萄球菌具有较为明显和广谱的抗菌效果;蚯蚓与水的比例为4∶5时对链球菌和副猪嗜血杆菌的抗菌效果明显。液体培养的紫外分光光度试验表明:两种处理对大肠杆菌、金黄色葡萄球菌及链球菌有不同程度的抗菌效果;蚯蚓匀浆液2效果更为明显; 24 h后,蚯蚓匀浆上清液的抗菌优势完全消失。本研究表明,蚯蚓匀浆上清液对猪场常见有害菌具有一定抗菌性,可为蚯蚓相关新型饲料原料开发提供理论依据。
蚯蚓;匀浆上清液;纸片扩散法(K-B法);紫外分光光度计法;抗菌
随着无抗生素饲料时代到来,在保证畜禽健康前提条件下,如何提高动物的生产性能成为了目前养殖行业研究的热点。蚯蚓为一种生活在潮湿并充满大量微生物环境中以腐败有机物为食的腐生生活动物,其具有在感染病菌的情况下大量合成抗菌肽类物质的能力并且能阻止病原对其继续侵染[1-2]。蚯蚓的抗菌肽被证实具有一定的抗菌、抗病毒功能,有研究称蚯蚓具有解热退热、镇痛、抗哮喘、促进伤口愈合等作用[3]。李曾夏子等人曾通过蚯蚓抗菌肽及兔巴氏杆菌的体外试验,证实其对兔巴氏杆菌具有抗菌作用,并且经一定处理后对兔巴氏杆菌病的治愈率可达100%,这为医药兽药行业发展提供了新思路[4-5]。蚯蚓不仅具有诸多治疗、抗菌、抗病毒功能,还具有非常高的动物蛋白[6]。蚯蚓廉价易得,且与猪场常见抗生素类饲料添加剂(如土霉素、喹乙醇等)相比更为安全健康,适合用于饲料添加以替代抗生素饲料添加剂。蚯蚓的种种功效受到人们关注,但目前人们对蚯蚓体自身抗菌性能及相关应用研究还相对较少。以往的研究者利用化学试剂、电击等方式刺激蚯蚓,使其将含有抗菌肽类物质的黄色液体分泌到体表,进行其他预处理,再进行抗菌试验,操作起比较复杂且对蚯蚓做了过多刺激[7-9]。本试验避免使用物理刺激或化学试剂添加,通过匀浆和离心等简易操作,得到含有抗菌肽类物质的蚯蚓匀浆上清液,利用纸片扩散法(K-B法)和紫外分光光度计法测其OD值,确定其对几种猪场常见有害菌(如大肠杆菌、金黄色葡萄球菌等)的抗菌效果及影响因素,以便于日后在畜牧场规模化应用。
1 试验材料与方法
1.1 试验材料
蚯蚓:粪基料中饲养的大平二号蚯蚓。
菌种:大肠杆菌();金黄色葡萄球菌();链球菌();副猪嗜血杆菌()。
仪器:DSX-280B型高压蒸汽灭菌锅;AX224ZH型电子天平;GZX-9240 ME型鼓风干燥箱;HZQ-F100型振荡培养箱;TGL-16B型高速台式离心机;SW-CJ-2F型超净工作台;TP-24型Tissue Prep快速组织细胞破碎仪;热空气消毒箱;恒温培养箱;UV-5100B紫外可见分光光度计。
1.2 蚯蚓匀浆上清液的获得
取10 g大平二号蚯蚓用流水冲洗并排粪10 h。再用PBS缓冲液、无菌蒸馏水反复冲洗蚯蚓表面。将蚯蚓按不同比例加入蒸馏水稀释,蚯蚓与蒸馏水的稀释比例由浓到稀依次为:(2∶1)、(1∶1)、(4∶5)、(1∶2)、(4∶25)、(2∶25)。稀释完毕后装入2 mL离心管中,在离心管中放入适量磁珠后启动快速组织细胞破碎仪使蚯蚓均匀成浆。再放入高速离心机调至4 000 r/min,20 min后,取离心后的上清液备用。
1.3 纸片扩散法(K-B法)试验方法
将灭菌、烘干后的待用药敏片浸泡于装有各浓度蚯蚓匀浆上清液的离心管中。再将这些离心管放入振荡培养箱中调至160 r/min,震荡2 h使其充分浸泡。浸泡后将离心管取出放置于超净工作台,用镊子将药敏片夹出平贴于干燥培养皿,注意不同药敏片之间的距离,做好标记后放入37 ℃培养箱内12~15 h,烘干备用[10]。
将制作好的药敏片紧贴于待测菌种所在培养基上,此时也要注意不同种药敏片间要保留一定距离,避免互相干扰。放入37 ℃恒温培养箱中培养24 h,并分别在培养的第6、12、24小时,使用游标卡尺测量其抑菌圈直径大小,试验3次,每次测量3次取平均值。
1.4 紫外分光光度计试验方法
将10 g大平二号蚯蚓按上述方法制作匀浆上清液备用,蚯蚓匀浆液稀释比例为1∶1和1∶4。将待用菌种放入摇床活化2 h,待其接近对数生长期菌液时,取0.5 mL加入到20.0 mL液体培养基中混合(下文直接称为菌液),再分别加入已制备比例为1∶1的蚯蚓匀浆上清液(蚯蚓匀浆液1)和比例为1∶4的蚯蚓匀浆上清液(蚯蚓匀浆液2)0.82 mL。各种菌操作步骤同上并做好标记以区分,放入振荡培养箱中温度调至37 ℃培养24 h。将不同菌的不同处理分组并在培养的第0、6、12、24小时利用紫外可见分光光度计测其OD值,测量前将其摇匀,测量时吸光度调至540 nm[11]。
1.5 数据分析
1.5.1 药敏片抑菌圈直径大小分析方法
先测得放入37 ℃恒温培养箱后的第6、12、24小时时,蚯蚓匀浆上清液对各菌种产生的抑菌圈直径大小后,再将所有重复试验的数据进行汇总整理。并计算其平均值及标准差后再对数据进行分析。
1.5.2 紫外分光光度计OD值计算抑菌率方法
将数次试验下各组所测得数据在Excel中进行归纳整理:行标题分别为对照组和各种菌组别的不同处理,列标题为0 h、6 h、12 h、24 h四个测量时间。将不同处理所对应的OD值填入并进行整理,分别用6 h、12 h、24 h与0 h对应数据作差(尽可能排除液体本身颜色对试验数据的影响)。再利用以下公式计算抑菌率[11]:抑菌率=(对照组OD值-试验组OD值)/(试验组OD值)×100%。
2 结果
2.1 纸片扩散法(K-B法)
2.1.1 蚯蚓匀浆上清液对大肠杆菌抗菌效果
蚯蚓与蒸馏水稀释比例最浓(比例为2∶1)的药敏片不论何时测量周围均有抑菌圈形成,而其他稀释比例(1∶1、4∶5、1∶2、4∶25、 2∶25)下的处理组并无抑菌圈。且比例为2:1的处理组在第一次测量(6 h)时就有明显的抑菌圈10.63 mm,且之后的几次测量均可测出明显抑菌圈直径。即蚯蚓抗菌肽对大肠杆菌有抗菌效果,且蚯蚓匀浆上清液的比例越大对其抗菌效果越明显(表1,图1)。

表1 蚯蚓匀浆上清液对大肠杆菌抑菌圈大小 mm
注:药敏片的直径为6 mm,下同
2.1.2 蚯蚓匀浆上清液对金黄色葡萄球菌抗菌效果
通过试验发现,稀释比例为2∶1的处理组在培养6 h就已有抑菌圈产生,第12、24小时测量时,抑菌圈消失;稀释比例为1∶1的处理组在培养12 h时测量出抑菌圈,并随着培养时间增加抑菌圈直径大小也增加;比例为4∶5的处理组在培养12 h时观察到有抑菌圈形成,12 h、24 h时其抑菌圈大小几乎无变化;1∶2比例的处理组在培养24 h测量出明显的抑菌圈,其直径为15.30 mm;4∶25、2∶25比例的药敏片在24 h内的3次测量中均无抑菌圈形成(表2,图2)。

表2 蚯蚓匀浆上清液对金黄色葡萄球菌抑菌圈大小 mm
2.1.3 蚯蚓匀浆上清液对链球菌抗菌效果
蚯蚓与蒸馏水稀释比例为4∶5的处理组在培养6 h时可测量到抑菌圈直径,而12 h、24 h测量无抑菌圈;2∶25比例处理组在第6小时可观察到明显抑菌圈。其余处理(2∶1、1∶1、1∶2、4∶25)并无抑菌圈产生(表3,图3)。

表3 蚯蚓匀浆上清液对链球菌抑菌圈大小 mm
2.1.4 蚯蚓匀浆上清液对副猪嗜血杆菌抗菌效果
从表4、图4可以看出,蚯蚓抗菌肽对副猪嗜血杆菌有抑制作用。稀释比例为4∶5的处理组在培养的第6小时可测得抑菌圈;4∶25的处理组在第三次(24 h)观察时才能测量到抑菌圈直径。其他比例 (2∶1、1∶1、1∶2、2∶25)并无抑菌圈形成。
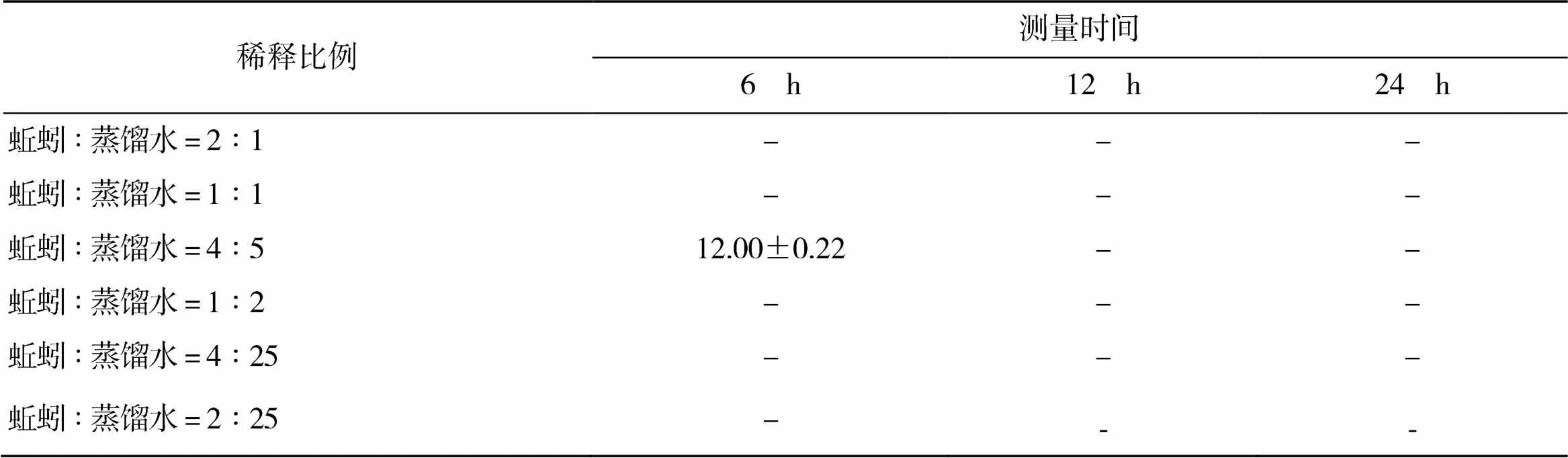
表4 蚯蚓匀浆上清液对副猪嗜血杆菌抑菌圈大小 mm
2.2 紫外分光光度计测抑菌率
2.2.1 蚯蚓匀浆液1对3种菌在不同培养时间及处理下的抑菌率
蚯蚓匀浆液1处理组对大肠杆菌并无抗菌效果。蚯蚓匀浆液1处理组对金黄色葡萄球菌出现抗菌效果的时间大致在培养的第6小时到12小时之间,12 h能直接测出其抑菌率,之后抗菌效果逐渐减弱,24 h测量时无抗菌效果。蚯蚓匀浆液1处理组对链球菌并无抗菌效果。

表5 蚯蚓匀浆液1对3种菌在不同培养时间及处理下的抑菌率
2.2.2 蚯蚓匀浆液2对3种菌在不同培养时间及处理下的抑菌率
蚯蚓匀浆液2处理组在第一次测量时就对大肠杆菌表现出一定的抗菌效果,这种效果随时间增长而减弱。蚯蚓匀浆液2处理组在第6小时测量时对金黄色葡萄球菌表现出抗菌效果,但在12 h 之后测量并无抗菌效果,12 h时变化较大。蚯蚓匀浆液2处理组在首次(第6小时)测量时无抗菌效果,在第12小时测量反映出其对链球菌具有抗菌效果,但在第24小时测量时抗菌效果消失。

表6 蚯蚓匀浆液2对3种菌在不同培养时间及处理下的抑菌率
3 讨论
在纸片扩散试验中测得大平二号蚯蚓匀浆上清液中的抗菌成分对猪场常见金黄色葡萄球菌、大肠杆菌、链球菌、副猪嗜血杆菌的生长均有抑制作用。但刘艳琴等试验表明,用5 V电压电刺激蚯蚓后收集到的分泌液对大肠杆菌并无抑制作用,与本试验所得结果相悖[8]。这种差异可能是由所选的蚯蚓环境来源不同,在恶劣环境胁迫下抗菌性能也不同造成的[12]。或是蚯蚓体内抗菌成分提取方式的差异,导致其对同种菌的抑制作用不同,且匀浆液中的抗菌物质对不同菌种的抗菌作用也具有选择性[13-14]。此外,在菌种号的选取上有所差异也会导致试验结果略有不同。刘兵等在蚯蚓对大肠杆菌的抗菌效果研究中发现,经大肠杆菌菌液诱导(抑菌圈直径最大为18 mm)及电刺激(抑菌圈直径最大为20 mm)后所得的抗菌物质对大肠杆菌的抗菌效果要优于本试验所得结果(抑菌圈最大直径为10.63 mm)[9]。但本试验中所用的含抗菌物质的蚯蚓匀浆上清液较上述研究中的处理更为方便,无需电击、化学试剂添加等步骤,达到的抗菌效果也可观,可试用于兽药中来防治一些常见细菌类疾病,或增强畜禽自身的抗菌能力。
本试验大多数处理组在培养24 h后所测得的抑菌圈直径缩小或消失。出现这一现象的原因可能是,抗菌类药物的半衰期长短不同,如青霉素类药物T1/2(半衰期)为0.5~1.0 h;头孢菌素类多数T1/2为1.0~2.0 h、氨基糖苷类药物T1/2约为2.0~4.0 h,在临床应用时会严格按照标准的给药间隔来维持药物在体内的浓度以达到抗菌效 果[15-18]。王升兰等曾测过一种抗菌肽的半衰期,用ELISA法测得为1.5 h,同位素示踪法测得为6 h[19]。本试验中所用的蚯蚓匀浆上清液为多肽物质,成分多种且复杂,其抗菌性能会在短期内失效造成抑菌圈变小(试验中个别浓度下在12 h时就已失效),推断为半衰期较短所致。
在纸片扩散试验中抗菌效果出现了两种情况:蚯蚓匀浆上清液多种浓度均对金黄色葡萄球菌及链球菌产生了抗菌效果,但抑菌圈直径大小与其他菌相比差别较小;大肠杆菌及副猪嗜血杆菌对浓度的选择性更高,只有几种浓度能对其产生抗菌作用,但其所得的抑菌圈直径较其他三种菌更大。单安山等介绍了抗菌肽抗菌机制之一,即为细菌的细胞膜或细胞壁,抗菌肽会通过对细菌的细胞壁进行破坏从而达到抗菌的效果[20]。故推测此现象可能是由于构成革兰氏阳性菌及革兰氏阴性菌的细胞壁成分差异所致。
利用紫外分光光度计法确定蚯蚓匀浆液对大肠杆菌、金黄色葡萄球菌、链球菌的抗菌效果与纸片扩散法所测得的结果相匹配,前者相对后者所得的结果更精准。潘卫东等曾利用分光光度计法测培养24 h后加有蚯蚓抗菌成分物质及金黄色葡萄球菌液液体培养基的分光光度值,得出了对金黄色葡萄球菌有明显抗菌效果的结果(<0.01)[21]。但在本试验中,24 h时测量出的结果为并无抗菌效果。通常在培养24 h时多数细菌生长处在平台期或衰退期,例如何岚等对大肠杆菌的生长曲线进行测量,在20 h左右其进入衰退期[22]。因为上述提及的蚯蚓抗菌肽的半衰期较短,对此时的抗菌效果造成了影响,所以测量后并无抗菌效果。所选用的蚯蚓品种有所差异,其体内的抗菌肽成分的不同也会造成此结果的差异。另外,通过纸片扩散法的结果也可看出,多数处理在第24小时时已经逐渐失效,与分光光度计测得的结果相匹配。
抗生素饲料添加剂滥用,造成环境污染,导致多种细菌产生耐药性以及产生食品安全方面的问题。在抵制抗生素饲料添加剂阶段,探索抗生素饲料添加剂的替代品成为目前的一个新目标。蚯蚓及其衍生产品均蕴藏着丰富的应用价值,其应用价值不仅局限在环境污染治理、生物催化、保健品等方面,在养殖和医疗方面也极具潜力、前景较好[23-24]。在诸多研究中曾证实蚯蚓抗菌肽应用到实际畜禽生产中,提高了畜禽的日增重、降低了畜禽的患病率、减少了养殖场的饲养成本[25-26]。蚯蚓匀浆液具有较为广谱的抗菌作用,但纸片扩散法和紫外分光光度计法都反映出抗菌效果与菌量和蚯蚓匀上清液中抗菌肽半衰期长短有关。若将蚯蚓匀浆上清液应用到畜禽生产中,则要考虑饲养环境中的杂菌数远大于实验室环境中菌量的情况,其抗菌效果会有所影响,可在保证浓度的前提下加大蚯蚓匀浆上清液使用量。另外,可采取给动物多次喂食蚯蚓匀浆上清液的方式,保持其在动物体内的浓度处于稳定状态以达效果。本试验所用的蚯蚓匀浆上清液为一种廉价易得、制备简单、具有效抗菌性且无毒害的物质,其替代抗生素饲料添加剂的可能性及发挥的作用和实际达到的效果都有很大的研究价值。
4 结论
蚯蚓匀浆上清液对大肠杆菌、金黄色葡萄球菌、链球菌以及副猪嗜血杆菌均具有抗菌作用,不同菌种对蚯蚓匀浆上清液浓度的选择性不同,而且对其抗菌作用的程度不同。蚯蚓匀浆上清液的抗菌效果具有半衰期短、抗菌较广谱的特点。根据蚯蚓匀浆上清液的这些特点,可在畜禽饲养及医疗等方面加以利用。
[1] 金光.昆虫抗菌肽[J].生物学教学,2008,33(3):70-71.
[2] 杜明亮,李成会.蚯蚓抗菌肽的研究进展[J].唐山师范学院学报,2014(2):49-51.
[3] 吴龙秀,李仲培,方其仙.蚯蚓的药用价值及养殖方 法[J].现代农业科技,2011(22):327-332.
[4] 李曾夏子,刘智连,李文平.蚯蚓提取液对兔巴氏杆菌病的治疗效果[J].动物医学进展,2009,30(8):66-69.
[5] 刘志贞,康慧芳,樊慧杰,等.蚯蚓体腔液抗病毒活性及其机制的研究[J].现代预防医学,2008(6):1132- 1134.
[6] 吴泽宇,孙晋民,王俭,等.蚯蚓提取物作用的研究进展[J].山西医药杂志,2015(13):1505-1507.
[7] 张显忠,张欣然,武晓雯,等.蚯蚓体内外分泌液的抗菌活性研究[J].安徽农业科学,2018(13):95-97.
[8] 刘艳琴,王东辉,孙振钧.蚯蚓体腔液及粗组分体外抑菌特性[J].家畜生态学报,2004,25(4):51-54.
[9] 刘兵,夏先林,施晓丽.蚯蚓体腔液对大肠杆菌抑菌效果试验[J].黑龙江畜牧兽医,2018(11):92-93.
[10] 孙丽蓉,李芳萍,康宏昌,等.兽用药敏片的制作和应用[J].黑龙江畜牧兽医,2001(5):24-25.
[11] 杨少通,贺盼盼,罗敏.不同类型敷料的抑菌效果研究[J].转化医学电子杂志,2017,4(12):30-33.
[12] 鲁耀雄,崔新卫,陈山,等.牛粪预处理对蚯蚓堆肥生物学特性和养分含量的影响[J].江西农业学报,2019,31(4):39-45.
[13] 郝荣超,王国华,孙茂红,等.蚯蚓抗菌肽的抑菌性及其在猪生产中的应用[J].今日畜牧兽医,2016(1):35-36.
[14] 樊慧杰.蚯蚓体腔液及脱氧核糖核酸酶的抑菌机制研究[D].山西:山西医科大学,2008.
[15] 胡皓夫.抗生素静脉给药的间隔时间问题[J].中国实用儿科杂志,1998(1):39-40.
[16] 孙向飞,李娇,苟静,等.常用抗菌药的半衰期、达峰时间及合理使用分析[J].中国实用医药,2008(12):185-187.
[17] 梁军林.抗菌药物半衰期与临床合理用药[J].健康大视野,2018(6):56.
[18] 包英兰.抗菌药物半衰期与临床合理用药[J].医药前沿,2017,7(1):345-346.
[19] 王升兰,李小芳,王西勇,等.两种方法测量抗菌肽大鼠体内血药浓度的结果比较[J].东南大学学报(医学版),2011,30(3):427-431.
[20] 单安山,田昊天,邵长轩,等.抗菌肽抗细菌机理研究进展[J].东北农业大学学报,2018,49(3):84-94.
[21] 潘卫东,刘向辉,戈峰.赤子爱胜蚯蚓体液中几种抗菌成分的比较研究[J].中国生化药物杂志,2004,25(24):199-202.
[22] 何岚,王柳懿,朱琪,等.两种绘制枯草芽孢杆菌和大肠杆菌生长曲线方法的比较[J].天津农业科学,2017,23(5):14-18.
[23] 孔凡真.蚯蚓在食品保健上的应用开发市场前景好[J].中国畜牧杂志,2000,36(1):54-55.
[24] 李志林,周海燕,官智.蚯蚓催化抗凝血药华法林及其衍生物的合成[J].有机化学,2017,37(6):1494-1500.
[25] 孙茂红,杨翠军,葛剑.蚯蚓抗菌肽在禽生产中应 用[J].今日畜牧兽医,2015(11):50-51.
[26] 李冬光,施晓丽.蚯蚓抗菌肽对贵州黄鸡生产性能的影响研究[J].饲料工业,2011,32(12):45-47.
Antibacterial activity of Earthworm homogenate supernatant on common harmful bacteria in pig farm
Yang Yueyan1, Mo Yihao1, Tian Jiamin1, Jin Xiang1, Jia Liming2, Pu Lei1,CorrespondingAuthor
(1.Tianjin Key Laboratory of Agricultural Animal Breeding and Healthy Husbandry, College of Animal Science and Veterinary Medicine, Tianjin Agricultural University ,Tianjin 300392, China 2.Tianjin Jia Liming Earthworm Breeding Co.Ltd., Tianjin 301500, China)
With the advent of the era of feed without antibiotics, the research and development of feed without antibiotics or alternative antibiotics has become a hot spot of current research.Earthworms are high-quality protein feed, and Chinese medicine believes that earthworms have a number of therapeutic effects.The aim of this study was to determine the antibacterial activity of earthworm homogenate on,,andfrom pig farm, with the antibacterial activity of earthworm homogenate treatment solution studied by Kirby-Bauer test(K-B)and ultraviolet spectrophotometry.The study showed that the supernatant of the earthworm homogenate had antibacterial effects on,,and.The highest concentration of earthworm homogenate supernatant with a ratio of earthworm to water of 2∶1 has antibacterial activity on.The supernatant of earthworm homogenate had obvious and broad-spectrum antibacterial activity effect on.The ratio of earthworm to water 4∶5 had obvious antibacterial activity onand.The spectrophotometric test showed that two different concentrations of supernatant of earthworm homogenate had different degrees of bacteriostatic effect oni,and.Earthworm homogenate 2 was more effective.24 hours later, the antibacterial advantage of earthworm homogenate supernatant disappeared completely.This study showed that the supernatant of earthworm homogenate has certain bacteriostasis to common harmful bacteria in pig farm, which can provide theoretical basis for the development of new feedstuffs related to earthworms.
Earthworm; homogenate supernatant; Kirby-Bauer test(K-B); ultraviolet spectrophotometry; antibacterial
1008-5394(2021)03-0075-06
10.19640/j.cnki.jtau.2021.03.016
Q93
A
2020-01-17
青海省重点研发与转化计划—科技援青合作专项(2021-QY-204);天津农学院大创项目(201810061234);天津生猪产业技术体系创新团队(ITTPRS2021006);天津市种业专项(15ZXZYNC00100)
杨悦妍(1998—),女,本科在读,主要从事猪遗传育种方面的研究。E-mail:854296484@qq.com。
蒲蕾(1987—),女,讲师,博士,主要从事猪遗传育种方面的研究。E-mail:pulei87@126.com。
责任编辑:张爱婷

