铝胁迫对酸性红壤古菌amoA 基因多样性的影响分析
尹 丽,刘仁绿`,廖永辉,宋勇生,贺根和10
(1.井冈山大学生命科学学院,江西,吉安 343009;2.江西省红壤丘陵区农业环境污染防控重点实验室,江西,吉安 343009)
在微酸性和中性土壤中,铝主要以三价氧化态和稳定的矿物质形式存在,随着土壤pH 的降低,铝以离子态释放到土壤溶液中,对土壤生物产生较强的毒害作用[1-2]。红壤分布于我国南方地区,铝含量较高。酸性沉降导致pH 下降和活性含量升高,pH 下降会导致土壤质量下降已是不争的事实[2]。然而,酸性沉降导致的土壤质量的下降是pH 改变直接导致的结果,还是由于铝对作物或者微生物的毒性导致的结果呢?以酸性红壤作为研究对象,研究铝对植物生长影响已有大量的报道[3]。铝对红壤微生物影响的研究报道较少。我们前期研究表明,当土壤中活性铝含量增加时,土壤细菌和真菌的数量、活性及种群结构均会发生改变[2,4],说明铝胁迫可以通过改变土壤微生物的行为而影响土壤质量。
氨氧化是全球氮循环的关键过程,主要通过硝化作用完成。硝化作用是微生物将氨转换成硝酸盐的过程,其中氨氮氧化成亚硝酸盐是硝化作用的限制性步骤,起直接作用的酶是氨单加氧酶(ammonium monooxygenase,AMO)[6]。近年来,国内外学者利用amoA 基因作为标记,从分子水平上研究环境样品中氨氧化菌的种群特征和系统发育状况[5]。近年来,越来越多的研究结果发现泉古菌(Crenarchaeota)具有很强的氨氧化能力,这群独特的微生物迅速吸引了人们的目光,成为一个新的研究热点[7-8]。
红壤区是我国主要的粮食产区,壤中的碳、氮和磷等是影响土壤肥力和植物生长发育的重要营养元素[9]。然而,土壤酸化导致活性铝含量的升高对古菌种群影响的研究报道较少。本实验以红壤地区典型的农田土壤和森林土壤为研究材料,应用古细菌amoA 基因克隆文库技术分析不同铝浓度胁迫下红壤氨氧化古菌群落结构组成情况。通过研究酸性土壤中氨氧化古菌的多样性,对开发利用红壤中丰富的微生物资源以及理解酸性沉降对氨氧化古菌的多样性的影响提供参考依据,并为进一步研究我国酸性土壤地区微生物生态系统提供重要参考。
1 材料和方法
1.1 样品收集
以红壤丘陵区森林土壤(Forest soils,FOR)和农田土壤(Agriculture soils,AGR)为研究对象,森林土壤样品取自江西省井冈山海拔83 m 处的常绿阔叶林(27°06ˊN,115°01ˊE),试验区属于温和的亚热带季风气候,雨水充沛,四季分明;农田土壤从距森林边缘不超过200 m 的农田中采集。土样采用五点法收集0-20 cm 的土层。样品取好后用封口袋封装带回实验室,一部分土样贮藏在4℃的冰箱中备用;一部分风干、磨碎后通过2 mm 筛后,供土壤理化特性分析,土壤的基本理化特性见表1。
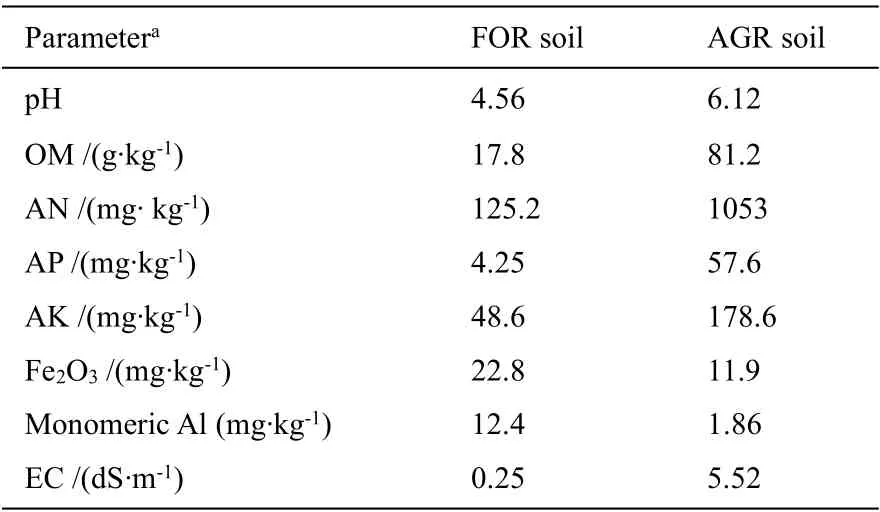
表1 土壤基本理化特征Table 1 The basic physicochemical properties of studied soils
1.2 实验设计
将100 g 土壤样品置于250 mL 的锥形瓶中,调节土壤含水量为田间持水量的60%,将土壤置于28℃的人工气候箱中预培养1 周。1 周后将铝(AlCl3·6H2O)加入土壤,添加Al3+的浓度分别为0、100、200 mg·kg-1(干土),铝加入后充分混合,置于28℃的人工气候箱中温育,保持如上的土壤水分含量。被测土壤分别标记为F0(森林土,加ddH2O),F100(森林土,100 mg·kg-1Al3+),F200(森林土,200 mg·kg-1Al3+)和A0(农田土,加ddH2O),A100(农田土,100 mg·kg-1Al3+),A200(农田土,200 mg·kg-1Al3+)。所有的实验均设3 个重复,分别培养后在第30 d 从锥形瓶中取样进行分析。
1.3 菌株、培养基与试剂
大肠杆菌(Escherichia coli)DH5α、pMD18-T Vector、氨苄青霉素和DNA回收试剂盒均购自生工生物工程(上海)股份有限公司;PCR引物由上海生工合成。
1.4 DNA 提取
DNA 提取按Ezup 柱式土壤DNA 抽提试剂盒的方法进行,试剂盒购自生工生物工程(上海)股份有限公司。
1.5 古细菌amoA 基因PCR 扩增
采用氨氧化细菌特异性用于扩增古细菌amoA基因。引物为Arch-amoAF:5’-STAATGGTCTGGCTTAGACG-3’,Arch-amoAR’-GCGGCCATCCATCTGTATGT-3’。扩增反应体系为:10×buffer 缓冲液5 µL,dNTP(25 mmol/L)2µL,引物21F(10 pmol/µL)lµL,引物 958R( 10 pmol/µL) l µL,模板 (基因组DNA)4µL,Taq DNA 聚合酶(5U/µL)0.5µL,双蒸水36.5µL,总体积50µL。扩增条件:94℃预变性5min:94℃变性30 s,53℃复性45 s,72℃延伸45 s, 最后72℃延伸10 min。
5µL PCR 扩增产物用1.0%琼脂糖凝胶(含溴化乙锭)电泳检测。PCR 产物纯化:用UNIQ-10 柱式DNA 纯化试剂盒对PCR 产物进行纯化,纯化产物和PMD18-T 质粒载体进行重组而后导入到大肠杆菌DH5α感受态细胞。
1.6 古细菌amoA 基因文库的构建
纯化后古细菌amoA扩增产物分别与pMD18-T 载体进行连接,条件为:pMD18-T 0.5µL,超纯水1.5µL,PCR 纯化产物3µL,Ligation Mix 5µL,16℃连接1.5 h,然后4℃过夜。连接产物转化大肠杆菌DH5α感受态细胞,随机选择大约150 个阳性菌落进行菌体PCR 证实amoA 序列插入完成。PCR 引物 为M13F (5’-CGC CAG GGT TTT CCC AGT CAC GAC-3’) and M13R(5’- GAG CGG ATA ACA ATT TCA CAC AGG-3’)。接着6 个来自不同处理的土壤样品amoA 基因克隆文库创建完成(F0、F100、F200、A0、A100和A200),相应的克隆依次从1 到628 标记。
1.7 古细菌amoA 基因的RFLP(限制性片段多态性)分析
通过引物M13F/R PCR 筛选阳性克隆的产物分别用HhaI 和RsaI 两个限制酶消化(37 ℃,1 h)。酶切DNA 片段用2%的琼脂糖凝胶(H,上海生工)电泳分离,经SYBR Green I 染色和凝胶成像系统成像后, 所得DNA 带型图谱在GIS 凝胶分析软件辅助下进行人工比较。以基因片段多态图谱为基础进行聚类,聚合到一起的具有相同图谱的克隆需要用第2 种限制性内切酶进行消化与电泳分离。当第二次所获得的基因图谱仍然相同时,则认为它们是相同的基因型。每一个基因型作为一个分类操作单位(OTU, Operational Taxonomic Unit) 或称为唯一基因型[10]。选取每个OUT 中的代表克隆送上海生工测序。将序列上的载体序列去除并去除嵌合序列后,通过NCBI 序列分析工具Blast(www.ncb.nlm.gov/blast/blast.cgi)和RDP 聚类分析分类(RDP classifier,http://rdp.cme.msu.edu/),确定序列的种属特征。
1.8 数据统计分析
用文库总的克隆和OTU 数量计算文库的库容(C)[11]:
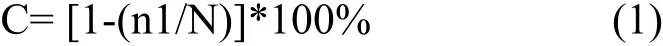
其中,代表在文库中仅出现一次的OTU 的数量,N为文库中总克隆数。
应用Mothur 聚类分析分析文库内种群的多样性指数(距阵小于或等于0.02)[12]。通过clustal X 2.0[13]and Mega 5.0[14]构建基于amoA基因序列的系统发育树。
2 结果
2.1 土壤DNA 的提取和古菌amoA 基因的扩增
从6 个土壤样品中提取DNA 并用巢式PCR 扩增古菌amoA rDNAs。提取的DNA 和PCR 扩增产物在1%(w/v) 琼脂糖电泳并通过凝胶成像系统拍照,所得产物片段大小与预期的大小一致(图1)。
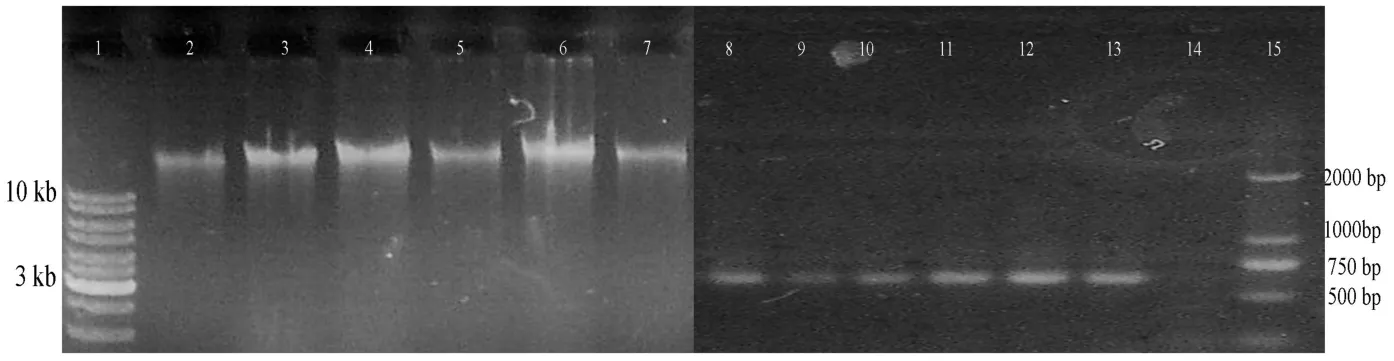
图1 土壤样品DNA(左)和amoA基因PCR产物(右)Fig.1 Soil DNA(Left)and PCR amplification of archaeon amoA gene fragments(Right)
2.2 古菌amoA 基因克隆文库的构建和PCR-RFLP 分析
从6 份DNA 样品的克隆文库中随机挑选628个白斑进行阳性检测,确定了602 个阳性克隆,阳性克隆率达到95.9﹪。将602 个amoA 基因克隆子PCR 鉴定产物用限制性内切酶RsaI 和HalI 酶切并进行多态性分析,65 个独特的OTU 被确定。从65个OTUs 中随机挑取1 个克隆子进行测序,序列去除含嵌合子后,确定了62 个独立的amoA 基因序列。Blast 和RDP 系统发育分析结果表明,62 个amoA 基因序列100%(62)属于Crenarchaeotes(泉古菌门),相似性为97-100%,分布于4 个基因族(Cluster1-4)(图2)。其中,Cluster 1 占38.7%(24),Cluster 2 占25.8%(16),Cluster 3 占14.5%(9),Cluster 4 占21.0%(13)。Cluster 1 氨氧化古菌在所有测试样品占比最多,其相对丰度在FOR 土壤分别达39.5%,40.0%和44.7%,在AGR 土壤分别达38.2%,42.9%和38.5%。Cluster 3 含量最低,在两种供试土壤中随着铝浓度变的差异性明显,在高铝浓度农田土中检测不到Cluster 3 的存在(表2)。
2.3 酸性土壤中铝胁迫对氨氧化古菌种群多样性的影响
所构建的6 个基因文库库容(C)从64.8%到81.1%(表3),文库库容值较大,覆盖程度较高,代表性较好,这表明文库能比较真实代表不同铝处理浓度下土壤样品中氨氧化古菌的多样性。从表3 可以看出氨氧化古菌的多样性明显受铝胁迫的影响。Shannon 和Simpson 指数值表明,铝浓度的提高会降低土壤氨氧化古菌多样性,却能在一定程度上提高其均匀度,而且铝胁迫对农田土壤的影响要高于森林土壤。A0土壤样品氨氧化古菌种群多样性最高,均匀度最低,相对更多的种群被发现于A0中。
3 讨论
氨氧化古菌广泛地分布于海洋和陆地土壤,对生态系统中氮素循环过程中发挥着重要作用。土壤酸化严重影响土壤质量,也影响着土壤氮素转化微生物的分布及特征[7-9]。同时,长期的环境胁迫会导致土壤微生物的多样性及功能发生了一些适应性改变[15]。我们前期的研究表明随着酸性红壤Al3+浓度的增大,土壤环境中真菌生长及数量会受到抑制,但也会产生一些耐受性强的优势种群[2]。目前,已有不少文献报道土壤氨氧化古菌的群落结构及相对丰度与土壤理化性质存在一定的相关性[6,16-17]。然而,酸性红壤中铝胁迫对氨氧化古菌种群结构变化的研究报道则较少。
分子生物学技术被认为是对土壤微生物种群丰度解析最有效的方法[18]。PCR-RFLP 扩增氨氧化古菌amoA 基因序列作为一种便捷的技术被广泛用于土壤氨氧化菌多态性的分析[19]。本研究表明,酸性红壤中分布的氨氧化古菌100%(62)属于Crenarchaeotes(嗜泉古菌界),这与目前多数研究的报道相一致。进一步通过Blast 分析发现酸性红壤中的氨氧化古菌分布于4 个基因族(Cluster1-4)(图2),而且在两种供试土壤中随着铝浓度的变化差异性明显,在高铝浓度农田土中检测不到Cluster 3 的存在(表3),说明农田土中存在的基因族Cluster 3 氨氧化古菌对铝的敏感性更强,抑或该族菌在农田土中多样性较低,相关的原因还需要进一步的深入研究。
酸性化肥的施用会导致稻田土壤酸化,在一定程度上会促进氨氧化古菌优势种群的生长,进化出对NH3具有较高亲和力的新种群,并能在酸性土壤中发挥主导作用[20]。本实验通过比较两种典型酸性土壤样品中氨氧化古菌多样性的差异,发现农田土壤和森林土壤所含的氨氧化古菌种群有所不同,农田土壤中氨氧化古菌具有较高种群丰度和多样性,在A0土壤样品的种群多样性最高,结果与上述研究结果具有明显一致性。我们进一步研究表明,随着铝胁迫浓度的增加,两种土壤中氨氧化古菌的丰度明显下降,农田土中氨氧化古菌对铝的胁迫表现得更为敏感,而且不同基因族(Cluster1-4)在不同土壤中表现出较大的差异(表3)。可见,农田土壤可能由于酸性肥料的施加,一定程度降低了土壤氨氧化古菌的多样性,同时还能在一定程度提高了其分布的均匀度和丰富度,其结果可能与种群的特异性有关,这能为高浓度铝胁迫下高耐性氨氧化古菌的分离鉴定提供了重要的理论依据。
4 小结
随着全球酸沉降的日益严重以及酸性肥料在农业中的大量使用,红壤丘陵区土壤富铝化作用加剧。铝毒可以通过影响土壤微生物的作用进而影响土壤生态功能,促进红壤提质增效势在必行。我们的研究表明,铝胁迫导致土壤氨氧化古菌群落结构改变,高铝胁迫下厌氧氨氧化菌也会发生适应性的转变;农田土壤由于酸性肥料的施用,氨氧化古菌群落分布受铝胁迫的影响大于森林土壤。

