固相萃取结合超高效液相色谱-质谱法测定畜禽肉及肉制品中肾上腺素和多巴胺的残留量
何亮娜 马俊美 范力欣 李强
摘 要:建立畜禽肉及肉制品中2 种儿茶酚胺类化合物(肾上腺素和多巴胺)的超高效液相色谱-质谱联用检测方法。样品采用10 mmol/L磷酸二氢钾溶液提取,WCX固相萃取柱净化,Waters Acquity BEH C18柱分离,采用电喷雾离子源,正离子多反应模式监测,基质匹配内标法定量。结果表明:肾上腺素和多巴胺在0.5~50 ng/mL范围内,相关系数(R2)均大于0.996;在畜肉中的检出限和定量限分别为0.39~0.40 μg/kg和1.00 μg/kg,在禽肉中的检出限和定量限分别为0.36~0.37 μg/kg和0.98 μg/kg,在肉制品中的检出限和定量限分别为0.38 μg/kg和0.96~0.97 μg/kg;加标量为1~10 μg/kg时,方法回收率为83.7%~111.2%,相对标准偏差为1.28%~5.76%。该方法具有灵敏度高、定量准确等优点,适用于畜禽肉及肉制品中残留儿茶酚胺类化合物含量的测定。
关键词:固相萃取;超高效液相色谱-质谱法;畜禽肉及肉制品;儿茶酚胺
Determination of Epinephrine and Dopamine Residues in Meat and Meat Products by Solid Phase Extraction Combined with Ultra-High Performance Liquid Chromatography-Mass Spectrometry
HE Liangna, MA Junmei, FAN Lixin, LI Qiang*
(Hebei Food Safety Key Laboratory, Hebei Food Inspection and Research Institute, Shijiazhuang 050299, China)
Abstract: An ultra-high performance liquid chromatography-mass spectrometry (UPLC-MS) method was established for the detection of the residues of two catecholamine compounds (epinephrine and dopamine) in meat and meat products. The samples were extracted with 10 mmol/L phosphate buffer solution, and the extract was purified on a WCX solid phase extraction column, and separated on a Waters Acquity BEH C18 column. The analytes were detected using an electrospray ion source in the positive ion multiple reaction monitoring (MRM) mode, and quantified by a matrix matched internal standard method. The results showed that the calibration curves for epinephrine and dopamine were linear in the concentration range of 0.5–50 ng/mL with correlation coefficient (R2) greater than 0.996. The limits of detection and limits of quantification were 0.39–0.40 and 1.00 μg/kg for livestock meat, 0.36–0.37 and 0.98 μg/kg for poultry meat, and 0.38 and 0.96–0.97 μg/kg for meat products, respectively. At spiked concentrations of 1–10 μg/kg, the recoveries of the method were between 83.7% and 111.2%, and the precision relative standard deviation (RSD) was 1.28%–5.76%. This method has the advantages of high sensitivity and accuracy, and is suitable for the determination of residual catecholamine compounds in meat and meat products.
Keywords: solid phase extraction; ultra-high performance liquid chromatography-mass spectrometry; meat and meat products; catecholamine
DOI:10.7506/rlyj1001-8123-20210422-107
中圖分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2021)09-0027-06
引文格式:
何亮娜, 马俊美, 范力欣, 等. 固相萃取结合超高效液相色谱-质谱法测定畜禽肉及肉制品中肾上腺素和多巴胺的残留量[J]. 肉类研究, 2021, 35(9): 27-32. DOI:10.7506/rlyj1001-8123-20210422-107. http://www.rlyj.net.cn
HE Liangna, MA Junmei, FAN Lixin, et al. Determination of epinephrine and dopamine residues in meat and meat products by solid phase extraction combined with ultra-high performance liquid chromatography-mass spectrometry[J]. Meat Research, 2021, 35(9): 27-32. DOI:10.7506/rlyj1001-8123-20210422-107. http://www.rlyj.net.cn
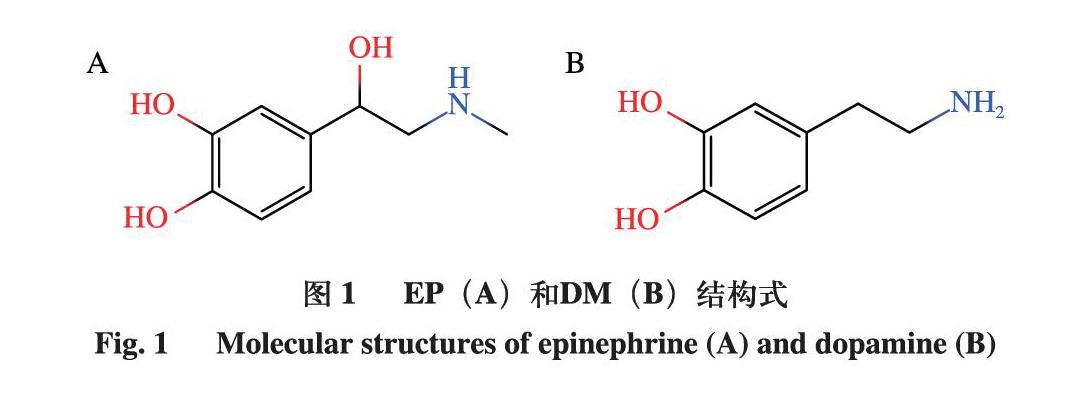
肾上腺素(epinephrine,EP)和多巴胺(dopamine,DM)属于儿茶酚胺类物质,在生物体内具有增强心肌收缩力和增加血流量的作用[1-2]。EP和DM的结构式如图1所示。这2 种物质在维持机体生理平衡中起着至关重要的作用,并且其体内水平与一些病理现象息息相关[3-6]。此外,EP还具有促进动物生长的作用[7]。然而,越来越多的不法商贩为取得暴利,强行给待宰的畜禽注射儿茶酚胺类药物,以提高畜禽肉中的水分含量[8-10]。
经过该方式进行注水的畜禽肉会呈现颜色鲜红的特点,卖相较好[10]。但是该注水方式会导致畜禽肉中药物残留,进而危害食用者的身体健康[11]。目前,对于儿茶酚胺類物质检测的研究大多集中于尿液[12-13]、血清[14-15]、组织液[16]等生物检材基质中,同时测定畜禽肉及肉制品中肾上腺素和多巴胺残留量的研究较少,仅对猪肉中的肾上腺素和多巴胺进行了相关实验[9],鲜见涉及其他肉类基质;并且仅有关于饲料中多巴胺检测的食品标准[17]。因此,亟需建立畜禽肉及肉制品中肾上腺素和多巴胺残留量的检测方法。
儿茶酚胺类物质的检测方法主要包括分光光度法[18-20]、电化学法[21-22]、化学发光法[23]、荧光光度法[24]和多技术联用[25-29]等。儿茶酚胺类物质自然发散的荧光较弱,需要进行衍生以提高荧光强度用于检测,且前处理时间较长。电化学法存在检测时间较长,易受干扰等问题。由于肉类样品基质复杂,基质效应显著,对检测方法的灵敏度要求相对较高。液相色谱-质谱联用技术具有特异性好、可实现多组分同时测定等优势,逐渐成为研究生物样品中药物残留的主流技术。本实验采用固相萃取柱对样品进行净化,同时选用超高效液相色谱-质谱联用技术和同位素内标法对肾上腺素和多巴胺进行定量分析,极大地降低了肉类样品基质对于儿茶酚胺类物质检测的干扰,结果准确度高,与现有方法相比灵敏度高,且实现了不同肉类基质中肾上腺素和多巴胺的同时检测,适用于畜禽肉及肉制品中儿茶酚胺类物质的痕量分析,为肉类样品中肾上腺素和多巴胺的本底值测定提供技术手段,为鉴别注水肉和完善动物源性食品中肾上腺素和多巴胺的检测标准提供参考。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈、甲酸(均为色谱纯) 美国Sigma公司;超纯水 广州屈臣氏食品饮料有限公司;氨水(色谱纯)、三氯乙酸(分析纯)、乙酸铵(色谱纯)、乙二胺四乙酸二钠(分析纯)、磷酸二氢钾(分析纯) 天津科密欧化学试剂厂;WCX固相萃取柱(60 mg/3 mL)、C18色谱柱(100 mm×2.1 mm,2.5 μm) 美国Waters公司。
肾上腺素(纯度99.4%)、盐酸多巴胺(纯度99.8%)、肾上腺素-D3(纯度98%) 德国Dr.Ehrenstorfer GmbH公司。
1.2 仪器与设备
TripleQuad 6500超高效液相色谱-三重四极杆质谱联用仪 美国AB Sciex公司;3K15高速冷冻离心机 美国Sigma公司;P300H超声波清洗仪 德国Elma公司;Vortex Genius 3旋涡振荡器 德国IKA公司。
1.3 方法
1.3.1 标准溶液配制
同位素内标和标准储备溶液:准确称取10.0 mg各标准品(精确至0.000 1 g),用体积分数0.1%甲酸-甲醇溶解后,于10 mL棕色容量瓶定容。配制成质量浓度为1 mg/mL标准储备液,-18 ℃保存待用。
混合标准系列工作液的配制:吸取适量标准储备液以及同位素内标储备液,用相应的空白基质配制系列混合标准工作液,质量浓度梯度为0.5、1、2、5、10、20、50 ng/mL,内标储备液质量浓度为25 ng/mL。
1.3.2 样品提取溶液配制
分别称取1.36 g磷酸二氢钾、0.15 g乙二酸四乙酸二钠和40 g三氯乙酸,分别用水溶解后转移到1 000 mL容量瓶,用水定容至刻度,备用。
1.3.3 样品提取与净化
提取:称取约2.00 g肉品试样(精确至0.01 g),加入100.0 μL同位素内标工作液(1 μg/mL),加入2 mL水,涡旋混匀,加入8 mL样品提取液,涡旋30 s,20 ℃超声10 min,4 ℃条件下9 500 r/min离心5 min,移取上清液5 mL,用氨水调pH 6~7,待净化。
净化:待净化液过WCX固相萃取柱(依次用3 mL甲醇、3 mL水活化),3 mL 20 mmol/L乙酸铵溶液、3 mL甲醇淋洗,2 mL体积分数50%乙腈溶液(含体积分数2%甲酸)洗脱,涡旋混匀洗脱液,0.22 μm有机尼龙滤膜过滤后供超高效液相色谱-质谱联用仪测定。
1.3.4 仪器条件
色谱条件:C18色谱柱(100 mm×2.1 mm,2.5 μm);流动相A为体积分数0.1%甲酸-水溶液,流动相B为乙腈;流速0.3 mL/min;柱温40 ℃;梯度洗脱条件:0.0~3.5 min、90% A,3.5~4.5 min、60% A,4.5~5.9 min、10% A,6.0~8.0 min、90% A。
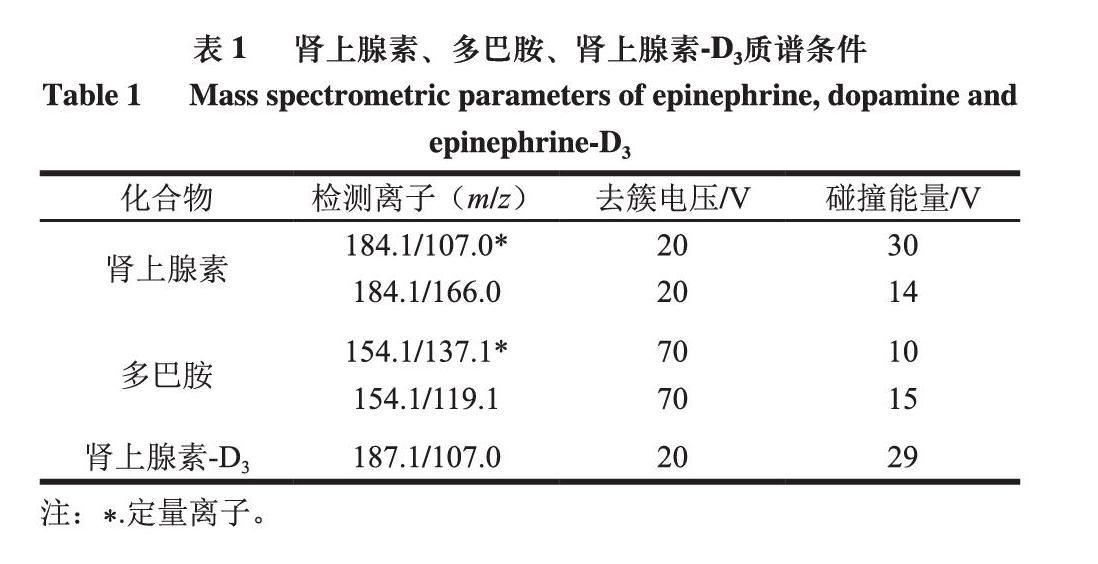
质谱条件:离子源:电喷雾电离离子源正离子模式(electron spray ionization,ESI+);毛细管电压5 000 V;多反应监测模式;离子源温度550 ℃;气帘气压力25 psi;辅助加热气(GS1)压力50 psi;辅助加热气(GS2)压力50 psi。3 种化合物的质谱参数见表1。
2 结果与分析
2.1 质谱条件优化
肾上腺素和多巴胺均含有氨基和羟基基团,在电离时,易带正电荷,选用正离子模式扫描确定化合物的母离子和子离子,同时根据检测离子对优化喷雾电压和碰撞能量,以确保EP和DM具有较高的灵敏度。
2.2 色谱条件优化
选用C18、GOLD、HILIC色谱柱对目标化合物进行分析,比较色谱峰的响应值和峰形,发现采用C18柱时,3 种化合物的峰形较好,且各种化合物均可分离。此外,目标化合物均为弱碱性化合物,在流动相中加入少量甲酸可以提高化合物的离子强度响应值,因此,选择C18色谱柱(100 mm×2.1 mm,2.5 μm)、体积分数0.1%甲酸-水溶液和乙腈作为流动相进行检测,色谱图如图2所示。
2.3 提取溶剂选择
肾上腺素和多巴胺均含有氨基和羟基,在有机试剂和水溶液中均有较好的溶解性,实验选择酸化甲醇、乙腈、酸化乙腈和10 mmol/L磷酸二氢钾缓冲溶液作为提取溶剂,考察加标量为10 μg/kg时,不同提取溶剂对方法回收率的影响。由图3可知,10 mmol/L磷酸二氢钾缓冲液作为提取溶剂时,肾上腺素和多巴胺的回收率均在85%以上,优于其他3 种提取溶剂,故本实验选取10 mmol/L磷酸二氢钾缓冲液作为提取溶剂。
2.4 固相萃取柱洗脱方式选择
考察MCX柱、WCX柱酸洗脱、WCX柱碱洗脱对目标化合物的净化效果,加标量均为10 μg/kg,由图4可知,WCX柱酸洗脱对目标化合物洗脱效果最好,回收率最高。
2.5 基质效应评价
其他组分在干扰待测组分离子化过程中造成的离子化抑制或增强的现象称为基质效应。当基质效应不在80%~120%范围内时,基质干扰对测定结果准确度的影响不可忽略[30]。肉类样品的成分复杂,本实验分别采用单一溶剂、鸡肉、猪肉和肉制品基质进行实验,考察基质对肾上腺素和多巴胺测定的影响。由表2可知,基质效应为71.4%~83.1%,表明基质会对检测结果造成影响。因此,本方法采用基质配标进行定量和定性分析,以降低基质效应的影响。
2.6 方法学结果
2.6.1 线性关系、检出限和定量限结果
采用内标法,同时在空白基质中添加标准物质进行标准曲线绘制,较好地消除了基质效应的干扰。由表3可知,在0.5~50 ng/mL质量浓度范围内,肾上腺素和多巴胺的R2均大于0.996,线性关系良好。采用已优化的前处理和检测条件对DP和EM进行检测,以3 倍信噪比作为该方法的检出限,10 倍信噪比作为定量限,肾上腺素和多巴胺在猪肉中的检出限和定量限分别为0.39~0.40 μg/kg和1.00 μg/kg,在鸡肉中的检出限和定量限分别为0.36~0.37 μg/kg和0.98 μg/kg,在肉制品中的检出限和定量限分别为0.38 μg/kg和0.96~0.97 μg/kg。
2.6.2 回收率和准确度
由表4可知,在阴性鸡肉、猪肉以及肉制品中分别添加1、2、10 μg/kg 3 个水平的混合标准溶液进行检测,3 种基质中2 种化合物的加标回收率为83.7%~111.2%,相对标准偏差为1.28%~5.76%,方法回收率和准确度良好,均满足日常检测要求。
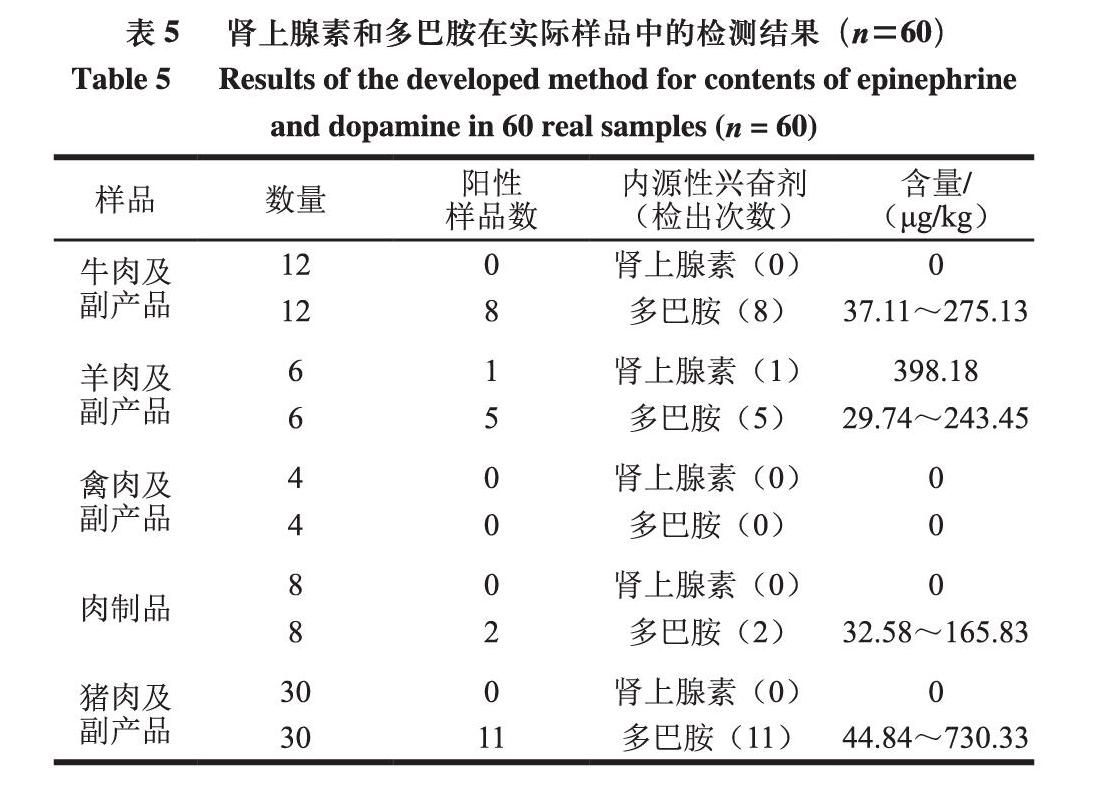
2.6.3 实际样品检测
由表5可知,采用本实验方法对市售60 批次畜禽肉及其副产品和肉制品进行检测,多巴胺阳性率为43.33%,实际样品中的残留量为27.94~730.33 μg/kg;肾上腺素阳性率为1.67%,仅在羊肾中检出。羊肉及副产品中包含一个羊肾样品,其肾上腺素残留量为
398.18 μg/kg,其余样品中均未检出。猪肉及副产品中包含一个猪肝样品,其肾上腺素未检出,多巴胺含量为730.33 μg/kg,除该样品外,肾上腺素未检出,多巴胺含量为44.84~182.93 μg/kg。禽肉以及副产品中肾上腺素和多巴胺均未检出。肾脏是肾上腺素主要代谢部位,肝脏正常代谢也会产生肾上腺素[31]和多巴胺[32],因此,肾上腺素和多巴胺容易在肾脏和肝脏处富集,与本实验的检测结果中羊肾和猪肝中肾上腺素和多巴胺含量较高相符。
3 结 论
研究建立了畜禽肉及肉制品中腎上腺素和多巴胺残留量的检测方法,样品经10 mmol/L磷酸二氢钾缓冲溶液提取,采用固相萃取净化技术进行净化,超高效液相色谱-质谱结合同位素内标法完成分离与定量。方法学验证结果表明,本方法操作简便、结果准确、灵敏度高,适用于不同肉类基质的检测。本方法为完善现有食品标准提供技术手段,为肉类样品中肾上腺素和多巴胺的本底值检测提供技术支撑,也为制定注水肉的检测指标提供思路,保障市售肉类品质。在实验中仅羊肾中有肾上腺素检出,羊肾和猪肝中多巴胺含量较其他肉类基质高,这与肾脏、肝脏等部位可正常代谢产生肾上腺素和多巴胺是否相关还需进一步实验验证,同时如何判断检出的儿茶酚胺类物质是否为外源性注射也需进行深入研究。
参考文献:
[1] 李双, 刘忠义, 李露青, 等. 液相色谱-串联质谱法检测猪肉中肾上腺素及其代谢物残留[J]. 环境化学, 2019, 38(3): 701-703.
[2] 彭颖斐, 吴炯, 郭玮, 等. 尿儿茶酚胺LC-MS/MS检测方法的建立[J]. 检验医学, 2015, 30(5): 433-436. DOI:10.3969/j.issn.1673-8640.2015.05.006.
[3] GARCIA F N, ALVARADO G H, HERNANDEZ M E A, et al. Characterization of sleep-pattern and neuro-immune-endocrine markers at 24 hour post-injection of a single low dose of lipopolysaccharide in male Wistar rats[J]. Journal of Neuroimmunology, 2018, 320(15):
15-18. DOI:10.1016/j.jneuroim.2018.04.011.
[4] LENDERS J W, DUH Q Y, EISENHOFER G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline[J]. Journal of Clinical Endocrinology and Metabolism, 2014, 99(6): 1915-1942. DOI:10.1210/jc.2014-1498.
[5] 徐新月, 李雪健, 任高彤, 等. 免疫細胞来源的儿茶酚胺类物质在机体代谢及炎性疾病中的作用[J]. 国际口腔医学杂志, 2016, 43(5): 599-604. DOI:10.7518/gjkq.2016.05.023.
[6] CORSSMIT E P, ROMIJN J A. Clinical management of paragangliomas[J]. European Journal of Endocrinology, 2014, 171(6):231-243. DOI:10.1530/EJE-14-0396.
[7] GOUGH C J R, JERRY P N. The role of adrenaline in cardiopulmonary resuscitation[J]. Critical Care, 2018, 22(1): 139. DOI:10.1186/s13054-018-2058-1.
[8] 任南, 赵文涛, 陈超, 等. 固相萃取联合超高效液相色谱-串联质谱法测定畜肉中3 种儿茶酚胺类物质[J]. 食品科学, 2019, 40(24):
300-305. DOI:10.7506/spkx1002-6630-20190107-085.
[9] 何志霞. 超高效液相色谱-串联质谱法测定猪肉中儿茶酚胺类的残留[J]. 食品安全质量检测学报, 2020, 11(16): 5608-5613. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.16.047.
[10] 孟伟, 马文涛, 张荣森, 等. 河南省濮阳市注水猪肉专项整治活动
分析[J]. 中国动物检疫, 2018, 35(8): 49-51. DOI:10.3969/j.issn.1005-944X.2018.08.013.
[11] 陈光胜. 病死猪及注水猪的危害与鉴定标准[J]. 中国动物保健, 2018, 20(11): 4-5. DOI:10.3969/j.issn.1008-4754.2018.11.002.
[12] 丘秀珍, 华永标, 郭会时, 等. 分子印迹纳米管膜的制备及对人体尿液中儿茶酚胺类药物的检测[J]. 高等学校化学学报, 2018, 39(4): 653-659. DOI:10.7503 /cjcu20170568.
[13] 彭颖斐, 吴炯, 郭玮, 等. 尿儿茶酚胺LC-MS/MS检测方法的建立[J]. 检验医学, 2015, 30(5): 433-436. DOI:10.3969/j.issn.1673-8640.2015.05.006.
[14] 李艳, 许舒欣, 刘海培, 等. 液相色谱-串联质谱法测定血浆中甲氧基肾上腺素和甲氧基去甲肾上腺素[J]. 分析科学学报, 2020, 36(3): 374-378. DOI:10.13526/j.issn.1006-6144.2020.03.010.
[15] 于梦洋, 吕琪, 王鑫, 等. 高效液相色谱-电化学法检测束缚挤压伤大鼠血清儿茶酚胺含量变化[J]. 武警后勤学院学报(医学版), 2016, 25(5): 345-349.
[16] 董捷, 房刚, 叶新强. 儿茶酚胺类物质的分析进展[J]. 化学分析计量, 2001, 10(6): 34-34. DOI:10.3969/j.issn.1008-6145.2001.06.016.
[17] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中盐酸多巴胺的测定 高效液相色谱法: GB/T 21036—2007[S]. 北京: 中国标准出版社, 2007: 1-2.
[18] NAGARAJA P, VASANTHA R A, SUNITHA K R J. A new sensitive and selective spectrophotometric method for the determination of catechol derivatives and its pharmaceutical preparations[J]. Journal of Pharmaceutical and Biomedical Analysis, 2001, 25(3/4): 417-424. DOI:10.1016/S0731-7085(00)00504-5.
[19] TEIXEIRA M, MARCOLINO-J?NIOR LH, FATIBELLO-FILHO O.
Flow injection spectrophotometric determination of adrenaline in pharmaceutical formulations using a solid-phase reactor containing lead(IV) dioxide immobilized in a polyester resin[J]. Farmaco, 2003, 57(3): 215-219. DOI:10.1016/S0014-827X(01)01196-X.
[20] ABDULRAHMAN L K, AL-ABACHI A M, AL-QAISSY M H. Flow injection-spectrophotometeric determination of some catecholamine drugs in pharmaceutical preparations via oxidative coupling reaction with p-toluidine and sodium periodate[J]. Analytica Chimica Acta, 2005, 538(1/2): 331-335. DOI:10.1016/j.aca.2005.02.045.
[21] RUAN Yijun, SHI Peiying, LEI Yun, et al. Polyvinyl butyral/graphene oxide nanocomposite modified electrode for the integrate determination of terminal metabolites of catecholamines in human urine[J]. Journal of Electroanalytical Chemistry, 2019, 848: 113267. DOI:10.1016/j.jelechem.2019.113267.
[22] TAIRA K, WEI L, TSUYOSHI M, et al. Well-designed dopamine-imprinted polymer interface for selective and quantitative dopamine detection among catecholamines using a potentiometric biosensor[J]. Biosensors and Bioelectronics, 2018, 117: 810-817. DOI:10.1016/j.bios.2018.07.014.
[23] 王辉, 曹俊涛, 李森, 等. 流动注射化学发光检测药物制剂中异丙肾上腺素及机理研究[J]. 信阳师范学院学报(自然科学版), 2015, 28(4): 555-558. DOI:10.3969/j.issn.1003-0972.2015.04.022.
[24] NIKOLAJSEN R, BOOKSH K S, HANSEN M, et al. Quantifying catecholamines using multi-way kinetic modelling[J]. Analytica Chimica Acta, 2003, 475(1): 137-150. DOI:10.1016/S0003-2670(02)01256-4.
[25] AMJADI M, HALLAJ T, MANZOORI J L, et al. An amplified chemiluminescence system based on Si-doped carbon dots for detection of catecholamines[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2018, 201: 223-228. DOI:10.1016/j.saa.2018.04.058.
[26] MOLINNUS D, HARDT G, KVER L, et al. Chip-based biosensor for the detection of low adrenaline concentrations to support adrenal venous sampling[J]. Sensors and Actuators: B Chemical, 2018, 272: 21-27. DOI:10.1016/j.snb.2018.05.136.
[27] 趙蓓蓓, 程雅婷, 李维, 等. 质谱技术在内分泌疾病诊疗中的应用[J]. 中华临床实验室管理电子杂志, 2018, 6(3): 129-134. DOI:10.3877/cma.j.issn.2095-5820.2018.03.001.
[28] 王浩, 方桂迁, 吴忠玉, 等. 选择性识别儿茶酚胺的长波长二硼酸荧光探针[J]. 化学研究, 2018, 29(2): 59-65. DOI:10.14002/j.hxya.2018.02.009.
[29] KONGKIATPAIBOON S, DUANGDEE N, CHEWCHINDA S, et al. Development and validation of stability indicating HPLC method for determination of adrenaline tartrate[J]. Journal of King Saud University-Science, 2017, 33(1): 48-51. DOI:10.1016/j.jksus.2017.05.016.
[30] 孙利东, 许秀丽, 袁飞, 等. 高效液相色谱-串联质谱法测定牛奶和鸡肉中4 种激素本底值[J]. 食品科学, 2017, 38(22): 291-297. DOI:10.7506/spkx1002-6630-201722043.
[31] 王聪, 赵晓宇, 孙磊, 等. 高效液相色谱-三重四极杆质谱法测定猪肉及肝脏中肾上腺素代谢物[J]. 食品安全质量检测学报, 2020, 11(21): 7909-7914. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.21.041.
[32] CAREY R M. Renal dopamine system: paracrine regulator of sodium homeostasis and blood pressure[J]. Hypertension, 2001, 38(3): 297-302. DOI:10.1161/hy0901.096422.

