卵泡抑素在口腔颌面部发育中的作用及其治疗应用前景
刘嘉程 孟昭松 李宏捷 隋磊
1.天津医科大学口腔医院病理科 天津 300070;2.天津医科大学口腔医院口腔颌面外科 天津 300070;3.天津医科大学口腔医院修复科 天津 300070
卵泡抑素(follistatin,FST)是一种广泛存在于上皮、肌肉、骨等诸多组织的细胞外分泌蛋白,参与多种病理生理过程,被认为是某些疾病的治疗靶点[1-3]。FST具有抑制促卵泡激素分泌、调控肝稳态、调节免疫以及促进骨形成等功能,并且是控制胚胎发育的关键因子,对神经、骨骼肌、腺体等组织的发育至关重要[4-6]。在口腔颌面部发育过程中,FST在上皮和间充质中均有不同程度的表达,对牙、颌骨等硬组织及唇腭、颜面等软组织的正常形成具有重要作用。FST是调控小鼠牙源性上皮干细胞成釉分化,保证釉质正常形成的关键因子之一,与激活素(activin,ACT)和骨形态发生蛋白(bone morphogenetic proteins,BMPs)等转化生长因子-β (transforming growth factor-β,TGF-β)超家族蛋白构成的信号调控网络是唇、腭、颌骨等口腔颌面部非牙体组织维持正常发育的重要机制,同时在某些疾病或组织再生中具有应用潜能。本文就此进行综述,以期为FST在口腔领域相关基础研究及临床应用提供线索。
1 FST的来源、亚型及生物学功能
FST主要来源于垂体促性腺激素细胞或星形细胞,也可由肝、肾、骨等多种组织合成,在胚胎期和出生后的多种组织均有不同程度的表达,其表达水平受氧化应激水平、机械力、转录因子等多种因素调节[7]。人类FST的基因序列定位于5q11.2,包含9个外显子;小鼠FST的基因序列定位于13 D2.2,包含6个外显子。成熟FST根据所含氨基酸残基数目不同分为FST-315、FST-288和FST-300,前两种是主要亚型。其中,FST-315的含量超过95%,是血清中主要的循环亚型[8]。FST的分子结构高度保守,在哺乳动物中具有95%的同源性[9]。
FST是一种高效的TGF-β信号通路抑制因子,以自分泌和旁分泌方式识别并结合靶细胞表面位点[10],通过结合ACT和BMPs抑制二者各自的信号传导蛋白Smad2/3/4和Smad1/4/5/8/9的功能,从而调控相关信号通路[11-13](图1)。FST对ACT的亲和力和抑制效应强于其对BMPs,呈ACT>BMP7>BMP2/4[14],其中FST-288对ACT的亲和力和抑制效应均强于FST-315,后者具有保护ACT不被溶酶体酶降解的功能,可能作为ACT贮库调控其在不同组织中的分布与功能[15]。

图1 FST调控ACT、BMPs信号通路的机制Fig 1 The mechanism of FST in regulation of ACT and BMPs signaling pathways
2 FST在口腔颌面部发育中的作用
2.1 FST在牙发育中的作用
FST主要表达于牙胚上皮,在间充质中也有少量表达。Wang等[16]的研究发现,K14-FST过表达小鼠的牙齿矿化不良,Amel、Ambn、Mmp20等釉质蛋白表达下调,成釉分化受到抑制;K14-FST敲除小鼠的牙尖发育畸形,釉质蛋白表达上调,舌中有异位分化的成釉细胞和异常表达的Dlx1、Msx1、Msx2、Pax9、Pitx2等经典牙齿相关转录因子。该研究还证实,FST在牙发育过程中受间充质中的ACT诱导,自胚胎18 d起在小鼠切牙颈环区呈舌侧强于唇侧的非对称性表达,通过控制上皮细胞中BMP4的表达水平调节牙上皮干细胞向成釉细胞分化。这一研究提供了FST调控牙齿发育的直接证据,揭示FST与ACT在其中存在负反馈调节。
牙齿的发育受信号转导网络的精密调控,作为FST配体的ACT、BMP2/4/7和作为信号传导介质的Smad蛋白在这一过程中起重要作用。ACT主要表达于牙胚间充质细胞,ACT-/-小鼠的牙齿发育停滞在蕾状期[17]。ACT信号传导需要Smad2/3的磷酸化和Smad4的结合。Smad2/3的磷酸化对釉质、牙本质的形成有调控作用[18]。Smad4能够维持牙源性干细胞的稳态,进而维持正常发育进程,Smad4-/-小鼠的牙上皮干细胞增殖过度,分化受限[19],还可能诱发多发性角化囊性瘤,导致发育延迟、牙齿畸形[20]。BMP信号通路中,BMP2在牙上皮细胞、间充质细胞和成牙本质细胞中表达,通过诱导上皮细胞中的Smad1/5/8磷酸化促进成釉细胞和成牙本质细胞的形成,并参与上皮根鞘(Hertwig's epithelial root sheath,HERS)和牙根的发育[21-23];BMP4主要在牙上皮细胞中表达,是促进成釉分化的关键因子,随着牙胚发育,BMP4的表达逐渐趋向间充质,并呈正反馈表达,提示BMP4可能有介导上皮间充质相互作用的功能[16];BMP7在HERS细胞、前成釉细胞和前成牙本质细胞中表达,在HERS细胞中FST通过抑制BMP7的表达维持HERS的正常结构[24]。
根据这些研究可以推测,FST可能通过结合ACT、BMPs,抑制受体磷酸化,使Smad蛋白的磷酸化和结合受阻,进而改变原始效应,影响牙发育进程。
2.2 FST在唇、腭发育中的作用
FST对颜面及腭部发育至关重要。FST在胚胎期面部上皮和间充质组织中的表达水平较高,且与BMPs家族成员生长分化因子11(growth differentiation factor 11,GDF11)共表达[25]。唇腭的正常发育既依赖于FST与GDF11分别以自分泌方式调节祖细胞群分化,又依赖于两者以拮抗剂和配体形式结合的相互作用[26]。小鼠和人的外显子测序显示,FST或GDF11的基因突变均可导致非综合征唇腭裂的发生[25]。纯合敲除FST的小鼠表现为腭裂,K14-FST敲除小鼠与唇腭裂关键基因Irf6在上皮细胞条件性敲除的小鼠具有相似表型,即出现牙尖形态改变和第三磨牙发育延迟[27]。因此,Cox等[25]建议将FST基因作为非综合征性唇腭裂相关候选基因纳入基因检测,以协助预测发病风险及早期干预。除GDF11外,FST靶蛋白信号通路组分BMP2/4、Smad2/4等也参与了颌面部组织的发育[28]。BMP2/4在前腭存在局限性表达,参与腭上皮和间充质对腭发育的调控[28]。Smad2/4对胚胎期颌面部组织的发育至关重要,Smad2-/-小鼠胚胎表现为中胚层缺失[29],Wnt1-Cre的Smad4敲除小鼠胚胎表现为第一鳃弓发育不足和面突不能融合[30]。由此可见,FST除自身直接影响唇腭发育之外,还可通过调控上述靶蛋白间接影响唇腭发育。
2.3 FST在颌骨发育中的作用
FST对颌骨发育也有关键调控作用。FST主要在成骨细胞中表达,在下颌骨的成熟骨细胞中也有表达[31],其表达水平在成骨初期较高,随细胞的分化而降低[32],此过程受BMP2负反馈调节。FST本身不是成骨因子,但可高亲和结合ACT和低亲和结合BMPs[33],通过招募间充质干细胞并促进其成骨分化、促进成骨细胞的成熟和矿化等途径促进成骨[34]。在BMP2通过磷酸化Smad1/5/8/9诱导成骨的过程中,FST不仅能抑制BMP2活性,还受其负反馈调控[35-37]。此外,研究[38]表明ACT可与c-fos和Smad2/3相互作用,增强核因子κB受体活化因子配体(receptor activator for nuclear factorκB ligand,RANKL)诱导破骨细胞形成的能力,FST可能通过高亲和结合ACT,在一定程度上抑制此过程造成的骨吸收。TGF-β通路是促进早期成骨分化的关键通路,但抑制后期成骨细胞的成熟和矿化[39],而FST具有促进骨成熟与矿化的能力,可能在成骨后期拮抗TGF-β通路对骨成熟的抑制效应。
3 口腔颌面部发育中的FST靶蛋白信号通路
FST靶蛋白信号通路各组分在口腔颌面部的分布、功能及FST作用机制见表1,目前尚缺乏FST通过抑制ACT、BMPs调控口腔颌面部发育的直接证据,也未明确Smad蛋白在其中的角色。进一步完善FST与ACT/BMPs信号通路在口腔颌面部软硬组织发育中的相互作用,对深入理解各类口腔颌面部发育异常的原因具有重要意义。
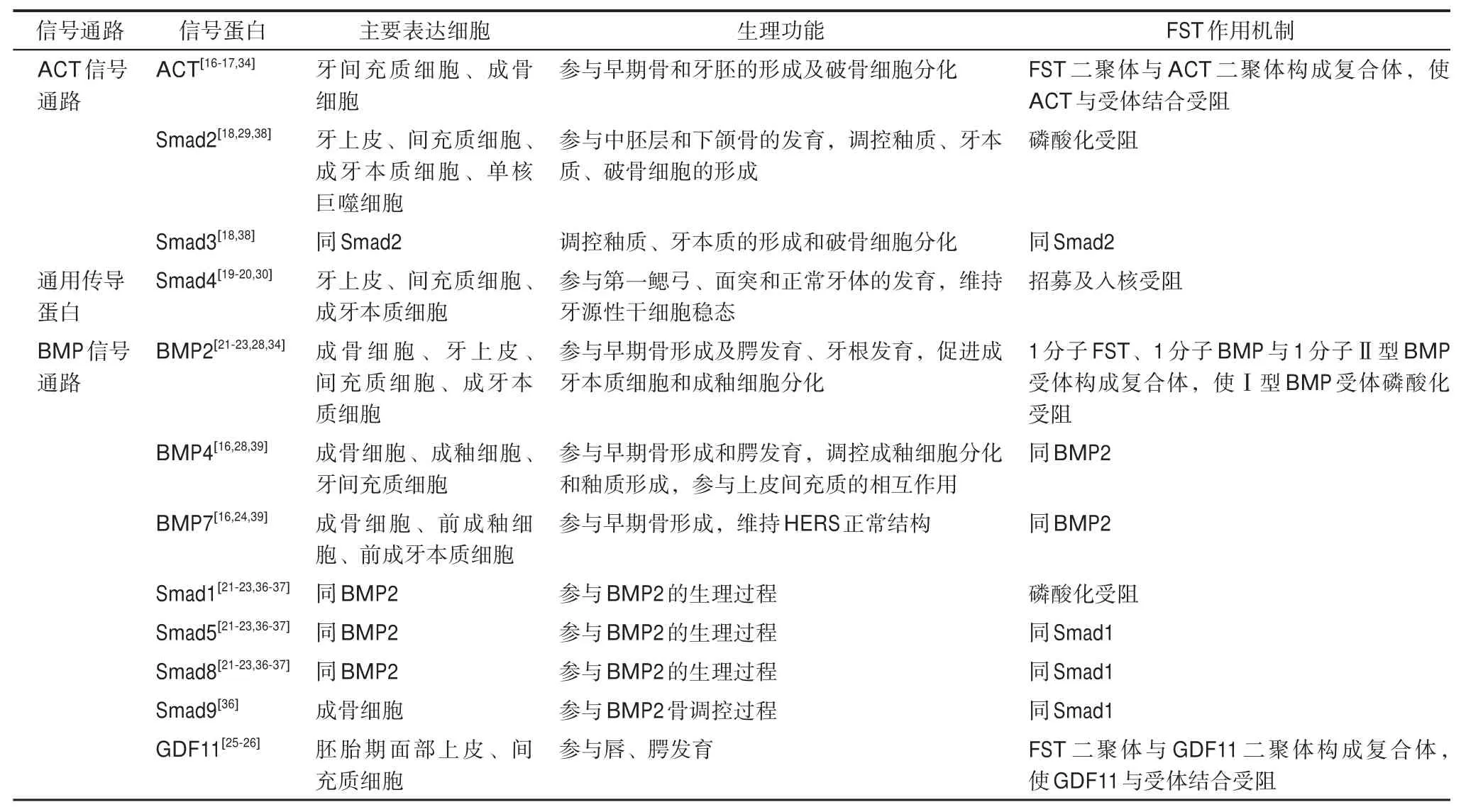
表1 FST靶蛋白信号通路组分在口腔颌面部的分布、功能及FST作用机制Tab 1 The distribution and functions of FST target protein signaling pathway components in oral and maxillofacial region and the mechanism of FST on them
4 FST治疗应用前景
FST作为人体高效的天然激素,来源广泛,提纯技术成熟,人为控制FST的表达量成为一种可行的治疗手段。在肌肉疾病中,FST-315已被系统地用于骨骼肌损伤的治疗[40],基于FST-315前体FST-344的基因疗法在包涵体肌炎、面肩肱型肌营养不良症的治疗中也取得了良好效果[41-42]。在炎症免疫性疾病中,一定剂量的外源性FST-288可减轻心脏、肾脏等器官的再灌注损伤程度[2,43],还可降低纤维化程度,保存细胞活性,进而缓解症状[44]。然而,FST在口腔颌面部疾病诊疗中的应用仍鲜见报道,其原因一方面是FST的药物代谢动力学参数和适宜载药系统相关研究尚不充分[34],另一方面是FST在口腔颌面部发育及创伤愈合中的作用机制尚未完全明确。依据现有研究结果,FST在口腔医学领域的治疗应用前景主要集中于肿瘤、炎症、骨组织再生三大方面(图2)。

图2 FST的治疗应用前景Fig 2 The prospect of therapeutic applications of FST
FST在口腔鳞状细胞癌细胞中高表达,并与恶病质和不良预后密切相关[45]。也有研究[46-47]指出:FST可通过降低癌细胞ACT水平,抑制癌细胞增殖、转移及血管生成,与富血小板血浆联合应用时还可降低放射治疗后鳞状细胞癌复发率[48]。进一步研究FST在口腔鳞状细胞癌发展中的分子机制,有望为其治疗提供潜在靶点。
FST作为重要促炎因子ACT的抑制剂,在内毒素血症、纤维化等急慢性炎症的治疗中具有临床应用价值[49-51]。FST/ACT信号轴还可调控白细胞介素-1β、白细胞介素-10、干扰素-γ等M1型巨噬细胞标记物的表达[50],因此在牙周炎、口腔黏膜下纤维化等口腔炎症中可发挥一定作用;但因FST无法抑制TGF-β1/2/3等炎症因子的活性,故其具体临床效果有待进一步明确。
FST还可促进口腔颌面部骨愈合及改建。Fahmy-Garcia等[34]在细胞水平的研究表明,髂骨移植腭裂修复术后,外源性FST通过调控ACT、BMPs信号通路,既可在不干扰血管系统自然级联反应的前提下招募内皮细胞,增强成血管能力,还可及时清除血液中的游离ACT,降低手术应激状态下ACT诱导的炎症反应水平,从而促进愈合;其中28 ng·mL-1是该实验中促进细胞迁移、成骨、新生血管等骨修复关键过程的最适质量浓度。动物牵张成骨实验[52]也证实,FST能通过调控ACT活性增强膜内成骨。此外,在正畸动物模型中张力侧成骨细胞的FST表达水平明显高于压力侧,提示FST有助于促进牙槽骨改建[53]。
5 展望
FST在口腔颌面部发育中发挥重要作用,且未来有望应用于相关疾病的诊疗。然而,FST受Wnt、MAPK、PKA等多条信号通路调控,并与转录激活因子等调节因子相互作用,故需深入探究其调控网络,进一步明确其作用,才能够确保精准应用;此外,FST在多种组织中均有结合位点,有效剂量也不尽相同,故如何令FST制剂定向进入病变组织并达到适宜浓度亦是其转化应用中亟待解决的问题。
利益冲突声明:作者声明本文无利益冲突。

