富血小板血浆和浓缩生长因子对人牙周膜细胞增殖和成骨分化影响的研究
刘娟 陈斌 闫福华
南京大学医学院附属口腔医院·南京市口腔医院牙周病科 南京 210008
牙周炎是由菌斑生物膜引起的慢性感染性疾病,会导致牙周组织炎症感染甚至丧失,是成年人失牙的主要原因之一。同时,牙周炎的疾病发展与全身健康密切相关。牙周治疗的最终目标是修复和重建已破坏的牙周组织,实现牙周组织再生[1]。目前的牙周治疗可以有效控制牙周炎症,尚不能获得理想的组织再生,因此,寻找有效的促进牙周组织再生的方法具有重要的临床意义。
牙周膜细胞(periodontal ligament cells,PDLCs)是牙周组织的主要构成细胞,是一个异质性很强的细胞群,其中包含的牙周膜干细胞(periodontal ligament stem cells,PDLSCs)具有自我更新和多向分化的潜能[2],可以分化为成骨细胞、成牙骨质细胞和成纤维细胞等,在维持牙周组织稳态和促进牙周组织修复再生中发挥关键作用。
血小板浓缩制品是近年来临床上比较常用的自体来源性生长因子,包含多种生长因子且质量浓度较高,各种生长因子的比例与人体中生长因子的比例相符,生物安全性高且外源性感染风险低。目前常用的血小板浓缩制品主要包括富血小板血浆(platelet-rich plasma,PRP)和浓缩生长因子(concentrate growth factor,CGF)。PRP是自体全血经二次离心得到的血小板浓缩物,其血小板质量浓度至少为全血血小板的4倍以上[3-4];CGF是全血通过加速离心制取的新一代血小板浓缩制品,呈凝胶状,富含生长因子的同时兼具了纤维团块的立体构架,可以压制成膜状,有利于手术创面的初期稳定[5]。
张宇等[6]使用PRP联合磷酸三钙修复种植体周骨缺损,对术后骨组织标本进行组织学观察发现:与对照组相比,PRP组新骨形成更为致密。Choi等[7]的研究则表明:低质量浓度的PRP可促进牙槽骨相关细胞的增殖,而高质量浓度的PRP反而会抑制细胞的增殖。Bozkurt Doğan等[8]通过膜龈手术的临床对照试验发现:加入CGF的实验组,其角化龈宽度和厚度的增量均高出对照组约0.4 mm,且术后牙龈退缩的风险更低。Pirpir等[9]通过研究发现:CGF可以促进成骨细胞的增殖能力,亦可促进细胞的分化速度,促进骨修复过程;然而Honda等[10]则认为:高质量浓度CGF会抑制干细胞的增殖和分化。魏中武等[11]通过对比大量文献发现:CGF虽然在口腔临床的应用广泛,但作用机制有待研究。
鉴于PDLCs在牙周稳态和牙周组织修复再生过程中的作用,笔者有理由提出设想:PRP和CGF对PDLCs的增殖和分化存在影响,从而影响着牙周组织修复再生的过程,因此有必要对PRP、CGF在牙周组织修复再生过程中发挥的作用进行探讨,以期指导其在临床上的有效应用。本文通过研究 PRR、CGF 对人PDLCs (human PDLCs,hPDLCs)增殖、迁移及成骨分化的影响,进一步探讨PRP、CGF在牙周组织再生中的作用。
1 材料和方法
1.1 材料和设备
DMEM培养基、胎牛血清(Gibco公司,美国),抗波形丝蛋白抗体、抗角蛋白抗体(Bioworld 公司,美国),茜素红、油红O、CCK-8(Cell Counting Kits-8) 试剂盒 (Sigma公司,美国),结晶紫染液(南京凯基生物公司),Runx2(runt-related transcription factor 2)(Cell Signaling Technology,美国),Dlx5(distal-less homebox 5)抗体、Msx2 (mu-scle segment homeobox gene 2)抗体(Abcam公司,英国)和Osx(Osterix)抗体(R&D公司,美国)等。
一次性真空采血管、细胞培养皿(Corning公司,美国)、倒置相差显微镜(Nikon公司,日本)、CGF离心机(Medifuge公司,意大利)。
1.2 hPDLCs的培养与鉴定
收集18~30岁志愿者拔除的健康的正畸减数牙或阻生牙,反复冲洗后刮取牙根中1/3部位的牙周膜组织,采用组织块法进行原代培养。选取生长良好的第2代hPDLCs行波形丝蛋白、角蛋白染色,通过免疫组织化学法检测细胞来源,CCK-8法检测细胞增殖能力,油红O和茜素红染色分别检测细胞成脂分化和成骨分化的潜能。本实验经南京大学医学院附属口腔医院伦理委员会批准(批准号为ChiCTR-OCH-13004679),所有志愿者均已知情同意。
1.3 血小板浓缩制品的制备与血小板计数
选取7名健康志愿者制备血小板浓缩制品。7名志愿者年龄22~26岁,无全身系统性疾病,女性处于非经期和孕期。实验经南京大学医学院附属口腔医院伦理委员会批准(批准号为ChiCTROCH-13004679),所有志愿者均已知情同意。
抽取志愿者肘静脉全血25 mL,分为3组。1)对照组:5 mL全血加入抗凝剂;2)PRP组:10 mL全血加入抗凝剂,制备PRP;3)CGF组:10 mL全血不加抗凝剂,制备CGF。
1.3.1 PRP 制备 肘静脉全血10 mL(加入抗凝剂),1 000 r·min-1离心15 min,吸取上层血浆(包括血小板和白细胞层)及下方1 mm以内的红细胞层,3 000 r·min-1离心8 min,上层的贫血小板血浆弃去,将底层的血小板、少量的红细胞和白细胞混合物充分悬浮置于EP管中,即为PRP。对PRP进行血小板计数。将含有100 U·mL-1人凝血酶的10% CaCl2混合液按1∶9的体积比加入PRP中,4 ℃过夜;待血块充分收缩后,4 000 r·min-1重离心20 min;吸取上清液置于EP管中,-80 ℃备用。
1.3.2 CGF 制备 肘静脉全血10 mL(不加入抗凝剂),按照CGF制备程序(加速30 s,2 700 r·min-1离心2 min,2 400 r·min-1离心4 min,2 700 r·min-1离心4 min,3 000 r·min-1离心3 min,减速36 s至停止)离心,分为3层:上层为贫血小板血浆层,下层为红细胞层,中间即为CGF凝胶层(图1)。取CGF层及部分与红细胞层交界的沉淀物置于离心管中,室温下静置60 min,3 000 r·min-1离心20 min,取上清部分即为实验用CGF。对制备的CGF进行血小板计数,分装,-80 ℃备用。

图1 全血制备CGFFig 1 The preparation of CGF from the whole blood
1.4 CCK-8 法 检 测 PRP、CGF 对 hPDLCs 增 殖 能力的影响
选取生长良好的第3、4代hPDLCs细胞,以每毫升1×105个细胞的密度接种于96孔板,每孔接种100 µL,根据添加培养基不同分为3组。1)对照组:基础培养基;2)PRP组:含质量分数5%PRP的基础培养基;3)CGF组:含质量分数5% CGF的基础培养基。3组细胞置于37 ℃、5% CO2细胞培养箱中培养,每3 d更换1次培养液;每天随机选取8个检测孔,每检测孔加入10 µL的CCK-8溶液,37 ℃、5%CO2细胞培养箱中培养4 h;采用酶联免疫检测仪测量450 nm波长下各组的吸光度值。
1.5 细胞划痕实验检测PRP、CGF对hPDLCs迁移能力的影响
选取生长良好的第3~4代hPDLCs细胞,以每毫升1×105个细胞的密度接种于6 cm细胞培养皿,每皿接种3 mL,根据添加培养基不同分为3组。1)对照组:基础培养基;2)PRP组:含质量分数5% PRP的基础培养基;3)CGF组:含质量分数5% CGF的基础培养基。3组细胞置于37 ℃、5%CO2细胞培养箱中培养1 d后,使用无菌细胞刮在培养皿底壁轻刮、旋转,制造直径约8 mm的圆形损伤区域,光学显微镜下检查损伤模型区域无细胞残留,分别在培养第1、4、7、10、13天每组选取1个培养皿进行结晶紫染色,显微镜下观察hPDLCs的迁移能力。
1.6 PRP、CGF对hPDLCs成骨分化影响的研究
选取第3~4代hPDLCs细胞,以每毫升1×105个细胞的密度接种;24 h细胞贴壁后,用无胎牛血清的DMEM培养基培养24 h,使细胞同步化,将细胞分为3组。1)对照组:用无胎牛血清的DMEM培养基培养;2)PRP组:分别用含有质量分数1%、5%、10%PRP的DMEM培养基进行培养;3)CGF组:分别用含有质量分数1%、5%、10% CGF的DMEM培养基进行培养。以上各组细胞分别培养24、48、72 h,进行矿化诱导,提取各组hPDLCs细胞总蛋白,Western blot检测hPDLCs成骨相关转录因子Runx2、Osx、Dlx5和Msx2的表达情况,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参照。
1.7 统计学分析
采用SPSS 17.0统计学软件对所得数据进行处理,组间差异比较采用单因素方差分析,检验水准为双侧α=0.05。
2 结果
2.1 hPDLCs的分离培养及鉴定
采用组织块法培养细胞在第4~5天可在显微镜下看见细胞从组织块周围游出,呈放射状生长。细胞呈长梭形,漩涡状排列;抗波形丝蛋白染色阳性,抗角蛋白染色阴性。CCK-8法检测显示细胞具备增殖能力,生长曲线基本呈S形;经矿化诱导,可见矿化结节形成,经成脂诱导,可见脂滴形成(图2)。

图2 hPDLCs的分离培养及鉴定Fig 2 The isolation culture and identification of hPDLCs
2.2 血小板计数
PRP中的血小板计数均为全血血小板数量的5倍以上,达到PRP的制备标准(表1)。全血制备出的CGF样本中,通过血小板检测仪未检测出血小板存在(表1)。

表1 全血、PRP和CGF的血小板计数Tab 1 The platelet count of whole blood,PRP and CGF
2.3 PRP和CGF对hPDLCs增殖能力的影响
3组的增殖曲线见图3:与对照组相比,5%PRP和5% CGF组hPDLCs的增殖明显增强,细胞生长曲线基本呈S形;在快速增殖期(4~6 d),对照组与2个实验组的差异均有统计学意义(P<0.05),提示PRP、CGF均可促进hPDLCs的增殖。

图3 PRP、CGF对hPDLCs增殖能力的影响Fig 3 The effect of PRP and CGF on the proliferation ability of hPDLCs
2.4 PRP和CGF对hPDLCs迁移能力的影响
3组的细胞划痕实验结果见图4:与对照组相比,PRP和CGF组的细胞迁移能力增强;第13天,PRP、CGF组无细胞区域有70%~80%的面积铺满细胞,而对照组无细胞区域仅约50%铺满细胞。与对照组相比,PRP、CGF组对hPDLCs迁移能力的影响具有明显差异(P<0.05);而CGF与PRP组相比,两组无明显差异(P>0.05)。结果提示:PRP和CGF均可促进hPDLCs的迁移,但二者促进细胞迁移的作用无明显差异。

图4 PRP、CGF对hPDLCs迁移能力的影响 结晶紫染色Fig 4 The effect of PRP and CGF on the migration ability of hPDLCs crystal violet staining
2.5 PRP、CGF对hPDLCs成骨相关转录因子表达水平的影响
Western blot检测结果见图5、6。与对照组相比,PRP、CGF组Runx2、Osx、Dlx5的表达升高,Msx2表达降低;在PRP、CGF质量分数为10%时,与对照组的差异有统计学意义(P<0.05)。与PRP组相比,10%CGF组Runx2的表达升高,Dlx5在培养24、48 h时的表达升高,10%CGF组Msx2的表达降低,差异均有统计学意义(P<0.05)。

图5 Western blot 法检测PRP、CGF对成骨相关转录因子Msx2、Osx、Dlx5、Runx2表达的影响Fig 5 The effect of PRP and CGF on the expression of Msx2,Osx,Dlx5 and Runx2 detected with Western blot
3 讨论
PRP、CGF作为血小板浓缩制品,在血小板被激活后,可释放多种生物活性物质,包括多种生长因子,如血小板源性生长因子(platelet-derived growth factors,PDGF)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、血管内皮生长因子 (vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(fibroblast growth factor,FGF)、胰岛素样生长因子(insulin like growth factor,IGF)等,可以促进成纤维细胞和成骨细胞的增殖和分化、血管生成,促进伤口愈合[12]。PRP具有促进骨重建、减轻术后反应、抗感染及炎症调节等作用[13]。CGF作为第3代血小板浓缩制品,也具有促进细胞增殖、成骨分化和促进血管生成等作用[14]。
本研究血小板计数结果显示:PRP中血小板计数量约为全血的5倍,符合PRP的制备标准[15]。CGF在制备过程中,未加入外源性抗凝剂,在变速离心、室温静置、再离心等过程中,血小板被激活,血小板计数未检测出。另外,值得注意的是,不同志愿者的全血制备出的血液制品中血小板计数存在差异,提示血小板计数存在个体差异性。
本研究通过组织块法获得hPDLCs,多数细胞的胞体较大,呈长梭形(图2),提示分离的细胞主要由成纤维样细胞和不同分化阶段的细胞共同组成,是含有干细胞成分的细胞群;经免疫组织化学鉴定为间质细胞来源,与既往的研究[16]相符。本实验采用第3~4代hPDLCs,具备较好的增殖能力,在培养4~6 d增殖明显,之后增殖能力逐渐趋于平稳。对hPDLCs进行多向诱导,脂滴和矿化结节的形成证明细胞具备成脂、成骨分化的能力,说明本实验获得的是一群异质性,具有增殖、多向分化潜能的hPDLCs[17]。
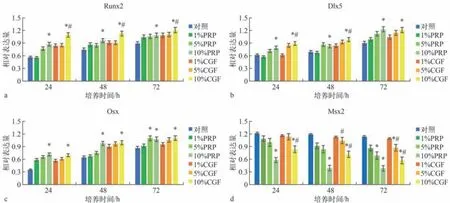
图6 PRP、CGF对成骨相关转录因子Runx2、Dlx5、Osx、Msx2表达的影响Fig 6 The effect of PRP and CGF on the expression levels of Runx2,Dlx5,Osx and Msx2
本实验中CCK-8实验(图3)结果显示:PRP、CGF均可促进hPDLCs的增殖,促进效果明显优于对照组,两者差异有统计学意义(P<0.05),CGF组促进hPDLCs增殖水平最高。细胞划痕实验(图4)结果显示:PRP和CGF均能够促进hPDLCs的细胞迁移,且CGF的促进效果优于PRP。其可能原因是:PRP和CGF作为血小板浓缩制品,富含多种生长因子,包括TGF-β、VEGF、PDGF等,可促进细胞的增殖和迁移;CGF通过加速离心方式,最大限度地富集了血小板中的生长因子,可能具有更优的促进作用。
Runx2、Osx、Dlx5和Msx2等成骨相关转录因子通过参与转化生长因子-β/骨形态发生蛋白(transforming growth factor-β/bone morphogenetic protein)信号通路、Notch信号通路及Wnt信号通路等参与调节骨代谢过程,对骨代谢及骨重塑具有重要意义[18]。Runx2 的表达提示成骨细胞 (osteoblast,OB)开始分化,可以激活相关成骨蛋白(骨钙蛋白、骨桥蛋白、骨涎蛋白和Ⅰ型胶原蛋白等)的转录和表达,促进成骨细胞向分化[19]。Osx处于OB分化路径中Runx2的下游,受Runx2表达的影响[20]。Dlx5能够调节BMP-2诱导Runx2、Osx的表达过程[21],Msx2能抑制Runx2的转录活性;Msx2与Dlx5相互协调,Dlx5可干扰Msx2对Runx2的抑制作用。
本实验以不同质量分数(1%、5%、10%)的PRP、CGF分别与hPDLCs共培养不同的时间(24、48、72 h),Western blot结果(图5)显示:随着培养时间的增加,Runx2、Osx、Dlx5的蛋白表达量增加,且呈时间依赖性,在72 h达到最高;在同样时间下,随着PRP、CGF质量分数的增加,蛋白表达量增加,在10%时达到最高;而Msx2蛋白表达量在24 h时相对最高,随着PRP、CGF质量分数的增加,其表达量降低。这与以往的研究[22-24]基本相符。本实验中,与PRP相比,CGF对Runx2、Dlx5的促进作用在质量分数为10%时存在明显差异,而对Osx的促进作用在不同质量分数之间则没有明显差异;CGF对Msx2的抑制作用较弱,仅在质量分数为10%时与其他质量分数存在差异。此外,本研究发现:hPDLCs成骨分化过程中,Runx2、Osx、Dlx5和Msx2的表达受PRP和CGF的影响,提示PRP、CGF对hPDLCs成骨分化具有促进作用,其过程是多重转录因子和信号通路共同调控的结果。后续的研究中需要进一步明确发挥主要作用的转录因子,必要时进行进一步的靶向抑制剂的调控研究。
有研究[7,10]发现:低浓度、高浓度的PRP和CGF对细胞的增殖、分化能力影响不同。笔者在前期的预实验中,采用的是5%和8%的RPR和CGF观察其对hPDLCs增殖能力的影响,结果发现:RPR和CGF均可促进hPDLCs的增殖能力,但是两者间无明显差异。同时,由于从全血中制备PRP和CGF的量不多,因此,在本研究采用1%、5%、10%的PRP、CGF与hPDLCs共培养,结果显示均具备促进增殖、迁移和分化的能力。但是,本实验中PRP、CGF对hPDLCs的促进作用未能达到并形成一个峰值进而出现拐点,因此后续研究中需要进一步提高PRP、CGF的质量分数,研究其对hPDLCs的作用,进一步探讨临床应用的最适宜质量分数。
综上所述:PRP、CGF可以促进hPDLCs增殖,增强Runx2、Osx、Dlx5表达并抑制Msx2表达,达到促进hPDLCs成骨分化的作用。PRP和CGF有望在牙周组织重建中发挥重要作用,但其作用机制、最适宜的作用质量分数及临床疗效尚需要进行进一步的临床研究。
利益冲突声明:作者声明本文无利益冲突。

