早期胃癌浸润深度的主要影响因素分析及预测模型的构建
蒋潇洒 杨倩 魏重操 肖彩兰 郝宇杰 刘奕辛 王进海
近年来随着内镜技术的发展,以内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)为代表的内镜治疗技术已被广泛地应用于早期胃癌(early gastric cancer,EGC)的治疗,但由于内镜治疗的局限性,术前需对病变进行准确的评估,以确认是否满足内镜治疗的适应证。2018日本胃癌治疗指南(第5 版)中对于ESD 治疗的适应证主要涉及病变浸润深度、大小、组织学类型以及溃疡等方面[1]。其中,对于病变的组织学类型(分化型、未分化型)、肿瘤大小以及有无溃疡可通过相关检查进行相对准确的评估。
对于病变浸润深度的评估,目前主要依赖于超声内镜、白光内镜和放大内镜联合窄带成像技术。但这些检查方法都有一定的局限性,准确性仍然有待进一步提高[2]。本研究旨在通过分析影响EGC 浸润深度的相关因素来建立预测模型,以期在内镜评价的基础上,为EGC 浸润深度的评估提供一定的参考依据。
1 材料与方法
1.1 临床资料
选取2011年1月至2019年12月于西安交通大学第二附属医院就诊的451 例EGC 患者为研究对象。纳入标准:1)病理诊断为EGC(包括高级别上皮内瘤变);2)接受胃癌根治术或ESD 治疗,且术前未行任何抗肿瘤治疗;3)术前均在本院接受胃镜检查,且存有清晰完整的内镜图片资料;4)临床病理资料完整。排除标准:1)合并其他部位的原发癌;2)复发性胃癌或残胃癌;3)因在外院行内镜下活检而影响病变形态的评估;4)合并严重的肝脏、肾脏疾病或者其他可能会导致血液系统异常的疾病或原发的血液系统疾病患者。根据上述标注,共纳入EGC 患者409 例。
1.2 方法
1.2.1 收集指标 通过HIS 系统和胃镜系统回顾性收集患者基本信息、疾病特征、实验室检查结果(血小板计数、中性粒细胞计数、单核细胞计数、淋巴细胞计数、CEA、CA724、CA199)、胃镜检查结果(肿瘤部位、肿瘤大小、内镜下分型、组织学分型、有无发红、表面表现、是否合并溃疡以及边缘有无隆起)、术前活检及手术组织病理结果(病理组织类型、分化程度、浸润深度、有无萎缩、有无肠化)。收集的所有临床资料以接受手术治疗当次的住院资料为准。
1.2.2 相关指标及定义 EGC 的诊断依据病理结果,其中不规则的腺上皮细胞团或孤立的腺上皮细胞浸润黏膜固有层间质,局限于黏膜肌层以内为黏膜内癌(M 组),超过黏膜肌层达到黏膜下层,但未侵及胃固有肌层者为黏膜下癌(SM 组)[3],见图1。依据世界卫生组织(WHO)消化系统肿瘤组织学分型标准[4]将EGC 分为分化型和未分化型,依据肿瘤的组织学分布特征分为单纯分化型(pure differentiated,PD)、单纯未分化型(pure undifferentiated,PUD)和混合型(mixed,M),其中PD 为组织学中分化成分占90%以上者,PUD 为未分化成分占90%以上者,组织学上既有分化成分又有未分化成分的定义为混合型。依照巴黎分型标准[5],EGC 依据内镜下表现分为隆起型(0-Ⅰ)、平坦型(0-Ⅱ)和凹陷型(0-Ⅲ)。中性淋巴细胞比值(NLR)由中性粒细胞和淋巴细胞比值计算得出,单核淋巴细胞比值(MLR)由淋巴细胞和单核细胞比值计算得出,血小板淋巴细胞比值(PLR)为血小板与淋巴细胞的比值。
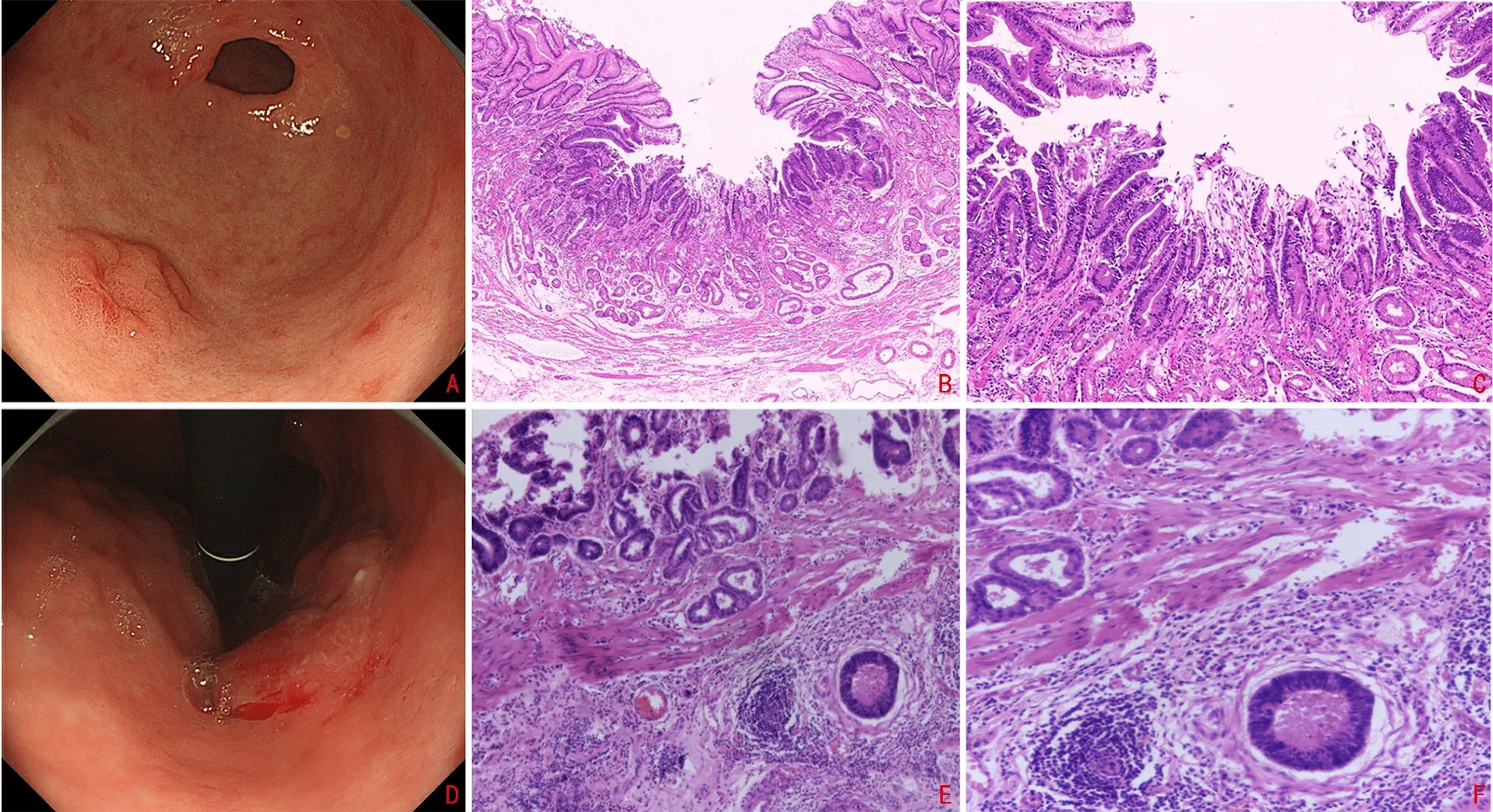
图1 EGC 胃镜和病理图片
1.3 统计学分析
采用SPSS 23.0 进行统计学分析。计量资料表示为均值±标准差,两组之间的差异使用t检验进行比较;分类资料采用计数,并计算其百分比,使用x2或Fisher确切概率法比较差异;NLR、PLR 和MLR 根据各自的中位数进行分组;多因素分析采用Logistic 回归分析法。为了评估独立危险因素预测浸润深度的价值,以术后病理结果为标准,绘制预测模型的受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积。采用R 软件(R4.0.4),应用rms 程序包构建基于多因素Logistic 回归分析预测早期胃癌浸润深度的列线图模型,采用Bootstrap 法做内部验证并计算一致性指数(C-index)确定模型区分度,通过构建SM 层浸润的预测概率与实际发生概率的校准曲线,进行一致性测试。以P<0.05 为差异具有统计学意义。
2 结果
2.1 样本人群的基本资料
本研究共纳入EGC 患者409 例,其中304 例接受了胃癌根治术,105 例接受了ESD 治疗。平均年龄为(61.44±9.66)岁,平均BMI 为(22.73±3.23)kg/m2。其中,男性310 例(75.79%),有吸烟史者144 例,有饮酒史者74 例,有家族肿瘤遗传史者28 例;患有高血压者83 例,患有糖尿病者26 例,患有冠心病者43 例,见表1。
2.2 样本人群的疾病特征
409 例EGC 患者中M 组240 例,SM 组169 例。分化型288 例,占70.42%;病变位于胃体下1/3 者居多,占43.03%。内镜下分型以巴黎分型0-Ⅱ型为主,占87.04%;组织学类型以单纯分化型为主,占67.24%,见表1。
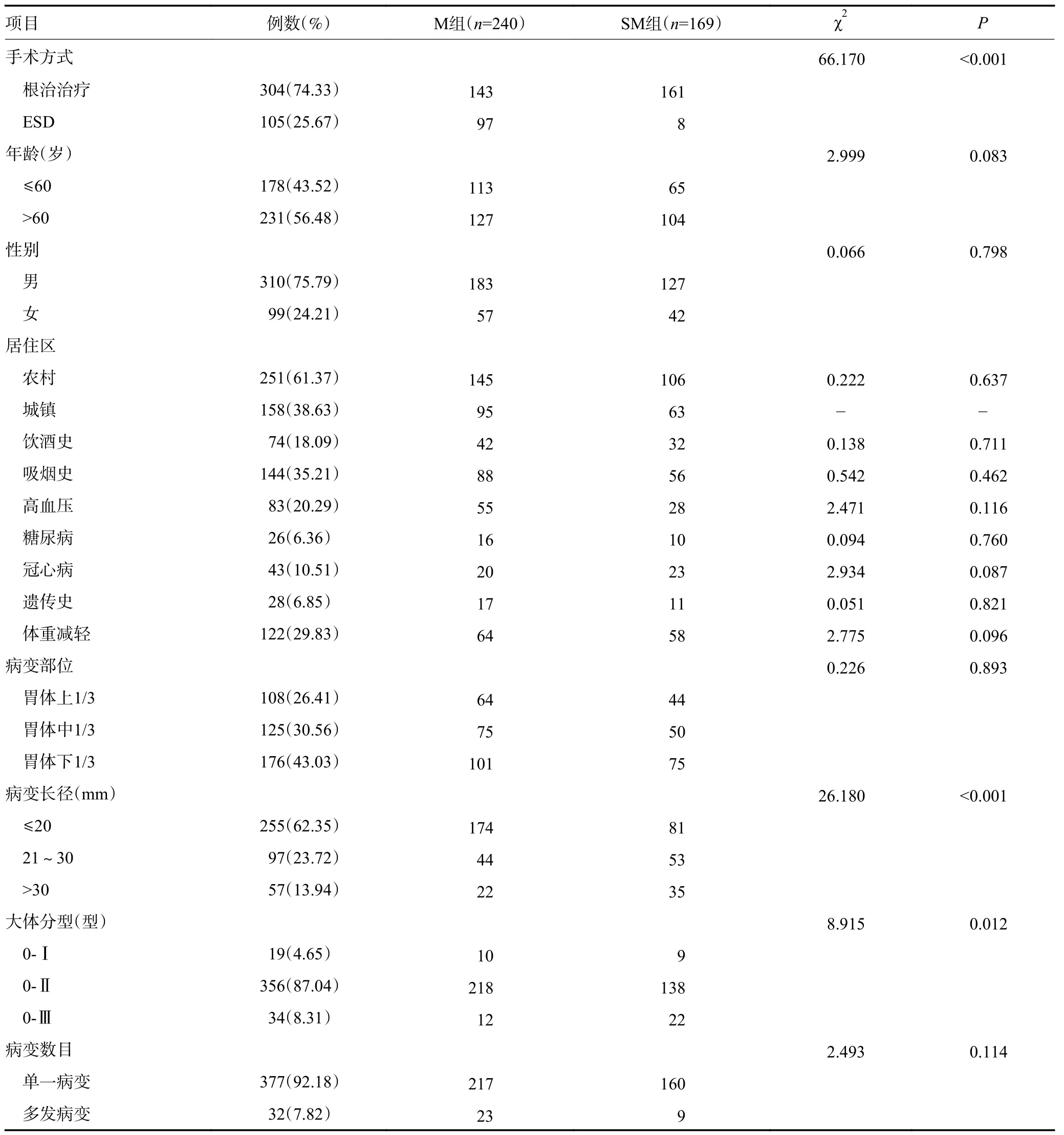
表1 M 组与SM 组EGC 患者临床特征的比较
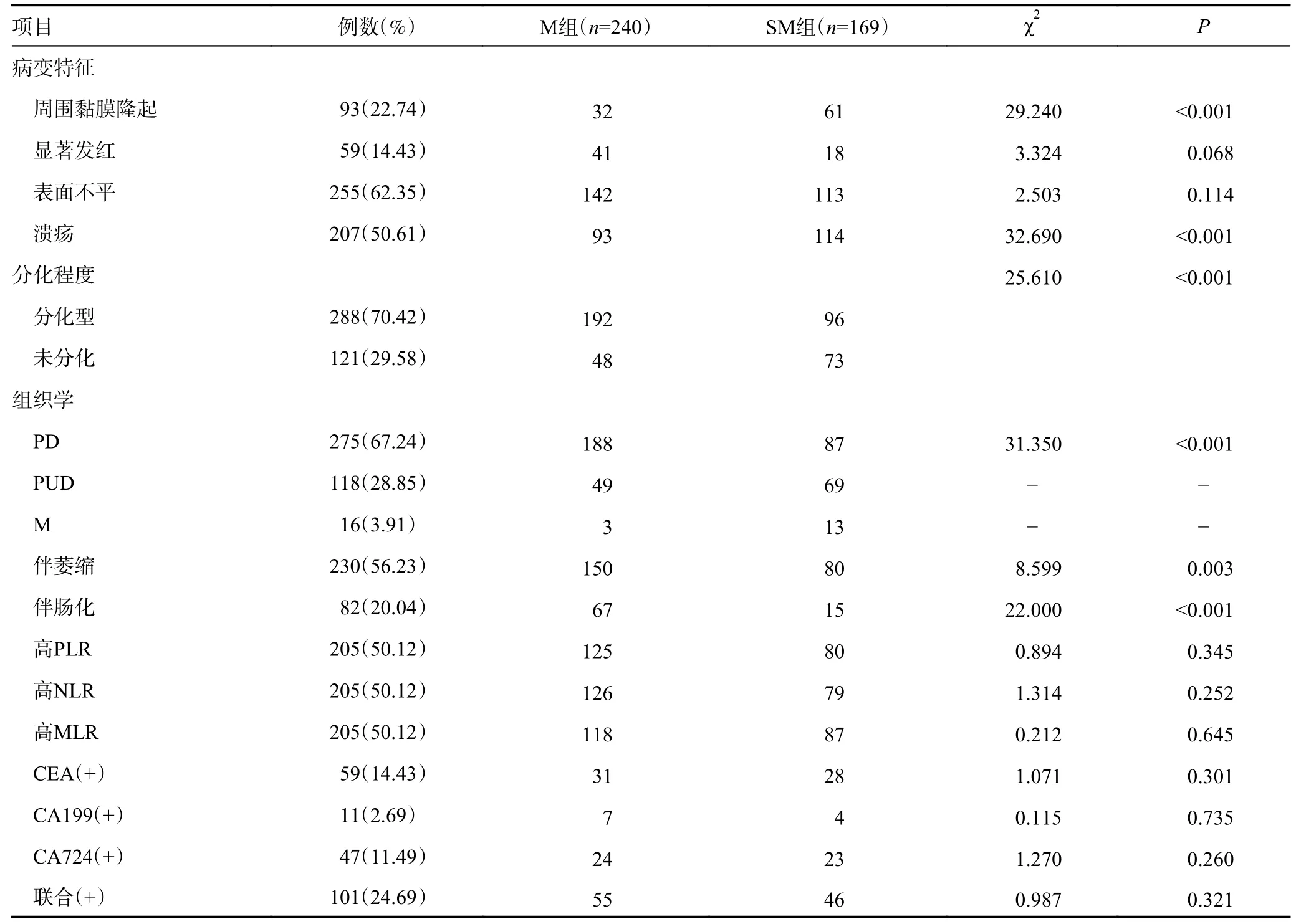
表1 M 组与SM 组EGC 患者临床特征的比较 (续表1)
2.3 影响EGC 浸润深度的相关因素分析
M 组和SM 组比较发现,两组在病变长径、分化程度、病变特征(溃疡和周围黏膜隆起)、内镜下分型、萎缩、肠化、组织学方面差异均具有统计学意义(均P<0.05)。多因素Logistic 回归分析结果显示病变长径>20 mm、病变边缘隆起、溃疡以及组织学混合型、未分化型都是病变SM 层浸润的独立危险因素(P<0.05),而肠化则是M 层浸润的独立危险因素(P<0.05),见表2。
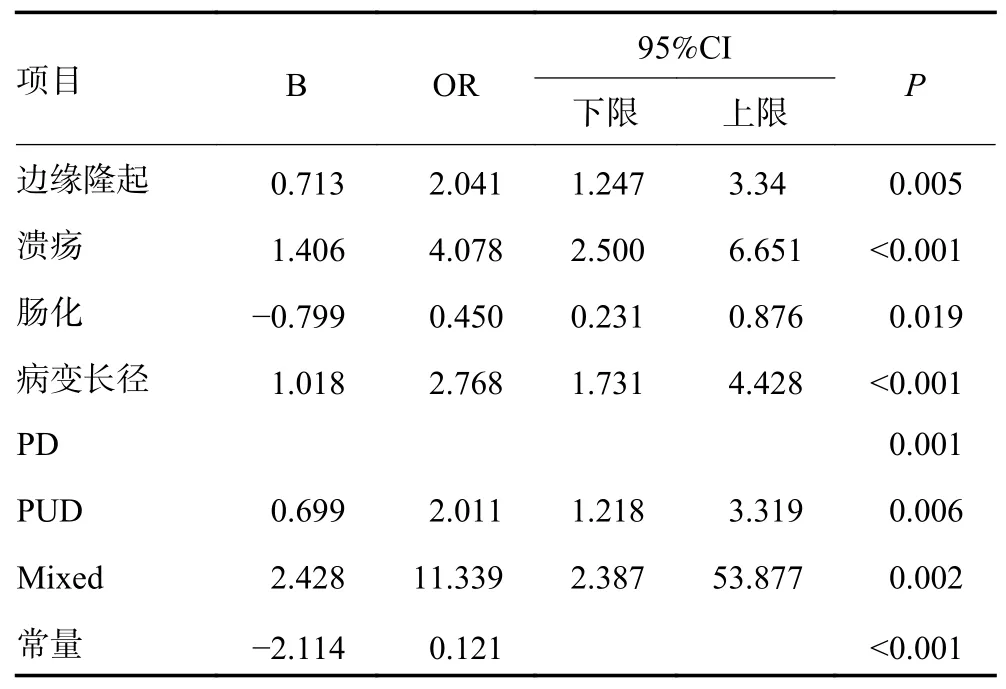
表2 影响EGC 浸润深度的多因素分析
2.4 EGC 浸润深度的预测模型
为比较分化程度和组织学分型对EGC 浸润深度的预测价值,将两者分别联合其他危险因素建立预测模型,以组织学特征构建的预测模型ROC 曲线下面积为0.769(95%CI:0.724~0.814,P<0.001),以分化程度构建的模型ROC 曲线下面积为0.756(95%CI:0.710~0.802,P<0.001),见图2。对比分析,以组织学分型为基础建立的预测模型诊断性能较好。基于以上分析结果,以病变长径、病变边缘隆起、溃疡、肠化和组织学分型为变量建立列线图模型,见图3。
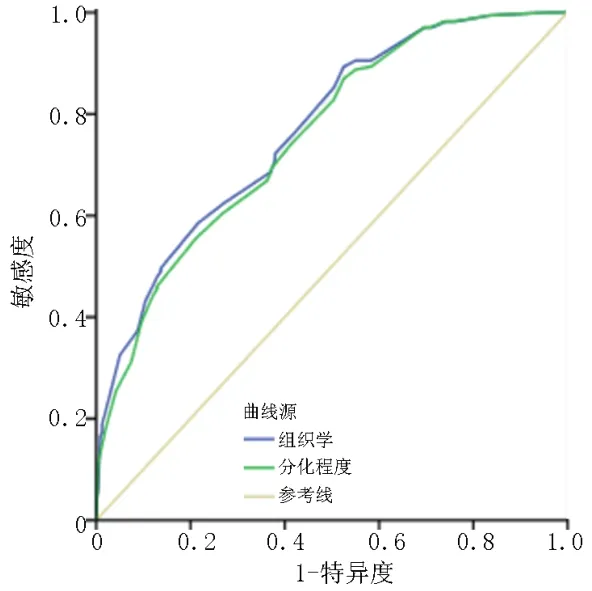
图2 分化程度和组织学分型预测EGC 患者浸润深度的ROC 曲线
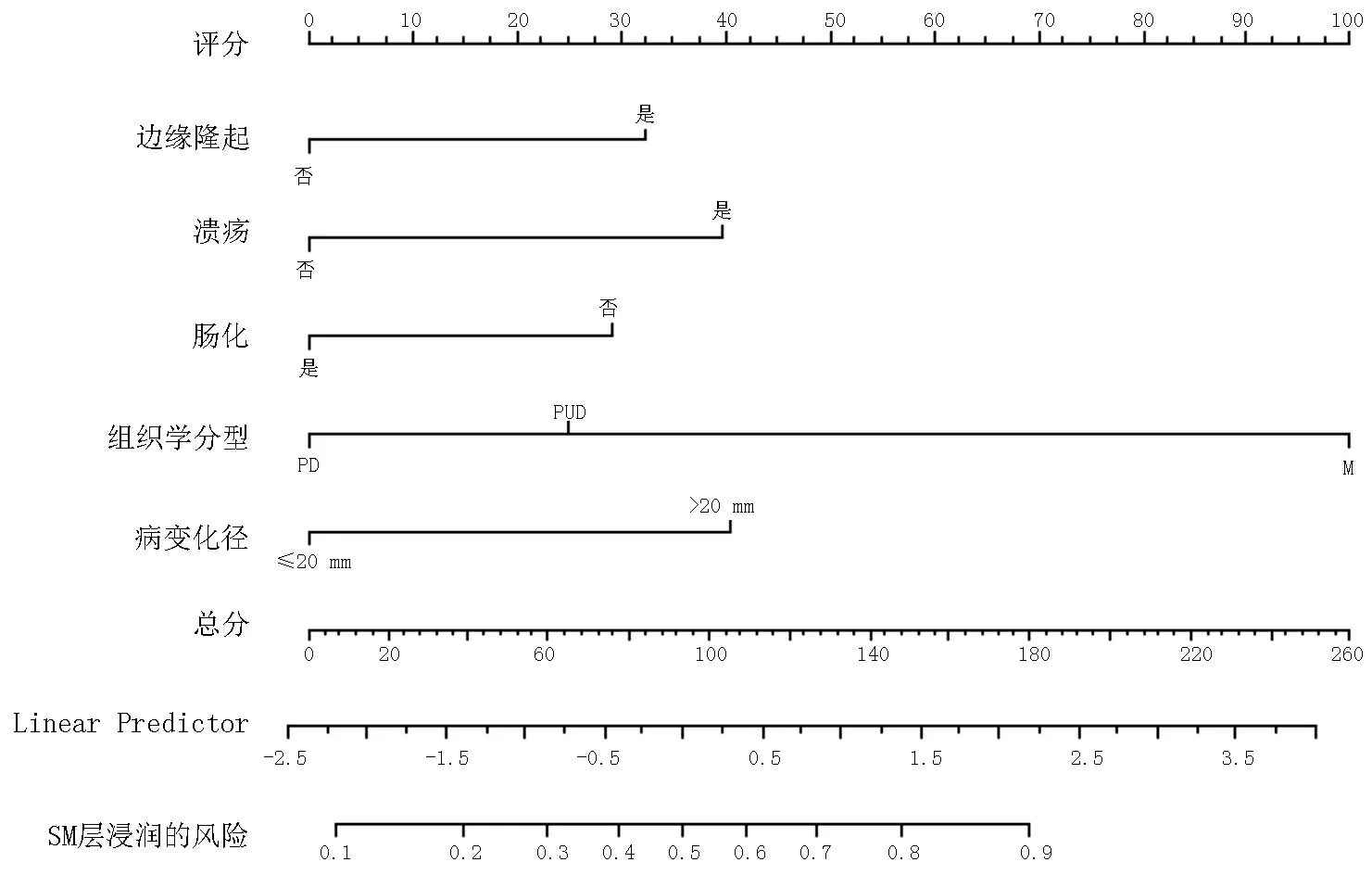
图3 预测EGC 浸润深度的列线图模型
2.5 列线图预测模型的评价
应用Bootstrap 自抽样法对上述模型进行内部验证,重复抽样1 000 次,计算的C-index 值为0.776,表明该预测模型具有较好的区分度(图4A)。预测值同实测值基本一致,说明该列线图预测模型具有较好的预测能力。基于活检结果进行内部验证,计算的C-index值为0.753,预测值同实测值也基本一致(图4B)。

图4 列线图预测模型的校准曲线
3 讨论
ESD 因具有创伤小、恢复快,能将病灶完整切除以及术后可获得准确的病理诊断资料等优势,已成为消化道黏膜及黏膜下病变的主要治疗手段[6]。目前,ESD 被推荐为黏膜内癌的最佳治疗手段,而一旦出现黏膜下层浸润,则推荐外科手术[7]。因此,术前对于病变浸润深度的评估尤其重要,临床实践中如果高估了ECG 病变的浸润深度将导致不必要的外科手术,而低估了浸润深度又会增加二次手术的风险。本研究通过对比分析M 组与SM 组EGC 患者的临床资料,探索与浸润深度相关的术前影响因素,以此构建列线图预测模型,并对模型的预测性及准确度进行内部验证,以期为EGC 病变浸润深度的评估提供一定的参考依据。
本研究通过比较分析M 组和SM 组患者的临床病理资料,发现两组在年龄、性别、BMI、糖尿病、高血压、冠心病、吸烟史、饮酒史、家族遗传史、体质量减轻、居住区方面差异均无统计学意义(均P>0.05),说明两组在年龄、性别、个人史、疾病史方面分布均衡,具有可比性。两组在病变部位、病变数目、病变特征(显著发红和表面不平)、术前PLR、NLR、MLR、CEA、CA199、CA724 以及三者联合结果方面差异均无统计学意义(均P>0.05);在内镜下分型、病变长径、分化程度、病变特征(溃疡和周围黏膜隆起)、萎缩、肠化、组织学方面差异均具有统计学意义(均P<0.05)。多因素Logistic 回归分析显示病变长径>20 mm、病变边缘隆起、溃疡以及组织学混合型、未分化型都是病变SM 层浸润的独立危险因素、而肠化与M 层浸润相关。
关于EGC 病变的镜下表现,Abe 等[8]通过对比M-SM1 层和SM2 层病变的镜下表现,发现显著发红、表面不平、边缘隆起和肿瘤直径>30 mm 的病变SM2层浸润的风险更高,并以此建立了DPS 评分标准。本研究中单因素分析显示显著发红和表面不整与病变的浸润深度并没有关联,病变边缘隆起和直径>30 mm与SM 层浸润相关,与其他研究结果基本一致[9]。DPS 评分认为>30 mm 为SM2 层浸润的危险因素,但本研究通过对病变长径进行详细的分组分析,结果显示≤20 mm 的病变以M 层浸润为主,21~30 mm 和>30 mm 的病变以SM 层浸润为主,单因素分析显示不同分组之间浸润深度的差异具有统计学意义。两两分组进一步比较发现,21~30 mm 组和>30 mm 组SM 层病变的比例差异无统计学意义,但均显著高于≤20 mm 组。因此,本研究在多因素分析中以20 mm为界进行了分析。区别于DPS 评分,本研究并未发现显著发红和表面不整与SM 层浸润的关系,因为这两种表现并不特异,临床上很难与炎性病变进行区分。本研究发现溃疡的存在也是EGC 病变SM 层浸润的独立危险因素,这与Abe 等[8]的研究结果一致。
本研究发现M 组肠化的比例远远高于SM 组,多因素分析显示伴有肠化的病变似乎表现出较浅的浸润。虽然肠上皮化生被认为是胃癌前病变,肠化者发生胃癌的风险明显高于正常人群。但目前的研究表明,肠化与Lauren 分型的肠型胃癌的发生密切相关[10]。而Lauren 分型中的肠型胃癌是和WHO 分类中的乳头状和中高分化的管状型腺癌相对应的[11],通常组织分化较好,因此和较浅的浸润深度相关。由于本研究为回顾性研究,只能依靠既往的病理结果进行肠化的诊断,再加上大多数病理医师可能将重点放在对胃癌的诊断,而存在遗漏肠化诊断的情况。因此,对于肠化与胃癌浸润深度的关系还需进一步研究。
组织学特征与浸润深度的关系基本得到了证实,只是目前多数研究均是分析分化程度与浸润深度之间的关系,并且也是根据主要成分来评估分化程度[9,12]。近年来有研究发现,次要成分对肿瘤的生物学行为也起到重要作用,并且发现混合型病变表现出更强的转移能力[13-15]。本研究分析发现,混合型病变SM 的比例高于PUD 和PD 型,虽然和PUD 型的差异无统计学意义,但也在一定程度上提示混合型病变具有相对较强的侵袭能力。因此,只基于主要成分的分组可能会低估了那些既有分化成分又有未分化成分的病变的侵袭能力,而容易对病变浸润深度做出错误的评估。为了比较这两种分类方法,将其分别联合其他危险因素构建预测模型,结果显示两者均具有相对较好的诊断性能(AUC>0.7),以组织学分型为基础构建的预测模型的AUC 略高于分化程度。因此,本研究以组织学特征联合其他危险因素构建了预测EGC 浸润深度的列线图模型。
列线图作为可视化的图像模型,相比复杂的回归方程,其预测结果更加直观,临床实用性也更强[16]。在临床实践中,根据模型中各个变量的不同分类向上投射到小标尺即可得到相应的得分,各个预测因子的得分相加即为总分,总分向下投射就可以得到事件发生的概率。本研究建立的列线图预测模型,经内部验证也显示出良好的预测能力,涉及到的各个因素通过术前常规的内镜检查及活检就可以获得,可以方便简单的计算出EGC 病变黏膜下层浸润的概率,进而为EGC 患者治疗方案的选择提供一定的参考依据。此外,考虑到术前依靠内镜活检获取的组织学信息与术后病理结果可能存在一定的偏差。为评价活检结果的可靠性,本研究使用活检结果进行了内部验证,结果也显示出良好的预测能力。
综上所述,病变长径、组织学特征、边缘隆起、非肠化、溃疡是影响EGC 病变浸润深度的独立危险因素,以此构建的列线图模型可以较准确地评估EGC病变的浸润深度,这可在内镜检查的基础上为EGC病变浸润深度的评估提供一定的参考依据。

