不同照射野对达完全缓解食管鳞癌患者失败模式影响的分析
沈文斌 陈俊强 祝淑钗
食管癌为影响我国居民健康的主要疾病之一[1],由于其前期发病的隐匿性,多数患者在临床就诊时均为中晚期而失去手术治疗的机会。基于基因突变的靶向药物和基于免疫节点抑制剂的免疫治疗为晚期食管癌患者带来新的希望[2-3],但目前根治性放(化)疗仍是我国不能手术治疗食管癌患者的主要治疗手段。然而,放疗剂量、剂量分割模式、临床靶区大小和放、化疗联合治疗模式等仍是接受放射治疗的食管患者的主要争议问题[4-5]。精确放疗的重点之一为靶区的精确勾画。但是,目前临床上对于接受根治性放(化)疗的食管癌患者究竟应该使用选择性淋巴结照射(elective nodal irradiation, ENI)还是累及野照射(involved-field irradiation,IFI)仍存在较大争议,争议的主要焦点之一在于与IFI 相比,ENI 未降低患者的野内复发率,却增加了患者的不良反应发生率[6-7]。为进一步明确食管鳞癌患者接受这两种不同治疗模式治疗后的失败模式,尤其是患者经根治性放(化)疗后达完全缓解(complete remission,CR)的患者的失败模式,本文进行了该项回顾性研究。
1 材料与方法
1.1 一般临床资料
入组标准:治疗前电子胃镜/食管镜咬检病理为食管鳞状细胞癌;于河北医科大学第四医院接受根治性放(化)疗;依据我国非手术治疗食管癌的临床分期草案,患者均为临床T1-4N1-2M0 期;KPS 评分≥80 分;病理、临床和随访资料完善。
收集2011年1月至2014年12月于河北医科大学第四医院接受根治性放(化)疗的食管鳞癌患者,其中符合入组标准的患者701 例,男女比例为1.8∶1;中位年龄67 岁,≥70 岁患者281 例(40.1%);病变位于颈段、胸上段、胸中段和胸下段者分别为30 例(4.3%)、206 例(29.4%)、337 例(48.1%)和128 例(18.3%);中位食管病变造影长度5.5 cm,其中≤5.0 cm者312 例(44.5%);cT1、T2、T3 和T4 期者分别占2.0%、34.3%、20.4% 和43.2%;cN0、N1 和N2 期患者分别占53.9%、33.5% 和12.6%;中位放疗剂量为62 Gy,其中接受≤62 Gy 的患者为416 例(59.3%);接受化疗的患者为232 例(33.1%),其中同步化疗132例(56.9%)。全组患者临床一般资料见表1,图1。
1.2 方法
1.2.1 放疗方式 522 例(74.5%)患者接受IFI 治疗,另179 例(25.6%)患者接受ENI,IFI 和ENI 患者的靶区勾画方式同既往研究[8]。两组患者在病变部位、病变长度、cT 分期、cN 分期、处方剂量和化疗人数上的构成比率具有显著性差异(χ2=57.881、9.124、10.373、6.221、22.103、4.685,P=0.000、0.003、0.006、0.045、0.000、0.030),见表1。
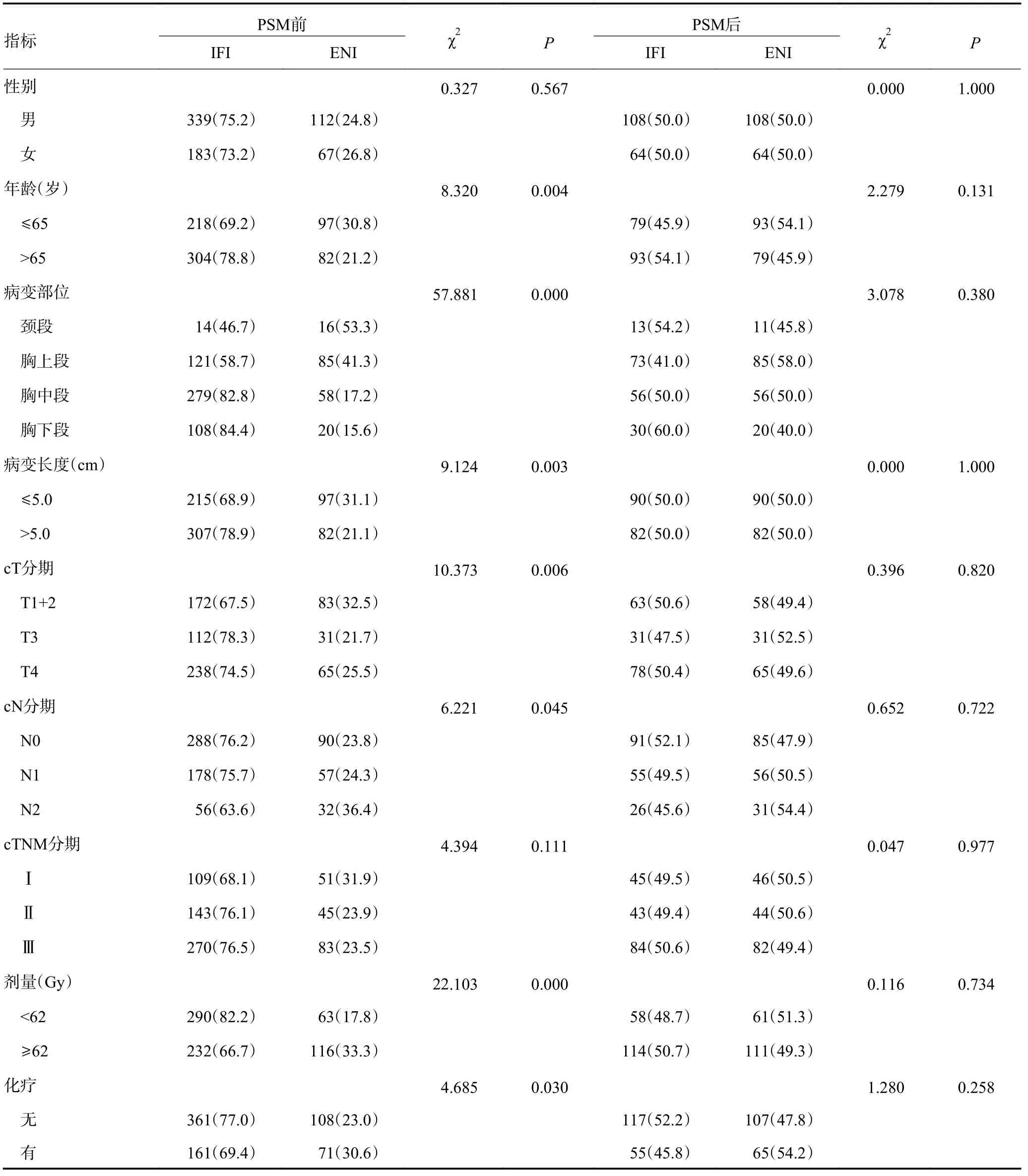
表1 不同照射野患者组成情况分析结果 n(%)
1.2.2 复发的判断标准与定义 野内复发为原照射野内的食管或和淋巴结复发;野外复发为原照射野外的食管或和淋巴结复发;如食管复发位于原照射野内外交界,则依据病变中心来确定。食管癌复发的判断标准为电子胃镜/食管镜的咬检病理,淋巴结复发的诊断标准依据既往研究结果来判断[9-10]。
1.2.3 观察指标及近期疗效判断标准 应用既往研究方法[11]对放疗结束患者进行疗效评价:造影评价为CR、CT 最大管壁厚度≤1.20 cm 且放疗后残存淋巴结体积≤1.00 cm3者为CR;造影评价部分缓解(partial remission,PR)或CT 最大管壁厚度>1.20 cm 者、造影评价CR 且cT 最大管壁厚度≤1.20 cm 但放疗后残存淋巴结体积 >1.00 cm3者为PR;造影评价(no remission,NR)或疗末CT 有新发病灶者为无缓解或病情进展。
随访期间1、3、5年的总生存率(overall survival,OS)和复发率,比较不同照射野患者的OS 和RR 的差异、不同照射野患者达CR 后的复发部位差异等。
1.2.4 随访 随访方式以电话随访、门诊复查为主,并结合病例资料查阅。自患者放疗开始之日算起,随访截止日期为2019年12月31日,患者第1年为每3~6月复查1 次,随后每6~12 个月复查1 次,失访17 例,随访率97.6%,失访病例以末次随访日期按死亡统计。
1.3 统计学分析
采用SPSS 19.0 软件进行统计分析,利用χ2检验进行组间构成比比较,采用Kaplan-Meier 法进行生存和复发分析,Log-rank 法检验单因素预后分析。时间计算从放疗之日开始,多因素分析采用Logistic 比例风险模型,并用向前Wald 筛选法评估复发的独立预后因素。对于全组患者多因素分析P<0.05 的变量在ENI 和IFI 两组间采用倾向得分匹配(propensity score matching,PSM)法进行配对,以平衡可观察的潜在混杂因素。P<0.05 为差异具有统计学意义。

图1 入组患者分布
2 结果
2.1 全组患者生存情况
患者1、3、5年OS分别为72.2%、32.6%和18.1%,中位OS 为20.4 个月;1、3、5年复发率分别为27.6%、52.2%和59.4%,中位复发时间为11.6 个月。
2.2 全组患者复发情况分析
截止随访日,有335 例患者出现复发,其中IFI 组复发247 例(47.3%),ENI 组复发88 例(49.2%),两组患者复发率无显著性差异(χ2=0.182,P=0.670)。
335 例复发患者中野内复发220 例(65.7%)、野外复发80 例(23.9%)、两者均有35 例(10.4%)。IFI与ENI 两组患者复发部位差异具有统计学意义(χ2=10.372,P=0.006),见表2。

表2 不同照射野复发患者PSM 前后复发类型分析结果 n(%)
2.3 不同治疗疗效与患者复发情况分析
治疗后近期疗效为CR、PR 和NR 者分别为189例(27.0%)、479 例(68.3%)和33 例(4.7%)。IFI 与ENI 两组患者近期疗效具有显著性差异(χ2=13.385,P=0.001),见表3。
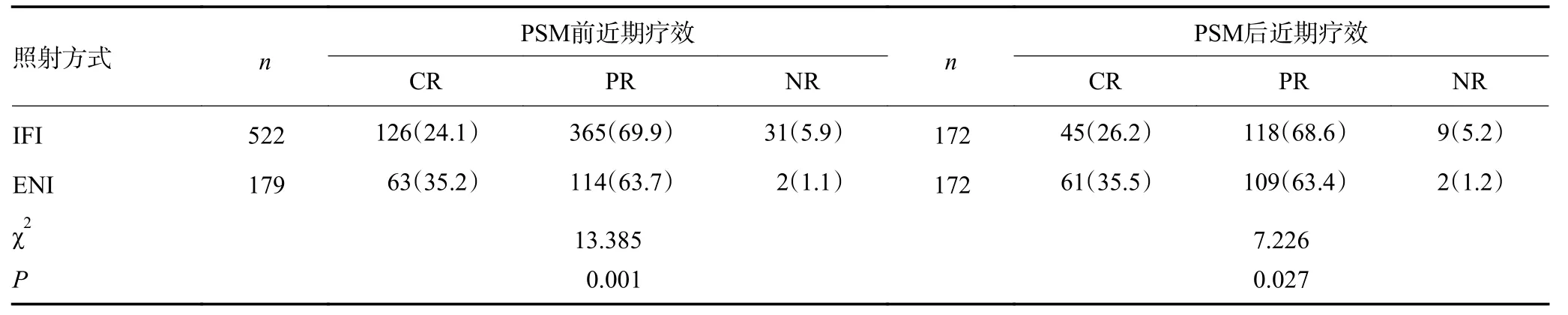
表3 不同照射野患者近期疗效PSM 前后分析结果 n(%)
达CR 患者共189 例,其中ENI 组63 例,IFI 组126 例,两组患者总体复发率(31.7%vs. 45.2%)差异无统计学意义(χ2=3.167,P=0.075);IFI 与ENI 两组患者相比复发部位差异亦无统计学意义(χ2=3.457,P=0.178),见表4。
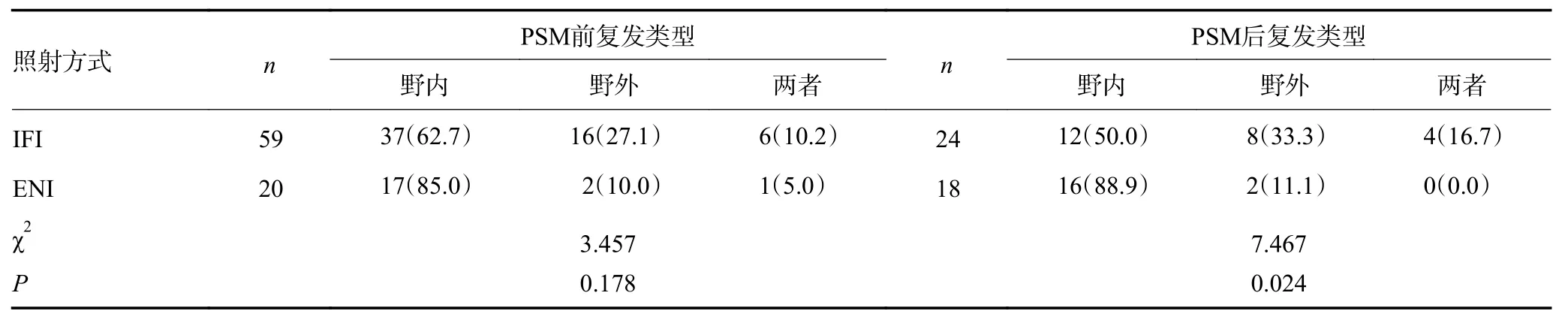
表4 不同照射野下达CR 患者PSM 前后复发类型分析结果 n(%)
2.4 影响全组701 例患者复发的Logistic 分析结果
将可能影响全组患者复发的因素纳入Logistic 多因素分析模型,结果显示食管癌病变部位、食管钡餐造影长度和临床T 分期为影响本组患者出现复发的独立性因素(P=0.007,0.003,0.001),见表5。

表5 影响全组701 患者复发的Logistic 分析结果
2.5 PSM 结果
依据可能影响患者复发的因素例如食管病变部位、病变长度、分期、处方剂量及联合化疗等指标,将ENI 和IFI 组患者按照1∶1 进行PSM 分析,每组均为172 例患者,PSM 后两组患者各项临床、物理指标构成比均无显著性差异,见表1。
IFI 组患者出现复发90 例(52.3%),与ENI 组患者(83 例,48.3%)相比,无显著性差异(χ2=0.570,P=0.450)。IFI 与ENI 两组患者复发部位具有显著性差异(χ2=10.513,P=0.005),见表2。
IFI 与ENI 两组患者近期疗效差异有显著性(χ2=7.226,P=0.027),见表3。PSM 后CR 患者为106 例,其中IFI 组患者为45 例,与ENI 组CR 患者相比,IFI 组CR 患者复发率(53.3%vs.29.5%)显著升高(χ2=6.145,P=0.013);两组患者复发部位亦具有显著性差异(χ2=7.467,P=0.024),见表4。
2.6 影响PSM 后344 例患者复发的Logistic 分析结果
将可能影响患者复发的因素纳入Logistic 多因素分析模型,结果显示近期疗效和食管癌病变部位为影响复发的独立性因素(P=0.014,0.018),见表6。
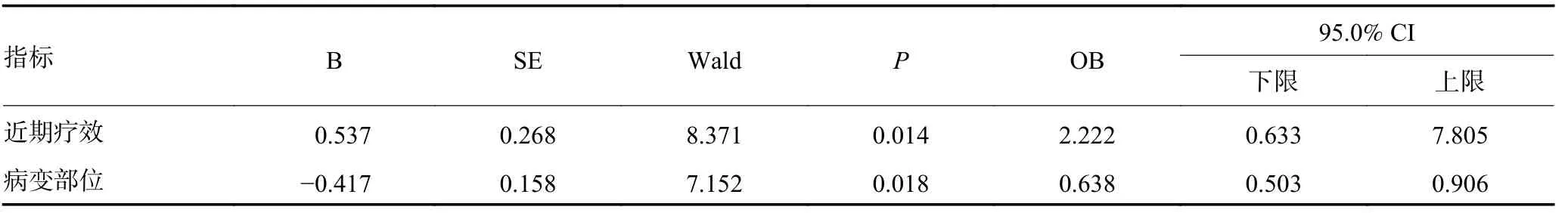
表6 影响PSM 后344 例患者复发的Logistic 分析结果
3 讨论
根治性放(化)疗为非手术治疗食管癌患者的主要治疗手段,但食管癌患者的最佳治疗模式仍无定论,其中临床靶区的范围为争论的主要内容。无论采用何种照射方式,食管癌局部区域复发或和远处转移均为其主要治疗失败模式[12-13]。有研究认为经治疗后达CR的患者预后优于其他患者,其复发模式可能也有所不同[14-15]。本研究先对全组患者的治疗结果和失败情况进行分析,结果显示虽然两组患者在复发部位上具有显著性差异,但总复发率无显著性差异,且IFI 组患者的野内复发率低于ENI 组,而ENI 组患者的野外复发率低于IFI 组;对两组治疗后达CR 患者分析显示复发部位无显著性差异。进而对入组患者进行PSM 分析,结果同样显示对于IFI 组的CR 患者其野内复发率低于ENI 组患者,而野外复发率却高于后者。本研究的ENI 组患者中放疗剂量较高者和联合化疗者所占比率均高于IFI 组,理论上认为放疗高剂量和联合化疗均对患者的生存有益,但本研究结果显示,ENI 全组患者的野内复发率显著性高于IFI 全组,而对于ENI 组中取得CR 的患者其复发率显著性低于IFI 组患者,这可能因为食管癌接受新辅助放、化疗患者在取得PCR 后患者才能受益。
对于接受ENI 或IFI 的食管鳞癌患者其治疗失败率的优劣,目前结论不一,有的研究认为两者无显著性差异,如Li 等[16]对644 例接受不同照射方式的食管鳞癌患者的预后等进行了分析(ENI=157,IFI=487),结果显示无论是PSM 前还是PSM 后(ENI=157,IFI=314),两组患者的食管肿瘤局部和淋巴结复发等方面均未见显著性差异。Cheng 等[17]对接受不同照射方式的1 348 例食管鳞癌患者进行了一项Meta 分析,结果显示ENI 和IFI 组患者的局部控制率和OS 均无统计学差异,且IFI 与长期复发或转移无关,同时认为ENI 并未降低照射野外的复发率。有的研究则认为IFI 的疗效优于ENI,例如Yamashita 等[18]评估了239例(ENI=120 例,IFI=119 例)食管癌患者的预后,结果显示两组患者的OS 无显著性差异(P=0.087),但IFI患者的3年LCR 显著性高于ENI 组(P=0.039),且该研究显示IFI 并未增加淋巴结复发的风险(ENI为27.5%,IFI 为13.4%)。有的研究则认为ENI 预后较IFI 好,例如Jing 等[19]对89 例(ENI=51 例,IFI=38 例)食管癌患者的长期生存进行了分析,结果显示相对于IFI,ENI 组患者的10年疾病特异性总体生存率(P=0.019)、10年DFS(P=0.040)和10年局部无复发生存率(P=0.018)均显著提高;其中照射方式、病变长度和临床分期为影响患者OS 和局部控制率的独立性因素,ENI 可以改善无法手术食管癌患者的疾病特异性总体生存率和局控率。Zhao 等[20]同样认为接受ENI 患者的局部区域控制率显著性优于IFI(P=0.025)。有报道认为ENI、联合化疗和靶向药物治疗的治疗模式与IFI 联合化疗相比可能会降低局部区域失败率[21]。本研究结果显示食管鳞癌患者接受ENI 或IFI 治疗的总失败率无显著性差异,结合既往研究,本文认为接受根治性放(化)疗的食管鳞癌患者治疗失败率的影响因素,主要与失败部位为照射野内有关,但该结论需要进一步对患者进行分层分析和前瞻性的研究结论加以证实。
本研究结果显示,即便是ENI 与IFI 两组患者的失败率无显著性差异,但两组患者的失败部位有显著性差异,ENI 组的野外复发率显著性低于IFI 组。白文文等[22]一项Meta 分析结果显示与IFI 比较,ENI降低了食管癌患者野外失败率(OR=3.727,P=0.007),但两组患者的局部控制率、总生存率和远处转移率均相似(P>0.05),但该文未对两种不同照射野的野内复发情况进行分析。另外,经治疗后达CR 的食管癌患者的失败率较低,且此部分患者的失败模式可能有别于未达到CR 的患者,Yamashita 等[14]回顾性分析了126 例接受ENI 治疗的食管鳞癌患者,结果显示全组87 例患者(69%)达到了CR,其中40 例患者出现治疗失败,局部失败和远处转移均为20 例,但无1 例出现孤立性淋巴结复发,其研究同时显示胸上段食管癌患者(34%)的局部复发率明显高于胸中段(9%)或胸下段食管癌患者(11%),认为ENI 可以有效地预防接受根治性放化疗食管鳞癌患者的区域性淋巴结复发。Onozawa 等[15]对102 例接受ENI 联合化疗的食管鳞癌患者进行分析,结果显示60 例患者治疗后达CR,达CR 后复发的患者中仅1 例患者出现单纯野内淋巴结复发,同样认为ENI 可以有效预防区域淋巴结转移。依据本研究结果和既往研究,随着放射生物学的研究进展和放疗技术的不断进步,IFI 已被运用于食管癌根治性放疗和术前放疗中[23-25],在这些研究中,阳性淋巴结一般被视为GTV,而相应危险淋巴结引流区或是淋巴结微转移病变并未接受预防性照射,因此应用IFI可能会导致照射野外淋巴结复发风险增加。
局部复发或(和)远处转移为接受根治性放、化疗非手术治疗食管癌患者的主要治疗失败模式,其中局部复发为主要原因,如何延迟、降低甚至消除这种治疗后的失败是临床研究的热点问题。影响患者出现局部复发的因素很多,其中病变部位为主要原因之一[14,20],这同本研究结果一致。另外,肿瘤局部残留往往是恶性肿瘤患者治疗后复发的主要原因之一,也是治疗后有无肿瘤残余的重要指征[26-27],既往研究显示治疗后达到CR 与PR 及NR 患者相比,25%~30%CR 患者的5年生存率得到提高[28-29],本研究结果显示患者近期疗效为影响患者复发的独立性因素,治疗后达CR患者的复发率显著性低于PR 和NR 组患者。
由于本研究为回顾性,因此有一些局限性,包括单中心研究病例选择的偏倚、潜在的混杂因素和样本数量较少等;此外,研究的单一性也可能影响本研究的最终结论。因此,需要精心设计的、更大的多中心前瞻性试验结果来进行验证。
总之,本文研究表明,对于接受根治性放(化)疗的食管鳞癌患者无论是ENI 还是IFI,局部区域复发仍然是最常见的失败模式;近期疗效和病变部位为影响患者治疗后复发的独立性因素;ENI 与IFI 这两种治疗模式的总治疗失败率无显著性差异,但其复发部位存在显著性差异,尤其是治疗后达CR 的患者。

