化学浴沉积法制备氢氧化镍及其催化过一硫酸盐降解亚甲基蓝
夏 强,廖小刚,李 纲
(重庆理工大学化学化工学院,重庆400054)
染料废水色泽深、COD值高,且染料分子本身多带有毒性,对环境和生物健康具有极大的危害。随着印染行业的发展,染料废水的排放量日益增加,生态环境所面临的压力持续加大,人们对染料废水的高效无害化处理技术的需求也因此更为迫切。染料废水的处理可分为物理法、化学法和生物法三类。物理法作为“转移”而非“清除”的方法,存在着废弃染料分子因无法被彻底清除而对环境仍有潜在污染风险的缺陷;生物法则存在适用范围窄、处理周期长和效率不高的缺点;相比之下,以高级氧化技术为基础的化学法在染料废水处理领域更具优势。
基于单过硫酸氢钾(PMS)的氧化法是新近发展起来的一类高级氧化技术。在以往的高级氧化技术中,通常由活性氧自由基如·OH、·O2-等承担难降解有机物的氧化任务;而在PMS氧化体系中,·SO4-的产生则成为了一大亮点。相比于·OH,·SO4-具有更高的氧化还原电位(E·OH=2.80 V[1],E·SO-4=2.5~3.1 V[2])和在溶液中更长的寿命,加之PMS易于保存和运输,因此基于PMS的高级氧化技术在难降解有机污染物处理领域极具发展前景和应用潜力[3]。
·SO4-可通过活化PMS而产生[4-5]。活化方式主要有均相催化[6](过渡金属离子)、非均相催化[7](过渡 金 属 氧 化 物 等)、紫 外 光 活 化[8]、热 活 化[9]、碱 活化[10]和超声活化[11]等。在前述方法中,非均相催化因具有催化剂可回收再利用、无需向反应体系额外提供能量、废水处理成本较低等优点,而成为PMS活化的首选。迄今为止,已有多种过渡金属氧化物(如Co3O4[12]、NiO[13]、CuO[14]等)或复合过渡金属氧化物(如FeCo2O4[15]、NiCo2O4[16]等)被报道可作为催化剂用于PMS的活化。由过渡金属离子构成的氢氧化物通常是制得上述氧化物的母相前驱体,它们可以作为中间产物稳定存在。该类氢氧化物是否具有活化PMS的能力是值得研究和探讨的科学问题,然而,目前有关该类物质用于催化活化PMS的研究报道较少。
因此,为了验证由过渡金属离子构成的氢氧化物用于活化PMS的可能性,本研究选择Ni(OH)2作为研究对象,拟采用简单的化学浴沉积法进行材料的合成制备,随后以MB(结构式如图1所示)溶液作为模拟印染废水,系统考察催化剂投加量、PMS用量、MB溶液浓度等工艺参数对Ni(OH)2催化PMS降解MB效果的影响。在此基础上,借助自由基鉴定实验来探讨Ni(OH)2对PMS的活化机理。
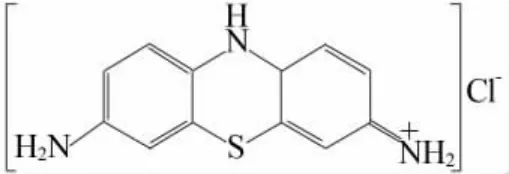
图1 MB分子结构Fig.1 Molecular structure of MB
1 材料与方法
1.1 实验药品与试剂
单过硫酸氢钾(PMS),纯度≥98%;亚甲基蓝(MB),纯度≥98%;浓氨水,质量分数为25%~28%;乙醇(EtOH)、叔丁醇(TBA)、过硫酸钾(K2S2O8)、六水合硫酸镍(NiSO4·6H2O)、亚硝酸钠(NaNO2)、硝酸钠(NaNO3)、草酸钠(Na2C2O4)、磷酸钠(Na3PO4),均为分析纯。
1.2 催化材料的制备
采用化学浴沉积法制备催化材料Ni(OH)2。制备 过 程 如 下:首 先,将NiSO4·6H2O(25 mmol)和K2S2O8(5 mmol)依次溶于300 mL去离子水中,得到澄清的均一溶液。随后,在强烈搅拌下向上述溶液中快速加入10 mL浓氨水。5 min后关闭搅拌,并将该混合液静置3 h,以使反应充分进行。采用真空抽滤方式收集沉淀,用去离子水充分洗涤后,于60℃下烘干,即得到黑色的粉体催化材料。
1.3 材料的表征
采用XRD-7000型X射线衍射仪对样品的晶相结构进行表征,Cu靶、Kα辐射、加速电压和电流分别为40 kV和40 mA、2θ扫描范围为10~80°。用Quanta F250型扫描电子显微镜(SEM)观察样品的形貌。
1.4 实验方法
准确称取一定量催化剂于300 mL烧杯中,加入250 mL MB溶液,开启电动搅拌器搅拌30 min,以使催化剂和MB溶液达到吸附平衡。随后,向上述混合液中加入一定量0.1 mol/L的PMS溶液,同时开始记录MB的降解时间,每隔一定时间用注射器抽取约3.5 mL样品,并立即混入150 μL浓度为3 mol/L的NaNO2溶液以猝灭反应,进行吸光度的测定。样品吸光度的测定在TU-1901型双光束紫外可见分光光度计上完成,采用光谱扫描方式测量,波长范围为500~700 nm。抽取的样品均经过孔径为0.22 μm的滤膜过滤,以避免催化剂颗粒的存在对溶液吸光度测量的干扰。所有实验均在室温(27℃±2℃)下进行。MB溶液的降解率通过下式进行计算。

式中:A0和At分别表示吸附30 min后和t时刻下MB溶液在最大吸收波长处的吸光度。
2 结果与分析
2.1 材料的物相结构与形貌分析
图2 a为采用化学浴沉积法制得的催化剂产物的XRD谱图。其中在2θ为12.28、24.59、36.09、37.12、41.85、49.71、65.08、66.49°处出现的特征衍射峰分别对 应 于Ni(OH)2·0.75H2O(JCPDS#38-0715)的(003)、(006)、(101)、(012)、(015)、(018)、(110)、(113)晶面,证明该催化材料为Ni(OH)2·0.75H2O。XRD谱图显示,这些特征衍射峰的峰型宽化,峰强度较低,表明采用化学浴沉积法得到的产物Ni(OH)2·0.75H2O晶化程度较低。图2b和2c为Ni(OH)2·0.75H2O在不同放大倍数下的SEM照片。由图2b和2c可知,产物整体呈现无规则颗粒状形貌,颗粒的尺寸介于亚微米级至数个微米级,部分颗粒之间存在团聚现象,形成了尺度更大的个体。图2c清晰显示,这些微粒具有微/纳结构,即单个微粒实际上是由众多花瓣状纳米片所组成,每个纳米片的片层厚度在35 nm左右。
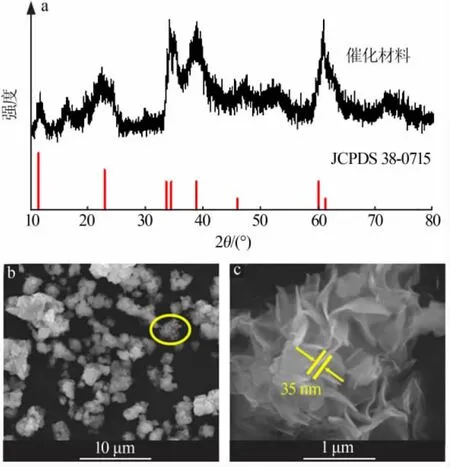
图2 产物的X射线衍射谱图(a)及扫描电镜照片(b、c)Fig.2 X-Ray diffraction pattern(a)and SEM images(b,c)of production
2.2 单因素实验分析及催化剂重复使用性能的研究
2.2.1 不同体系下MB溶液的降解效果
图3 为不同体系下MB溶液的降解效果。待降解MB溶液的初始质量浓度为10 mg/L、催化剂投加量为0.05 g、PMS用量为1.5 mL。由图3可以看出,当MB溶液中只加入催化剂Ni(OH)2·0.75H2O时,MB的去除率仅为9.46%,这是Ni(OH)2·0.75H2O对MB溶液的物理吸附作用所致;当MB溶液中只加入PMS时,MB降解率仅为19.32%,这可能是可见光对PMS有一定的活化作用所引起的MB降解;当MB溶液中同时添加催化剂和PMS时,经过40 min反应,MB溶液的降解率达到了84.33%,这说明Ni(OH)2对PMS具有良好的催化作用。
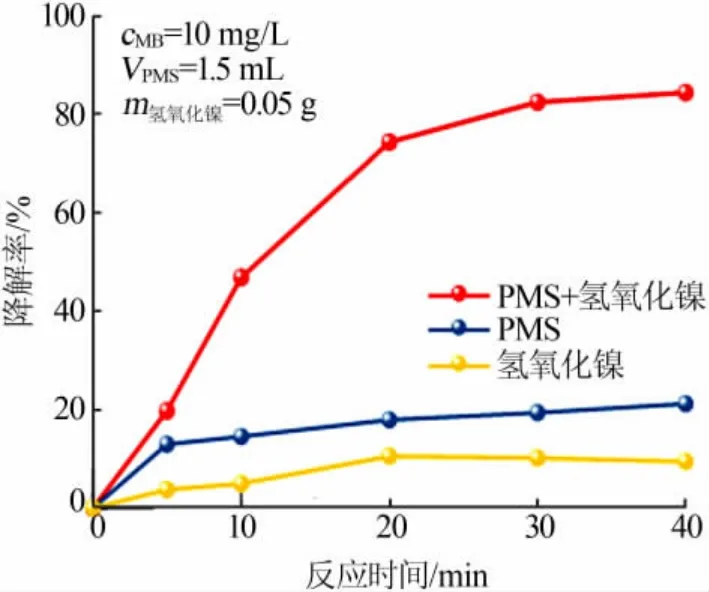
图3 不同体系下MB溶液的降解效果Fig.3 Degradation efficiency of MB solution under different conditions
2.2.2 催化剂用量、PMS浓度和溶液初始浓度对MB降解的影响
采用单因素法考察了催化剂用量、PMS浓度以及MB初始浓度对MB溶液降解效果的影响,相关结果见图4。图4a显示,当催化剂用量从0.03 g增加至0.05 g时,MB溶液的降解率随之增加,尤其是在反应的前20 min增加较多,从59.57%提高至74.26%;而当催化剂投加量继续增至0.07 g时,MB溶液的降解率维持在84%左右不变,这说明该反应体系中催化剂的投加量为0.05 g时已达到饱和。在图4b中,当PMS的用量为1、1.5、2 mL时,对应的MB溶液的降解率分别为63.15%、84.33%和90.56%。亦即在本实验范围内PMS用量的增加有利于提高MB溶液的降解率,但有研究表明,由于·SO4-的自猝反应以及·SO4-与HSO5-之间反应的存在,过高的PMS浓度反而会导致降解效果的下降[17],因此本研究后续实验中PMS的用量均设定为1.5 mL。图4c显示,MB溶液的降解率随起始MB浓度的升高而呈现出下降趋势。起始MB溶液的质量浓度为7.5、10、12.5 mg/L时,对应的MB溶液的降解率分别为90.31%、84.33%、77.63%。这是由于MB浓度升高导致PMS浓度与MB浓度之比减小所引起的。

图4 催化剂用量(a)、PMS浓度(b)以及MB初始浓度(c)对MB溶液降解效果的影响Fig.4 Effect of catalyst dose(a),PMS concentration(b)and original MB concentration(c)on the degradation efficiency of MB solution
2.2.3 阴离子对MB降解的影响
考虑到实际印染废水成分的复杂性,本研究还考察了不同价态阴离子的存在对MB溶液降解的影响,相关结果见图5。所用的MB溶液质量浓度为10 mg/L、催化剂添加量为0.05 g、PMS用量为1.5 mL、所加阴离子浓度均为20 mmol/L。
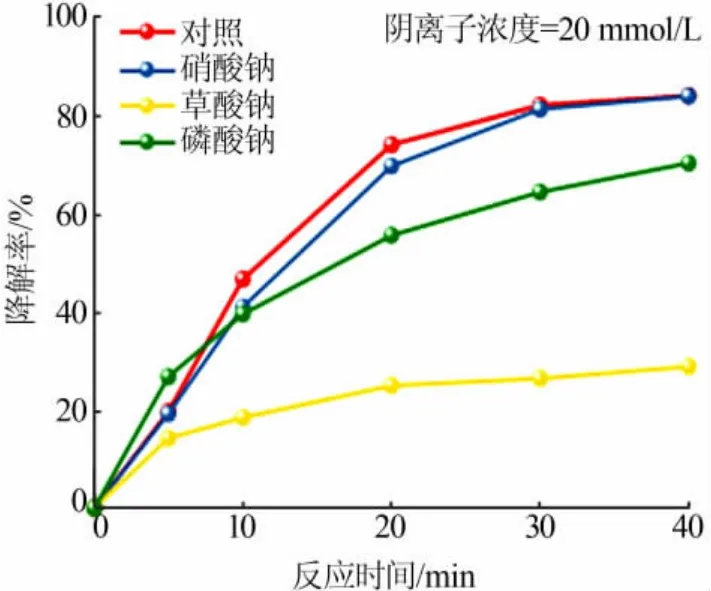
图5 不同阴离子对MB溶液降解率的影响Fig.5 Effect of various anions on the degradation ratios of MB solutions
由图5可见,当向MB溶液中加入Na2C2O4和Na3PO4后,MB的降解受到了不同程度的抑制,其降解率从84.33%分别降为28.87%和70.47%,相较于正常条件下抑制率分别为65.77%和16.44%;而加入NaNO3后,MB的降解率为84.10%,与正常条件下无明显差异。其中Na+对PMS的催化氧化反应没有影响,MB溶液的降解效果受到抑制由相应阴离子导致。上述实验结果表明,二价C2O42-对催化降解率的抑制作用最大,其次为三价PO43-,而一价NO3-对该催化氧化体系未见明显影响。究其原因,一方面,因Ni(OH)2的等电点为10.6[18],故在本研究所采用的近中性溶液体系下其表面荷正电,较之NO3-,荷负电更多的C2O42-和PO43-更易通过静电吸引作用占据Ni(OH)2表面的催化活性位点,从而导致其催化活化PMS效率的降低;另一方面,C2O42-作为一种还原性物质,在氧化还原体系中,其与MB分子存在竞争关系,C2O42-的存在造成活性中间体的消耗,继而使得MB溶液的降解率大为降低。
2.2.4 催化剂的重复使用性能
将使用过的Ni(OH)2催化剂经重力沉降、过滤、洗涤和干燥(60℃,3 h)等步骤加以收集,以测试其催化PMS降解MB溶液的重复使用性能。图6对比了初次使用和循环使用两次后MB溶液的催化降解效果。重复使用一次后,MB溶液的降解率从84.33%降为69.75%,重复使用两次后则下降至61.79%,分别相当于原始催化剂催化效能的82.71%和73.27%。其催化效果有明显下降,其原因可能是:1)亚甲基蓝分子及其降解产物在催化剂表面有吸附残留,造成了部分活性点位的损失。即通过简单的水洗过程无法实现催化剂的完全再生;2)催化材料在重复使用过程中的团聚加剧,引起催化剂比表面积的减小等。

图6 催化剂的重复使用性能Fig.6 Resability of the catalyst
2.3 催化机理与反应动力学分析
2.3.1 自由基鉴定结果与催化机理
相关研究表明,PMS催化氧化体系中的活性物质通常以·SO4-为主[19]。为进一步了解Ni(OH)2催化下PMS降解MB的反应机理,分别向反应体系中加入叔丁醇(TBA)和乙醇(EtOH)以明确反应时产生的活性自由基物种。其中叔丁醇作为·OH的俘获剂,乙醇作为·OH和·SO4-的共同俘获剂,两者对MB溶液的降解率的影响见图7。
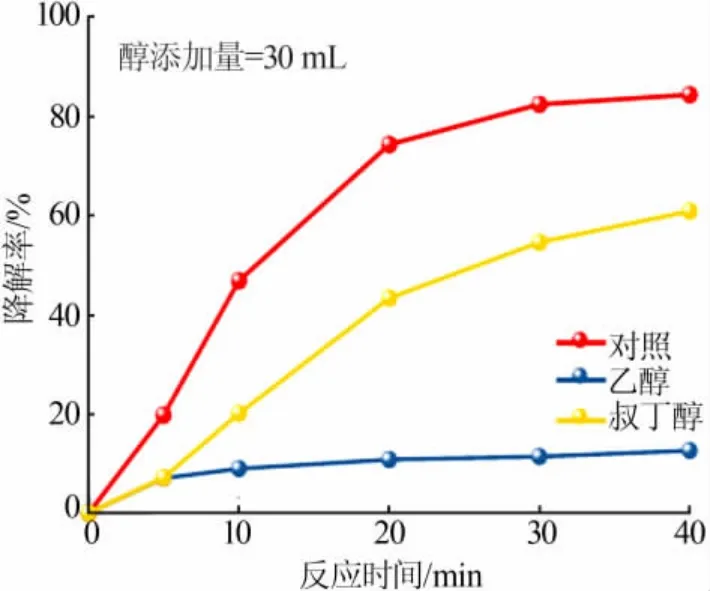
图7 自由基俘获剂对MB溶液降解率的影响Fig.7 Effect of radical scavenger on catalytic degradation ratio of MB solution
由图7可知,加入叔丁醇后,MB溶液的降解率从84.33%下降至60.78%,而加入乙醇后,MB溶液的降解率急剧降至12.62%,降解效能分别相当于正常催化下的72.07%和14.97%。由此证实MB的氧化降解遵循自由基机理,且·SO4-为其降解过程中参与的主要活性物质。基于自由基物种鉴定结果,推测Ni(OH)2/PMS反应体系中MB溶液的可能降解机理如下:
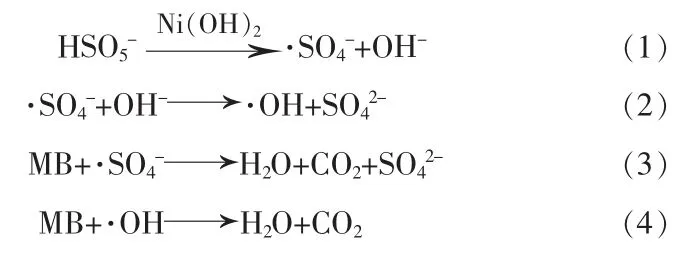
2.3.2 反应动力学
将40 min内MB溶液的浓度c的变化对反应时间t积分处理,可得到MB降解的n级反应动力学方程,如下式所示:
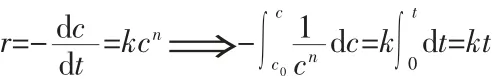
当n=0、1、2时,积分结果依次如下:

将MB溶液降解过程中其浓度随反应时间的变化分别按照上述3式进行线性拟合,结果如图8所示。当n=0、1、2时,对应的R2分别为0.854 8、0.945 1、0.978 8,说明Ni(OH)2催化PMS降解MB溶液的反应更符合二级反应动力学。
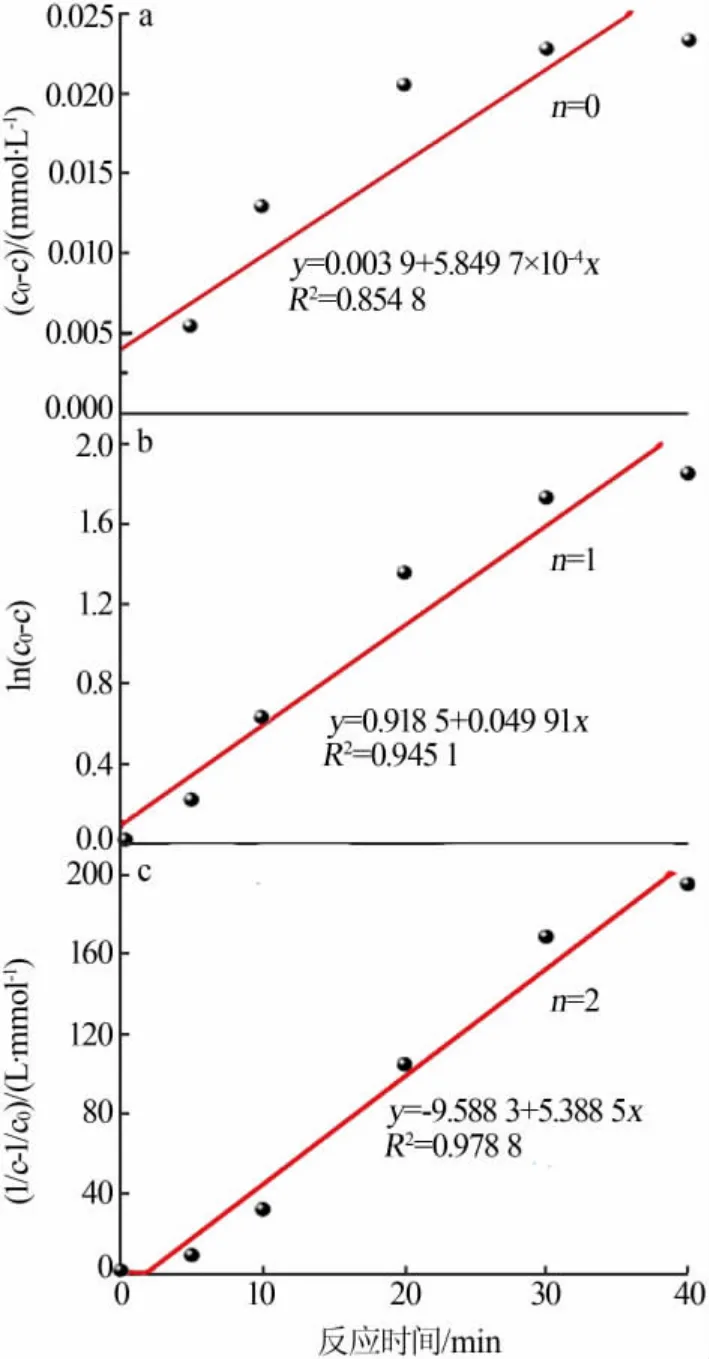
图8 MB溶液的降解反应动力学线性拟合曲线Fig.8 Linear fitting curves of degradation reaction kinetics of MB solution
按二级反应计算出MB降解速率常数为5.39 L/(mmol·min)。此外,加入不同自由基俘获剂后MB溶液的降解反应速率常数依次为:k叔丁醇=1.35 L/(mmol·min)、k乙醇=0.10 L/(mmol·min),结果如图9所示。
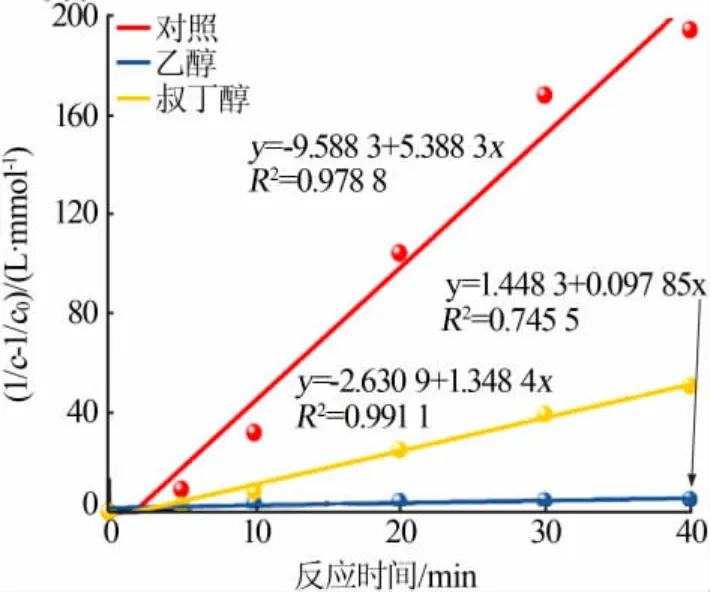
图9 不同体系中MB溶液降解的二级反应动力学拟合曲线Fig.9 Second-order reaction kinetic fitting curves for MB solution degradation under various reaction systems
3 结论
1)采用简单的化学浴沉积法合成了由厚度约为35 nm的纳米片自组装而成具有微米级尺寸的水合氢氧化镍[Ni(OH)2·0.75H2O]粉体。其作为催化剂,显示出良好的催化活化PMS降解MB溶液的性能。经历相同的反应时间,Ni(OH)2/PMS复合体系对MB溶液的降解率可达84.33%,远高于单一PMS或Ni(OH)2体系下MB的去除率(分别为19.32%和9.46%)。2)考察了PMS用量、催化剂投加量及初始溶液浓度对MB降解的影响。确定了降解250 mL质量浓度为10 mg/L的MB溶液的最佳实验参数:PMS(0.1 mol/L)用量为1.5 mL,催化剂投加量为0.05 g。3)研究了阴离子的引入对Ni(OH)2/PMS体系中MB溶液降解效率的影响。二价C2O42-对MB降解的抑制作用最显著,其次为三价PO43-,而一价NO3-基本无影响。4)在Ni(OH)2/PMS体系中,主要活性物质为·SO4-,其对MB溶液的降解遵循自由基反应机理。MB溶液的降解为二级反应,动力学反应速率常数为5.39 L/(mmol·min)。

