广州管圆线虫感染对不同宿主免疫系统的影响
刘 珍,刘嘉华,马芷璇,周宗朴,吴忠道,冯 英
(1.广州市第一人民医院//华南理工大学附属第二医院输血科,广东广州510180;2.华南理工大学医学院,广东广州510006;3.中山大学中山医学院寄生虫教研室,广东广州510080)
广州管圆线虫是引起嗜酸性粒细胞增多性脑膜炎和脑膜脑炎的重要病原体。大鼠是广州管圆线虫的适宜宿主,人和小鼠是其非适宜宿主[1-2]。目前,广州管圆线虫病已成为严重的公共卫生问题,是我国重大食源性传染病之一[3-5]。宿主的免疫系统在维持机体抗感染的免疫平衡和免疫调节中发挥重要作用,免疫系统和神经系统双向相互作用[6-7],中枢神经系统受损对免疫功能产生重大影响[8-9]。我们前期研究[10]显示广州管圆线虫感染对小鼠免疫系统产生明显抑制作用,可能是寄生虫产生免疫逃逸的重要机制。广州管圆线虫感染对大鼠免疫系统影响并无系统研究,大小鼠脑部炎症反应存在差异,而这种差异可能与免疫调节有关。本研究通过分析广州管圆线虫感染对大鼠和小鼠免疫系统的影响,探索机体免疫系统在广州管圆线虫感染所致脑炎发病机制中的重要作用,为广州管圆线虫病的临床防治提供新思路。
1 材料与方法
1.1 主要试剂和抗体
无水乙醇(广州瑞舒生物科技)、水合氯醛(鼎国生物科技有限公司)、生理盐水(广州威佳生物科技)、牛血清白蛋白(Bovine serum albumin,BSA)(广州威佳生物科技)、PBS粉末(广州威佳生物科技)、RPMI-1640培养基(广州威佳生物科技)、Per⁃coll分离液(广州威佳生物科技)、红细胞裂解液(碧云天)、流式抗PE-conjugated CD3(eBioscience)、流式 抗 体PE-Cyanine5-conjugated CD4(eBiosci⁃ence)、流 式 抗 体FITC-conjugated CD8 antibody(eBioscience)。
1.2 实验动物
本实验中所涉及的SPF级SD大鼠(雄性,6~8周龄,200 g左右)和SPF级BALB/c小鼠(雄性,6~8周龄,25 g左右),均购于广东省实验动物中心,动物生产许可证号为:SCXK(粤)2018-0002。我们将动物置于湿度(60±10)%和温度(25±2)℃,模拟正常昼夜生物节律的SPF环境中饲养,本研究中动物的饲养、管理、实验流程以及实验后处理符合国家科技部《实验动物护理和使用指南》,并遵守华南理工大学实验中心动物伦理要求及相关实验动物福利及使用准则。
1.3 广州管圆线虫感染期幼虫的收集及感染动物模型的建立
1.3.1 虫体分离和收集 取感染广州管圆线虫的藁杆双脐螺,参照以前的实验操作[11],通过机械压碎,消化螺肉,中和后,收集广州管圆线虫感染期幼虫(L3)置于无菌生理盐水中备用。阳性螺由中山大学寄生虫教研室提供。
1.3.2 构建动物模型 SD大鼠和BALB/c小鼠经一周适应性喂养后,分别被随机分成两组:对照组和感染组。大鼠和小鼠禁食3 h,使用人工灌胃方法,每只大鼠和小鼠分别经口感染100条和30条广州管圆线虫L3幼虫。每组实验动物数量5~8只,实验重复3次。感染21 d后开展实验。
1.4 采集宿主胸腺和脾脏指数
广州管圆线虫感染21 d后,各组大鼠和小鼠分别称量体质量后,采用腹腔注射100 g/L水合氯醛(0.3 mL/kg)剂量麻醉。小鼠和大鼠分别采用眼球取血方法和断尾取血方法收集外周血,取血后的实验动物通过颈椎脱臼方法处死。将处死后的大鼠和小鼠仰卧位,打开胸腔,完整暴露胸腺,游离周边组织完整取出胸腺;打开腹腔,充分暴露脾脏,完整取出脾脏。胸腺和脾脏用PBS缓冲液冲洗后,用滤纸除去表面多余水分,拍照,称重。计算各组大鼠和小鼠胸腺指数和脾脏指数[胸腺指数=胸腺质量(mg)/宿主体质量(g);脾脏指数=脾脏质量(mg)/宿主质量(g)]。
1.5 流式细胞术检测脾脏和胸腺T细胞亚型
1.5.1 胸腺单个核细胞制备 将胸腺放入含有不完全RPMI-1640培养基的平皿内剪碎;充分研磨,200目筛网过滤;台盼蓝计数活细胞数量;用PBS缓冲液洗涤2次,重悬待用。
1.5.2 脾脏单个核细胞制备 将脾脏放入含有不完全RPMI-1640培养基的平皿内剪碎;充分研磨,200目筛网过滤;离心取沉淀,加入同体积工作浓度的红细胞裂解液,轻轻吹打混匀,4℃裂解5 min;离心(4℃,500×g,5 min)后弃红色上清;用PBS缓冲液洗涤3次后重悬,台盼蓝计数活细胞数量,待用。
1.5.3 表面抗原染色及流式细胞术检测 每组取100µL体系的PBS缓冲液重悬的1×106~1×107个胸腺/脾脏单个核细胞于流式管中,根据说明书每管分别加入1µL CD3、CD4和CD8流式抗体抗体;4℃避光染色孵育30 min;PBS缓冲液洗涤3次后重悬至400µL体系;流式细胞仪上机检测。
1.6 脑组织单个核细胞提取及流式细胞术检测
1.6.1 Percoll分离液的配制 将Percoll原液与10×PBS(0.1 mol/L)按9:1配制100%Percoll分离液;用100%Percoll分离液与RPMI 1640培养基按照7:3稀释,配制70%Percoll分离液;用100%Per⁃coll分离液与RPMI 1640培养基按照3:7稀释,配制30%Percoll分离液。
1.6.2 脑组织单个核细胞的提取 剪开处死的大小鼠头部皮肤,暴露颅骨;用眼科剪顺着颅骨中线剥离颅骨,最后用镊子取出全脑;将脑组织置于PBS缓冲液中研磨,用200目滤网过滤;收集悬液至15 mL离心管中,水平离心(4℃,500×g,10 min)后弃上清;向沉淀中加入4 mL 30%Percoll重悬;将4 mL 70%Percoll液加入新的15 mL离心管中,将混悬物轻铺于70%Percoll上;水平离心(4℃,500×g,30 min),吸取70%Percoll和30%Percoll层之间的白色细胞层,即为单个核细胞,收集离心管中用PBS洗涤后计数备用。
1.6.3 流式细胞术检测脑组织单个核细胞 将提取的脑单个核细胞,计数1×106~1×108个细胞,用400µL PBS定容,流式细胞仪上机检测。
1.7 统计方法采用
所有数据采用SPSS 19.0软件进行统计学分析,实验数据统计结果以均数±标准误(Mean±SEM)表示,对照组和感染组比较采用独立样本t检验进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 广州管圆线虫感染对大鼠免疫系统的影响
胸腺大体观察结果显示,正常大鼠胸腺外观呈乳白色,广州管圆线虫感染21 d后,大鼠胸腺大小及外观无明显变化(图1A)。脾脏大体观察结果显示,正常组和感染组大鼠脾脏大小无明显差异,但感染组脾脏较正常组颜色暗红(图1B)。正常组和感染组大鼠胸腺指数和脾脏指数变化均无统计学意义(P>0.05;图1C)。流式细胞术测量各组大鼠胸腺和脾脏单个核细胞总数的结果也显示,感染组和正常组之间的差异均无统计学意义(P>0.05;图1D)。
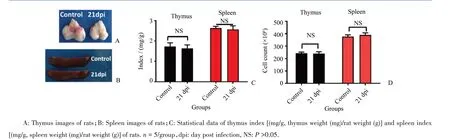
图1 广州管圆线虫感染对大鼠胸腺和脾脏形态影响Fig.1 Effects of A.C.infection on the morphology of thymus and spleen in rats
采用流式细胞学方法,检测广州管圆线虫感染对大鼠胸腺细胞各亚群的影响(图2A),结果显示:感染广州管圆线虫21 d后,感染组大鼠胸腺中各细胞亚群CD4+T、CD8+T、CD4+CD8+T双阳细胞(dou⁃ble positive,DP)和CD4-CD8-T双阴细胞(double negative,DN)的比例和数量与对照组差异无统计学意义(P>0.05;图2B)。采用流式细胞学技术,检测广州管圆线虫感染对大鼠脾脏CD4+T和CD8+T细胞的影响(图2C),结果显示感染后大鼠脾脏细胞亚群变化明显:具体表现在脾脏CD4+T细胞比例和数量(t=3.052,P=0.016;t=2.795,P=0.023)均增加,而CD8+T细胞比例和数量变化均无统计学意义(P>0.05;图2D)。
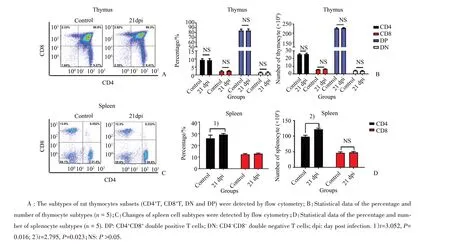
图2 广州管圆线虫感染对大鼠胸腺和脾脏细胞亚型的影响Fig.2 Effects of A.C.infection on cell subtypes of thymus and spleen in rats
2.2 广州管圆线虫感染对小鼠免疫系统的影响
我们进一步观察广州管圆线虫感染对非适宜宿主小鼠免疫系统的影响。正常小鼠胸腺外观呈乳白色,广州管圆线虫感染21 d后,小鼠胸腺体积明显缩小,色泽暗黄(图3A)。正常小鼠脾脏外观饱满,颜色红润,感染后小鼠脾脏颜色苍白,体积明显缩小(图3B)。同时感染导致小鼠胸腺(t=10.08,P<0.000 1)和脾脏指数(t=7.618,P<0.0001)均明显降低(图3C)。流式细胞术检测各组小鼠胸腺和脾脏单个核细胞计数,结果显示,正常小鼠胸腺细胞总数约(55~58)×106个,感染后细胞总数急剧下降至10×106个左右,各组之间差异具有统计学意义(t=22.04,P<0.000 1);正常小鼠脾脏单个核细胞总数约80×106个,感染后降至约20×106个,各组之间差异具有统计学意义(t=22.34,P<0.000 1;图3D)。
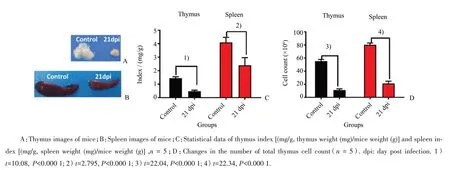
图3 广州管圆线虫感染对小鼠胸腺和脾脏形态影响Fig.3 Effects of A.C.infection on the morphology of thymus and spleen in mice
我们采用流式细胞术检测广州管圆线虫感染对小鼠胸腺细胞亚群的影响,结果显示,正常小鼠胸腺中CD4+CD8+T胸腺细胞比例占80%~85%。感染第21 d后,胸腺CD4+CD8+T胸腺细胞比例急剧降低(t=44.15,P<0.000 1),CD4+CD8+T胸腺细胞总数也明显减少(t=24.09,P<0.000 1)。感染也导致胸腺细胞中CD4-CD8-T、CD4+T和CD8+T细胞比例分别相应增加(t=8.60,P<0.000 1;t=19.99,P<0.000 1;t=16.26,P<0.000 1),但CD4-CD8-T和CD4+T细胞总数减少(t=4.180,P=0.003 1;t=4.584,P=0.001 8),CD8+T细胞总数变化差异无统计学意义(P>0.05;图4A、B)。同时,感染对外周免疫器官小鼠脾脏产生严重影响,具体表现在感染后小鼠脾脏单个核细胞中CD4+T和CD8+T细胞比例分别增加(t=7.55,P<0.000 1;t=4.792,P=0.001 4),其中CD4+T增加更明显;但CD4+T和CD8+T细胞总数均下降(t=7.449,P<0.000 1;t=4.032,P=0.003 8;图4C、D)。
2.3 广州管圆线虫感染对大鼠和小鼠脑单个核细胞的影响
为了观察感染后大鼠和小鼠脑部炎症细胞的浸润,我们通过流式细胞术对各组大鼠和小鼠脑组织单个核细胞总数进行检测,结果显示,感染后大鼠脑组织单个核细胞各群变化不明显,总数变化无统计学意义(P>0.05);正常组小鼠脑中单个核细胞数量很少,当感染21 d后,小鼠脑部单个核细胞数量明显增加,各组间差异具有统计学意义(t=21.55,P<0.000 1;图5)。
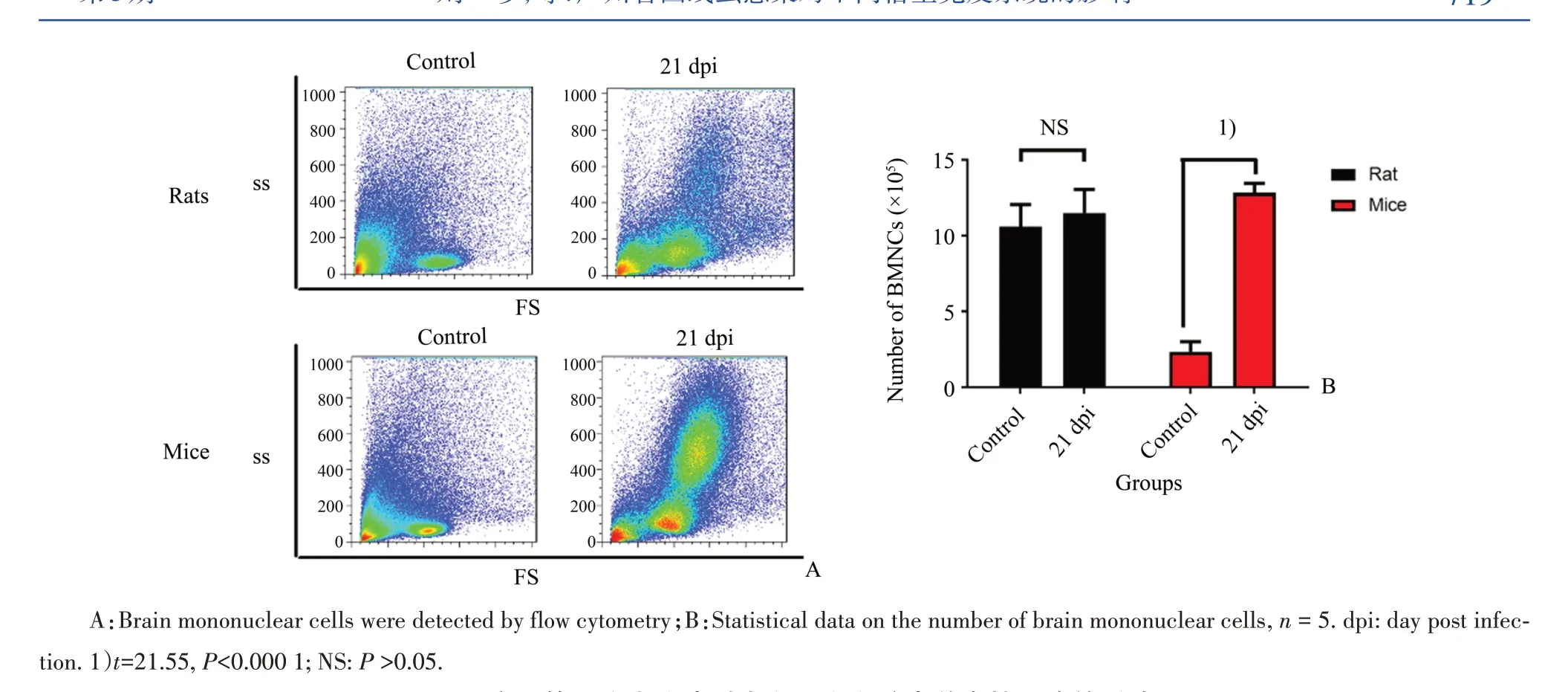
图5 广州管圆线虫感染对大鼠和小鼠脑内单个核细胞的影响Fig.5 Effects of A.C.infection on brain mononuclear cells in rats and mice
3 讨论
适宜宿主大鼠感染广州管圆线虫后,脑组织发生明显的以嗜酸性粒细胞浸润为特点的炎症反应,但感染21 d后,其炎症反应明显减弱;而非适宜宿主小鼠感染广州管圆线虫后,脑部炎症持续升高,感染21 d后大多数小鼠出现死亡[10-11]。我们实验结果证实,广州管圆线虫感染21 d后,大鼠脑部单个核细胞数量变化不明显,而小鼠脑部单个核细胞数量明显增加,提示其脑部炎症反应存在差异。同时,感染对非适宜宿主小鼠的免疫系统产生严重的免疫抑制,具体表现在感染后小鼠胸腺和脾脏明显萎缩,胸腺细胞中CD4+CD8+T细胞比例严重减少,进一步影响T细胞的分化发育。胸腺是机体重要的中枢免疫器官,是T细胞发育、分化、成熟的场所[12]。T细胞的发育起源于骨髓的前体T细胞,首先从胸腺皮髓质交界处进入胸腺,在胸腺皮质内,胸腺细胞由双阴阶段发育到双阳阶段、单阳阶段,然后在胸腺髓质内完成进一步的阳性选择和阴性选择,从而进一步发育为成熟的T细胞并输出给外周免疫器官[13]。脾脏作为最大的外周免疫器官,是最主要的免疫应答和病原体清除场所,也是淋巴细胞等免疫细胞定居区域[14]。因此,脾脏淋巴细胞亚型和功能改变能有效反映机体对广州管圆线虫感染后产生的免疫应答特点[15]。免疫功能受损可能是小鼠感染广州管圆线虫后,脑组织炎症反应得不到调控或减轻的主要原因(非可近期性炎症反应)。而感染对大鼠免疫系统产生影响较小,不同宿主的反应差异可能与免疫调节有关。
中枢神经系统的损伤对免疫功能有重要影响[6,16]。在一定的生理和病理条件下,神经系统损伤严重会导致机体免疫状态失衡,诱导免疫系统受到损害[17]。在广州管圆线虫感染后期,机体免疫应答在宿主抗感染中发挥重要作用[11,18]。宿主的免疫反应主要以Th2型反应为主,Th2型细胞因子在免疫反应中发挥重要作用[19],这与CD4+T细胞比例的增加密切相关。结果证实广州管圆线虫感染后,大鼠和小鼠外周免疫器官脾脏中CD4+T细胞比例均增加,小鼠的变化更加明显,炎症反应更剧烈。广州管圆线虫感染后,大鼠作为适宜宿主,对这种炎症反应可做出适当的免疫调节,脑部炎症反应减轻;而小鼠是非适宜宿主,可能缺少这种调节功能,脑部炎症反应持续加强,发生非可控性急性炎症反应,从而导致感染后期,小鼠多出现死亡。广州管圆线虫感染对非适宜宿主小鼠的免疫系统产生严重免疫抑制,而大鼠的免疫系统受影响较小。这种神经系统的损伤诱导外周免疫系统产生的免疫抑制,进而引起宿主清除和抵抗寄生虫能力降低,这可能是寄生虫产生免疫逃逸的重要机制,但具体的机制还需要进一步深入研究。
综上所述,广州管圆线虫感染对适宜宿主大鼠脑部炎症以及免疫系统影响较小,而感染引起非适宜宿主小鼠的脑部炎症反应明显,免疫系统受到严重的免疫抑制。这种变化证实机体免疫系统在广州管圆线虫感染所致脑炎的发病机制中发挥重要调控作用。一方面,免疫系统的受损导致机体抵抗病原体能力降低,参与免疫应答的反应减弱,进一步导致脑炎加重;另一方面,严重的脑部炎症导致机体免疫状态失衡,诱导机体免疫系统受到损害。机体神经-免疫系统失衡,形成恶性循环。本研究提示在广州管圆线虫病临床治疗时,有必要使用提高或恢复免疫力的药物或相关治疗手段,进一步增强机体抗寄生虫能力和机体自我修复能力。本研究揭示了机体免疫系统在广州管圆线虫感染所致脑炎发病机制中的重要作用,为广州管圆线虫病的临床治疗提供了新思路。

