T-006改善APP/PS1/Tau转基因小鼠学习记忆功能及调控突触相关蛋白表达
程洁鸿,张桂梁,郭宝剑,孙业伟,张高小,王玉强,张在军
(1.广州中医药大学第一附属医院,广东广州510405;2.暨南大学药学院新药研究所,广东广州510632)
阿尔茨海默病是一类在老年人群中病率非常高的神经退行性疾病,主要的临床病理特征是在大脑中出现淀粉样斑块沉积和神经纤维缠结,临床表现为认知能力出现障碍并伴随记忆能力衰退[1]。截止到2020年,全球大约有5 000万名AD患者,到2050年,AD患者的人数将达到1.5亿左右,不断加重社会与家庭的经济负担;临床上目前应用于治疗AD的药物主要包括NMDA受体拮抗剂(美金刚)和乙酰胆碱酯酶抑制剂(多奈哌齐、加兰他敏)两类药物,但是这两类药物只能延缓疾病的症状,并不能逆转疾病的进程[2]。因此,寻找有效治疗AD的药物迫在眉睫。J147是姜黄素的衍生物(图1),是美国Salk研究所研发的一个多功能神经保护药物[3],在AD动物模型中展现出非常好的疗效,通过调控线粒体,降低Aβ淀粉样斑块沉积,减轻小鼠的认知障碍,并延缓衰老[4-5],目前正在人体中进行临床Ⅰ期的试验;TMP是从中药川芎中提取出来的活性成分,易通过血脑屏障系统,现广泛应用于心脑血管疾病的治疗。基于前期对化合物J147和四甲基吡嗪(TMP)的研究,我们设想利用TMP穿过血脑屏障的特点,将J147结构中的苯氧甲基替换成TMP,合成了目标化合物T-006(图1)[6],希望能够进一步提高脑组织与血浆中的药物比,又能保持J147的生物活性,进而在治疗神经退行性疾病发挥作用。前期研究发现,T-006具有较好的神经保护作用,在PD模型中能够改善模型小鼠的行为学表现,提高阳性酪氨酸羟化酶的数量,促进α-syn蛋白清除[7],但是在AD模型中的疗效及作用机制有待于进一步的探究。APP/PS1/Tau转基因小鼠大脑内既有淀粉样蛋白沉积,同时也会在神经元内出现神经纤维缠结,该模型最大程度的模拟AD病人的动态病理变化,是目前研究AD疾病最常用的动物研究[8];AD疾病在人群中存在性别差异,女性患病的概率是高于男性的。因此,在本次研究中选用雌性的APP/PS1/Tau转基因小鼠作为研究对象,结合前期J147的作用机制,本研究以主要围绕淀粉样蛋白、突触蛋白以及BDNF/CREB信号通路等方面开展探究,为AD疾病的防治提供有效的实验依据。
图1 姜黄素、J147、TMP和T-006结构式Fig.1 The structures of Curcumin,J147,TMPand T-006
1 材料与方法
1.1 实验用动物及分组
8月龄的APP/PS1/Tau(3×Tg)转基因小鼠(雌性,22~25 g),饲养于深圳市疾病预防控制中心毒理科实验动物中心SPF级环境动物房(实验动物使用许可证号:SYXK(粤)2015-0068),室内温度维持在(22±2)oC,湿度在50%~80%,12 h/12 h循环光照,小鼠可以自由进食和饮水。实验动物使用过程中严格遵循3R原则,本实验的所有流程均符合深圳市疾病预防控制中心实验动物伦理委员会的要求。
WT和3×Tg转基因小鼠共分为8组,分组如下:WT组、WT+T-006(10 mg/kg)组、3×Tg组、T-006低、中、高剂量组(1,3和10 mg/kg)、多奈哌齐组(1.3 mg/kg)、美金刚(5 mg/kg)。
T-006溶解于橄榄油中,多奈哌齐和美金刚溶解于0.9%的生理盐水中;T-006和多奈哌齐1 d给药1次,美金刚1 d给药2次。模型组小鼠给予等体积的橄榄油,WT组小鼠给予等体积的生理盐水。
1.2 实验用主要仪器与试剂
电子天平(梅特勒斯,德国);旷场实验装置、Morris水迷宫实验装置、黑白箱实验装置、ZHMGY型新物体识别系统(安徽正华生物仪器设备有限公司);超纯水系统(Merck Millipore Corpora⁃tion);倒置荧光显微镜(Olympus Corporation);图像自动采集软件、软件分析系统(上海欣软信息科技公司)。
T-006由实验室合成(批号:MC10790-123-T-006A),多奈哌齐和美金刚购买于京东大药房;载玻片购买于江苏世泰公司;50×柠檬酸抗原修复液、RIPA裂解液、一抗稀释液等购买于上海碧云天生物科技有限公司;鼠兔通用型免疫组化显色试剂盒购自于基因科技有限公司;PSD95、BDNF、synapto⁃physin、p-CREB、CREB、β-actin等一抗购自于CST公司;synapseⅠ、synapseⅡ、APP、BACE-1等一抗购自于Abcam公司;免疫印迹二抗均购自于CST公司;ECL发光液购自于杭州弗德生物科技有限公司。
1.3 水迷宫实验
水迷宫实验参考文献[9],步骤简要如下:本实验分为定位航行训练和空间探索两部分。训练期(隐藏平台于水下),小鼠随机的从N、E、SE、NW四个方位面壁放入水池中,在60 s以内记录小鼠找到平台的时间,超过60 s尚未找到平台的小鼠,则人工引导小鼠找到平台,并在平台待10~15 s。每只小鼠按四个方位起始点一共测试4次,分别记录其找到平台的时间,没有找到平台则记为60 s,连续训练5 d后,将隐藏在水中的平台撤掉,从平台对角线方位(NE)将小鼠放入水池中,记录2 min内小鼠第1次找到平台的时间以及穿越平台次数等指标。
1.4 电跳台实验
电跳台实验参考文献[10],步骤简要如下:在跳台装置中心设置一个可以通电的铁网,将小鼠放在铁网适应5 min,期间给铁网通电(恒压为35 V),小鼠受到电击时会本能的跳上平台,经过多次训练后,记忆能力好的小鼠会停留在平台上。在测试期,将小鼠放在平台上,记录小鼠第一次找到碰触铁网时间以及小鼠跳下平台的次数(犯错次数)。
1.5 新物体识别实验
新物体识别实验步骤简要如下[11]:在旷场两个角落各放置一个相同的长方体,将小鼠面壁放入装置中,自由探索5 min。连续训练3 d后,将其中的一个长方体换成圆柱体,使用摄像头记录小鼠5 min的运动轨迹。小鼠探索旧物体和新物体的时间分别记为T1和T2,作为评价小鼠记忆能力的指标。小鼠对新旧物体的辨别能力用DI表示,具体计算算式为:DI=(T2-T1)/(T1+T2)。
1.6 免疫组化
小鼠腹腔注射10 g/L水合氯醛麻醉,打开小鼠胸腔,暴露心脏,依次灌注生理盐水和40 g/L多聚甲醛溶液,待小鼠尾巴僵硬,结束灌流。小鼠头部剪下,取出脑组织浸泡于40 g/L多聚甲醛中。
采用石蜡包埋脑组织并切片(厚度为5µm),石蜡切片置于60℃烘箱中,烘片1 h,脱蜡至水,柠檬酸缓冲液抗原修复,3%H2O2封闭内源性过氧化物酶,通透,10%FBS封闭非特异性结合位点,一抗孵育过夜,PBS洗片,二抗室温孵育,PBS洗片,DAB显色,苏木素核染,脱水透明,封片,使用倒置显微镜观察染色结果。
1.7 Western blotting
提取海马组织蛋白,BCA蛋白定量,变性。按照15µg上样量进行电泳实验,经10%SDS-PAGE胶,恒压条件下分离蛋白,随后转移至PVDF膜,常温使用5%的脱脂牛奶封闭90 min。4℃冰箱过夜孵育PSD95(1:2 000)、BDNF(1:1 000)、synapto⁃physin(1:2 000)、synapseⅠ(1:2 000)、synapseⅡ(1:2 000)、p-CREB(1:1 000)、CREB(1:1 000)、APP(1:2 000)、BACE-1(1:2 000)、β-actin(1:2 000)等抗体。TBST洗膜(10 min×3次),二抗(An⁃ti-Rabbit,Anti-Mouse)室温孵育90 min。TBST洗膜(5 min×3次)。利用ECL发光液,凝胶成像仪观察目的蛋白表达情况,Image J进行图像灰度值分析。
1.8 统计分析
采用Graphpad 8.0进行数据分析处理,均以均值±标准差(Mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),方差分析差异有统计学意义时采用LSD(Least Significant Differ⁃ence)法进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 T-006提高APP/PS1/Tau转基因小鼠的行为学表现
如图2所示,经单因素方差分析,8组间辨别指数DI差异无统计学意义(F=1.849,P=0.088)。
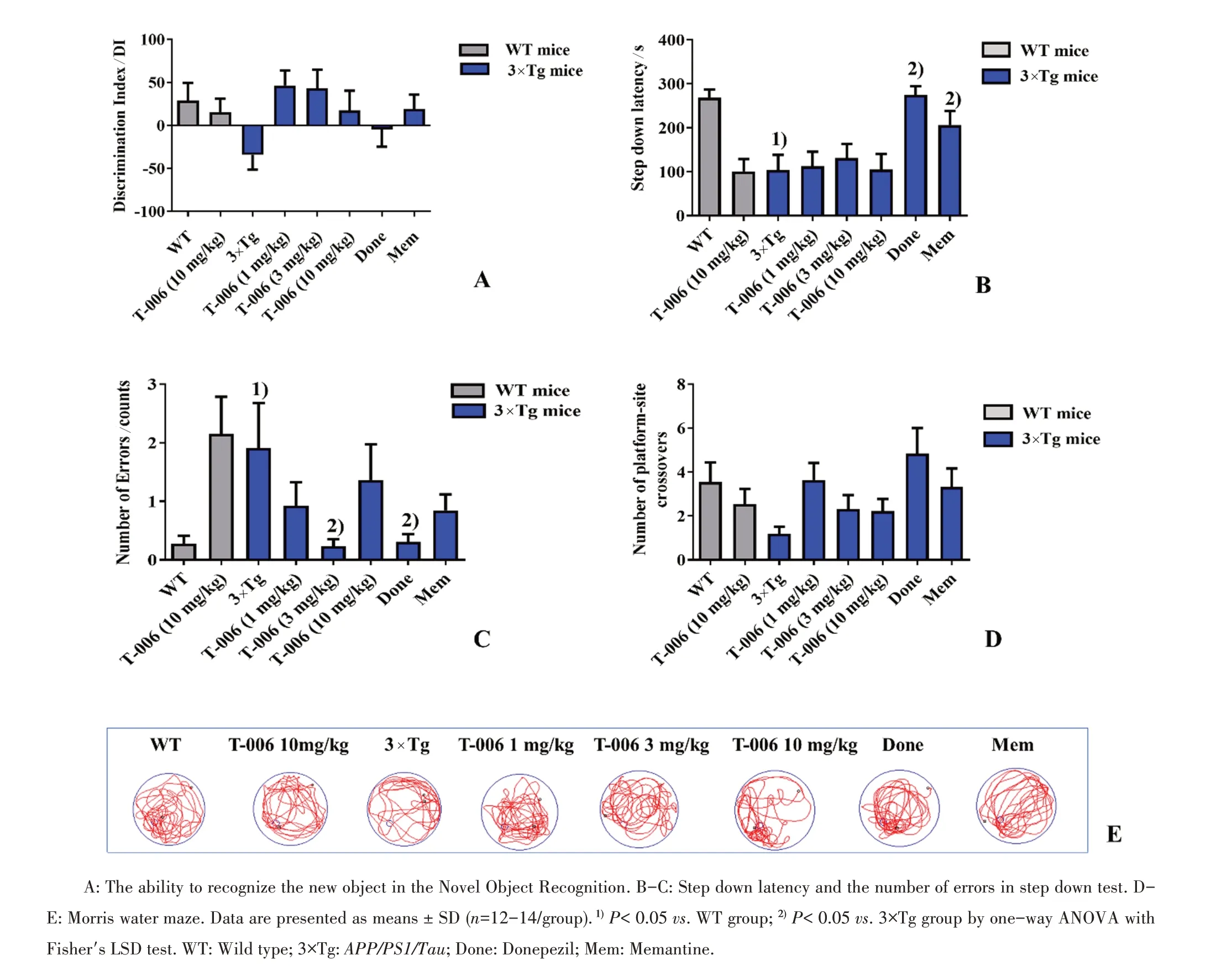
图2 T-006对APP/PS1/Tau转基因小鼠行为学的影响Fig.2 The effect of T-006 on the behavior test of APP/PS1/Tau transgenic mice
经单因素方差分析,八组间潜伏期(step down latency)差异有统计学意义(F=6.082,P=0.000);采用LSD法进行两两比较,与WT相比,模型组小鼠会显著性地降低小鼠在电跳台实验中的潜伏期(103.70±34.66vs.268.70±18.28,P=0.000);与模型相比,T-006可以增加小鼠在电跳台实验中的潜伏期,但差异无统计学意义(P>0.05),多奈哌齐和美金刚显著性地提高小鼠在电跳台实验中的潜伏期(274.70±20.20vs.103.70±34.66,P=0.000;206.40±31.82vs.103.70±34.66,P=0.018)。
经单因素方差分析,8组间犯错次数(number of errors)差异有统计学意义(F=2.923,P=0.008);采用LSD法进行两两比较,与WT相比,模型组小鼠会增加电跳台实验中犯错的次数(1.909±0.768vs.0.270±0.140,P=0.014);与模型相比,T-006(3 mg/kg)减少小鼠在电跳台中的犯错次数(0.231±0.121vs.1.909±0.768,P=0.009),多奈哌齐也可以减少小鼠犯错的次数(0.308±0.133vs.1.909±0.768,P=0.012),但美金刚不影响小鼠的犯错次数(P>0.05)。
经单因素方差分析,8组间穿越平台次数(number of platform-site crossovers)差异无统计学意义(F=1.989,P=0.066)。
2.2 T-006降低APP/PS1/Tau转基因小鼠APP蛋白的表达
如图3A所示,通过免疫组化染色观察发现,与WT相比,模型组中Aβ淀粉样斑块沉积显著增加;与模型相比,T-006(3 mg/kg)可以减少斑块沉积。
Western blotting结果显示(图3B、C),经单因素方差分析,六组间APP表达量差异有统计学意义(F=5.669,P=0.003);采用LSD法进行两两比较,与WT相比,模型组中APP表达量显著增加(2.108±0.175vs.1.000±0.041,P=0.000);与模型相比较,T-006(10 mg/kg)可以显著性降低APP的表达量(1.315±0.097vs.2.108±0.175,P=0.004)。

图3 T-006对APP/PS1/Tau小鼠海马区APP剪切过程及Aβ淀粉样蛋白斑块的影响Fig.3 The effects of T-006 on the expression of on APPcleavage process and Aβplaques in the hippocampusof APP/PS1/Tau mice
经单因素方差分析,6组间BACE-1表达量差异无统计学意义(F=2.112,P=0.114)。
2.3 T-006增加APP/PS1/Tau转基因小鼠突触相关蛋白的表达
Western blotting结果显示(图4),经单因素方差分析,六组间PSD95表达量差异有统计学意义(F=5.987,P=0.002);采用LSD法进行两两比较,与模型相比较,T-006(1 mg/kg)可以提高PSD95表达量(1.445±0.070vs.0.760±0.062,P=0.000)。

图4 T-006对APP/PS1/Tau小鼠海马区突触相关蛋白的影响Fig.4 The effects of T-006 on synapse-associated proteins in the hippocampus of APP/PS1/Tau mice
经单因素方差分析,6组间synaptophysin表达量差异有统计学意义(F=3.511,P=0.022);采用LSD法进行两两比较,与模型相比较,T-006(1 mg/kg)可以 提 高synaptophysin表 达 量(1.189±0.034vs.0.869±0.053,P=0.005)。
经单因素方差分析,6组间synapsinⅠ表达量差异有统计学意义(F=11.79,P=0.000);采用LSD法进行两两比较,与模型相比较,T-006(1、3、10 mg/kg)可以提高synapsinⅠ表达量(1.736±0.073vs.0.839±0.050,P=0.000;1.718±0.124vs.0.839±0.050,P=0.000;1.314±0.153vs.0.840±0.050,P=0.007)。
经单因素方差分析,6组间synpainⅡ表达量差异有统计学意义(F=5.015,P=0.006);采用LSD法进行两两比较,与模型相比较,T-006对于syn⁃painⅡ的表达无影响(P>0.05)。
2.4 T-006提高APP/PS1/Tau转基因小鼠CREB/BDNF通路蛋白的表达
Western blotting结果显示(图5),经单因素方差分析,6组间p-CREB表达量差异无统计学意义(F=1.267,P=0.335)。

图5 T-006对APP/PS1/Tau小鼠海马区CREB/BDNF通路蛋白的影响Fig.5 The effects of T-006 on BDNF-CREB signaling pathway in the hippocampusof APP/PS1/Tau mice
经单因素方差分析,六组间BDNF表达量差异有统计学意义(F=6.509,P=0.004);采用LSD法进行两两比较,和模型相比较,T-006(1 mg/kg)提高BDNF的表达量(2.032±0.522vs.0.526±0.051,P=0.001)。
3 讨 论
阿尔茨海默病是一类在老年人群中发病率极高的疾病,发病作用机制尚不明确,临床尚没有可以药物治愈AD。研究发现,突触相关蛋白突触在记忆、神经元信号传导等方面扮演重要角色,通过调控突触蛋白可能是治疗AD的有效途径。
参考T-006前期在帕金森疾病模型中的药效学研究[12],本次研究中T-006设低、中、高(1、3、10 mg/kg)3个剂量,同时添加阳性药(美金刚和多奈哌齐)做对照。在行为学研究中,我们可以看到,T-006在改善小鼠学习与记忆能力方面效果较好。在电跳台实验中,T-006与多奈哌齐有大体等同的药效;在新物体实验中,T-006有提高辨别指数DI的趋势。因此,从行为学数据推测,T-006在治疗AD疾病中有较大的潜力。
包括淀粉样蛋白级联假说等被认为是AD发病的重要原因。特别是最早提出的Aβ假说,一直是被认为是AD发病的核心原因。APP又称为淀粉样前体蛋白,是一种跨膜蛋白,由APP生成的产物有两种形式,Aβ1-42是APP在β(BACE-1)、γ切割酶的作用下形成的肽段;Aβ1-42淀粉样蛋白是老年斑块的组成成分,也是AD疾病重要的病理学标志之一,在疾病发展过程中扮演重要角色[13]。研究发现,T-006不仅可以抑制APP蛋白的表达,同时也减少淀粉样斑块沉积,这对于下游信号通路的调节这是非常关键的。在AD患者中值得注意的是,最典型的病理特征是斑块和神经纤维缠结,但突触功能障碍与记忆力和认知能力下降有更强的关联性[14]。在淀粉样斑块和神经原纤维缠结出现之前,AD患者中就发生突触功能障碍,这表明在AD早期产生的可溶性Aβ寡聚体可能会破坏突触功能[15]。研究表明,Aβ聚集形成的寡聚物,有神经毒性,会破坏谷氨酸的摄取水平,过度激活NMDA受体,Ca2+超载,破坏突触的传递功能造成突触障碍,进而影响学习和记忆能力[16]。PSD95是一种重要的支架蛋白,可以调节NMDA受体的突触分布和活性,PSD95表达下降是由Aβ引起的病理级联反应中的重要中间步骤[17]。在AD病人中,已经发现包括PSD95、synaptophysin、SNAP-25等突触相关蛋白表达量下降的现象,特别是海马区突触相关蛋白丢失较为严重[18]。本次研究中,我们发现T-006可以显著性地提高PSD95、synaptophysin、synapsinⅠ蛋白的表达量,而且T-006可以提高3×Tg小鼠的行为学习与记忆能力。因此,我们初步推测小鼠学习与记忆能力的改善与突触蛋白表达量的升高密切相关。
cAMP反应元件结合蛋白(CREB)是关键的转录调节因子,可调节与神经元分化,突触可塑性,学习和记忆有关的基因的转录,如脑源性神经营养因子(BDNF)[19];BDNF是一种CREB依赖性基因,在突触的形成和可塑性方面扮演重要角色。研究发现,AD患者中BDNF的mRNA水平和蛋白表达量显著下降;体外实验中,Aβ通过CREB降低BDNF的水平,可能导致突触丧失和神经变性[20]。BDNF也可以调节APP的代谢进程,减少Aβ产生[21]。AD患者中神经营养因子信号通路的破坏可能与认知能力下降有关[22],CREB介导的转录已被广泛分析,因此,靶向作用于CREB-BDNF可能是治疗AD疾病的关键通路[23]。更为重要的是,即使在AD临床发作后,通过调节CREB的mRNA水平来增加BDNF的表达也可以逆转患者记忆缺陷和认知功能障碍[24]。与文献报道相符合,本次实验中,T-006促进BDNF含量的增加,因此,我们推测,APP以及突触蛋白表达的变化与CREB/BDNF通路的激活有关。
综上所述,本研究证明了T-006在调节APP、突触蛋白表达方面效果显著,可以改善3×Tg小鼠的记忆和认知功能障碍,推测和突触相关蛋白表达的增加密切相关,为进一步研发T-006抗AD提供了实验依据。

