聚乙二醇接枝苯乙烯马来酸共聚物复合微球的制备和检测应用
张贤楠,冷远逵,武卫杰,李万万
(上海交通大学 金属基复合材料国家重点实验室,上海 200240)
随着现代医药学的发展,个人基因图谱、临床诊断和药物研发等应用领域均需要对大量生物分子进行快速定性和定量的分析检测[1].因此,多元检测技术,如固态阵列式芯片[2]和液相悬浮式生物芯片技术发展迅速.其中,以悬浮编码微球为反应载体的液相生物芯片技术因兼具快速高通量、高密度多元分析、高灵敏度和应用范围广泛等优势而备受关注[3-4].在多元检测中存在非特异性吸附(交叉反应性)[5],尤其在蛋白的免疫检测中,捕获探针、检测抗体和非特异性抗原等物质之间的交叉反应会导致背景荧光增强,活性位点可能被非特异性吸附的蛋白占据而降低检测灵敏度,从而限制同时检测的蛋白种类.在基于聚合物微球的液相生物芯片中,由于微球比表面积大,所以非特异性吸附现象更易产生[6].对此,抑制或降低非特异性吸附对于提高液相生物芯片的灵敏度和多元检测能力至关重要.
目前,抑制非特异性吸附的常见方法为在微球表面修饰非特异性吸附抑制剂.抗非特异性吸附常用材料主要为天然蛋白,如牛血清白蛋白(BSA).BSA的空间位阻作用能够有效降低非特异性吸附[7],然而其抑制效果不稳定,且存在生物污染的可能性.因此,人工合成的亲水性聚合物作为非特异性吸附抑制剂得到发展.其中,聚乙二醇(PEG)及其衍生物最具代表性[8-9].PEG同时具有水合作用和空间排斥效应,因此经PEG修饰的基体具有优异的抗非特异性吸附能力.Sarma等[10]用等物质的量的(3-氨基丙基)三乙氧基硅烷和2-[甲氧基(聚氧乙烯)6-9丙基]三甲氧基硅烷对聚苯乙烯/二氧化硅核壳结构微米球进行表面官能化,使微球表面具有氨基和聚乙二醇硅烷(PEGS)链.在针对咖啡因的免疫检测中,其有效抑制了抗体的非特异性结合.然而将PEG化学偶联在微球表面的制备工艺复杂,成本高,不适合大量制备.因此,需要发展简单、低成本和高产率的PEG接枝聚合物微球的制备方法.
在合成具有不同PEG接枝率和链长的聚乙二醇接枝苯乙烯马来酸共聚物(PEG-g-PSMA)的基础上,本文结合SPG膜乳化-乳液溶剂挥发法制备系列铜铟硫/硫化锌(CuInS2/ZnS)量子点复合PEG-g-PSMA荧光微球.该方法的制备工艺简单、可重复性高,且所制备的PEG-g-PSMA复合微球具有优异的单分散性和荧光性能,适用于在干扰物甲胎蛋白(AFP)和癌胚抗原(CEA)存在的条件下,肿瘤标志物糖类抗原CA199的免疫检测.以PSMA复合微球作对照,研究PEG-g-PSMA复合微球在免疫检测中抑制非特异性吸附和提高检测灵敏度的效果与PEG接枝率和链长之间的相关规律.研究结果有助于推动液相芯片技术的广泛应用.
1 实验方法
1.1 PEG-g-PSMA合成
PEG-g-PSMA的合成分两步进行.第一步为苯乙烯马来酸酐共聚物(PSMAH,Sigma-Aldrich,美国)的水解.将4 g PSMAH加入50 mL四氢呋喃中,磁力搅拌至完全溶解;逐滴加入0.5 mL、质量分数为36.5%的浓盐酸,于55 ℃加热回流12 h,加入去离子水使聚合物沉淀;将沉淀物用大量的去离子水洗涤3次并冻干,即可得到苯乙烯马来酸共聚物(PSMA).第二步为甲氧基聚乙二醇(mPEG,阿拉丁,中国)和PSMA的酯化接枝反应.将0.5 g PSMA、若干一定相对分子质量的mPEG和20 μL三乙胺加入 30 mL 甲苯中,磁力搅拌至完全溶解;在氮气(N2)氛围中于90 ℃加热回流12 h,冷却至室温,加入无水乙醚使聚合物沉淀;将沉淀物用大量无水乙醚洗涤3次并冻干,即得到PEG-g-PSMA.
1.2 量子点/PEG-g-PSMA复合微球制备
利用SPG(一种多孔玻璃膜)膜乳化-乳液溶剂挥发法[11]制备量子点/PEG-g-PSMA复合微球.取0.12 g PEG-g-PSMA和10 mg CuInS2/ZnS量子点(自制)溶于4 mL二氯甲烷中,该溶液作为分散相;取1 g十二烷基硫酸钠(SDS)溶于200 mL超纯水中,该溶液作为连续相.在3 kPa氮气压力下,外压式MG-20膜乳化装置储液罐中的分散相透过SPG亲水膜上的微孔(孔径4.9 μm)被挤入流动的连续相中,并形成均一的水包油(O/W)型乳液.在室温条件下,对乳液以 2 200 rad/min的速度磁力搅拌24 h,液滴固化得到微球悬浮液;将微球用超纯水和无水乙醇各离心洗涤3次并冻干,即得到量子点/PEG-g-PSMA复合微球,制备过程如图1所示.将分散相中的PEG-g-PSMA改为PSMA,即可制得量子点/PSMA复合微球.通过调节分散相中量子点的发射波长λ=695,755,790 nm,可以得到3种荧光编码.
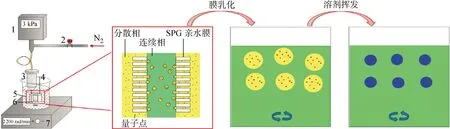
1—压力表;2—进气阀;3—分散相储液罐;4—排气阀;5—连续相;6—SPG亲水膜;7—磁力搅拌器
1.3 肿瘤标志物免疫检测
根据表1配方配制免疫检测实验用缓冲液.其中,磷酸盐缓冲液(PBS)和微球活化液以超纯水为溶剂配制,微球洗涤液、1#和2#储存液以及1#和2#分析液以PBS为溶剂配制.
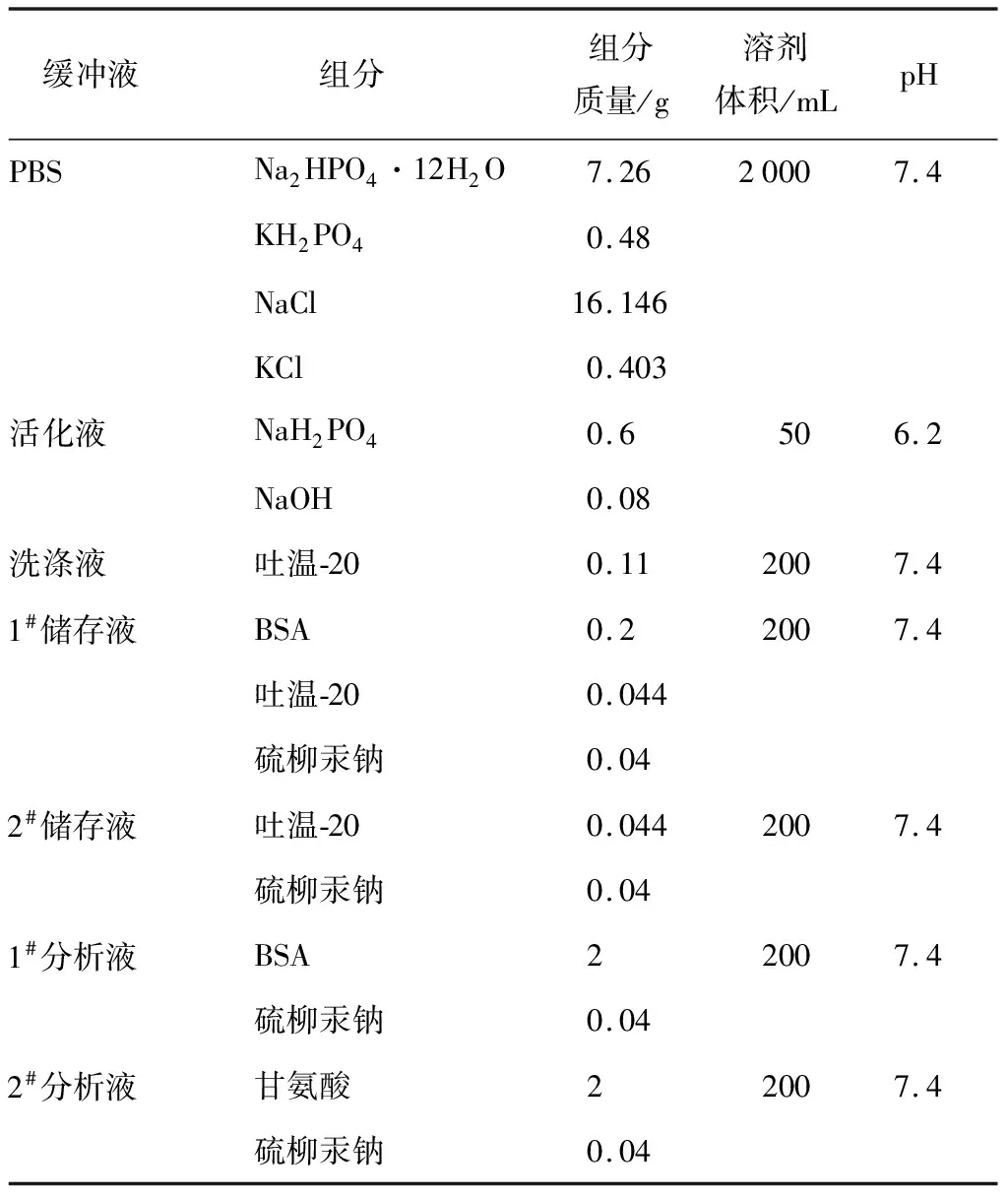
表1 免疫实验缓冲液配方
采用液相生物芯片对CA199进行免疫检测.首先,利用复合微球表面的羧基和抗体探针的氨基之间的酰胺化反应,将抗体探针偶联在微球表面.悬浮在样品溶液中的带有特定抗体探针的微球可以捕获样品内的目标抗原分子.然后加入由生物素标记的检测抗体和由亲和素标记的荧光报告分子藻红蛋白SA-PE,最后在微球表面形成“三明治”型双抗夹心免疫检测结构[12].利用流式细胞仪检测微球的荧光信号,根据微球的量子点荧光编码信号和报告分子藻红蛋白(PE)的荧光强度即可定量分析待测样品中目标抗原的质量浓度或活性浓度.本文将已知活性浓度的抗原标准品作为待测物,经梯度稀释后检测并绘制标准曲线.
1.3.1复合微球的表面探针包被 取2×105个量子点/PEG-g-PSMA复合微球或量子点/PSMA复合微球于离心管中,用微球洗涤液离心洗涤3次.加入100 μL微球活化液,超声并涡旋至微球分散均匀,加入10 μL、50 mg/mL新制的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶液和N-羟基硫代琥珀酰亚胺溶液(Sigma-Aldrich,美国),于室温以 8 800 rad/min振荡避光孵育20 min,用PBS离心洗涤.将微球重新分散于500 μL PBS中,加入12 μg CA199捕获抗体作为探针,于10 ℃以 8 800 rad/min振荡避光孵育12 h,用微球洗涤液离心洗涤.加入500 μL 2#分析液,于室温以 8 800 rad/min振荡避光孵育30 min,离心洗涤后将包被好探针的微球分散于储存液中,置于冰箱4 ℃避光保存.
1.3.2含AFP和CEA干扰的CA199单因子免疫检测 将CA199抗原标准品梯度稀释,配制活性浓度为0、0.1、1、10、100、1 000 kU/L(1 U=1 μmol/min)的CA199抗原溶液.将偶联了CA199捕获抗体的复合微球以2×104个/孔的投量加入96孔板中,用微球洗涤液抽滤洗涤3次;每孔均加入100 μL、100 ng/mL的AFP和CEA抗原溶液以及不同活性浓度的CA199抗原溶液,于室温以 6 900 rad/min振荡避光孵育1 h,抽滤洗涤3次.向各孔加入 100 μL、5 μg/mL生物素标记的AFP、CEA和CA199检测抗体溶液,于室温以 6 900 rad/min振荡避光孵育1 h,抽滤洗涤3次.向各孔加入100 μL、1 μg/mL 的SA-PE溶液(Invitrogen,美国),于室温以 3 200 rad/min振荡避光孵育10 min,抽滤洗涤3次.最后,每孔加入200 μL微球洗涤液以分散微球,并将微球悬浮液转移至离心管,采用流式细胞仪(FC500,美国Beckman公司)进行检测,激发光源为488 nm氩离子激光器,微球的编码信号由通道FL4和FL5检测,PE的定量信号由通道FL2检测.通道FL2、FL4和FL5的荧光采集范围分别为(575±15)nm、(675±15)nm和(755±15)nm.
2 结果与分析
2.1 PEG-g-PSMA的合成与表征
PEG-g-PSMA的合成路线如图2所示.首先,PSMAH的酸酐基团在酸性条件下进行水解得到PSMA;然后,经三乙胺催化,PSMA和mPEG在甲苯中酯化接枝得到PEG-g-PSMA.PEG-g-PSMA的傅里叶变换红外光谱(FTIR)和核磁共振氢谱(1H NMR)见图3.其中,σ为波数,δ为化学位移.图3(a)中,在σ=3 026,1 601,1 493,1 453,1 076,1 030,758,699 cm-1处是苯环特征峰;在σ=2 925,2 851 cm-1处是苯乙烯单元上亚甲基的伸缩振动吸收峰.水解后,在σ=1 856,1 780,1 219 cm-1处的五元环酸酐(C==O)—O—(C==O)的伸缩振动吸收峰明显变弱,在σ=1 710 cm-1处出现羧基中 C==O 双键的伸缩振动吸收峰,在σ=3 455 cm-1处出现宽而强的羧基中O—H单键的伸缩振动吸收峰,表明PSMAH已转化为PSMA.此外,在σ=1 735 cm-1处出现酯基中C==O双键特征峰,在σ=1 106 cm-1处出现 C—O—C 键的伸缩振动吸收峰,表明mPEG已接枝到PSMA上.图3(b)中,在δ=6.5×10-6,7.1×10-6处为苯乙烯单元上苯基质子的吸收峰,在δ=3.5×10-6处为PEG亚甲基质子的吸收峰,表明PEG-g-PSMA成功合成.
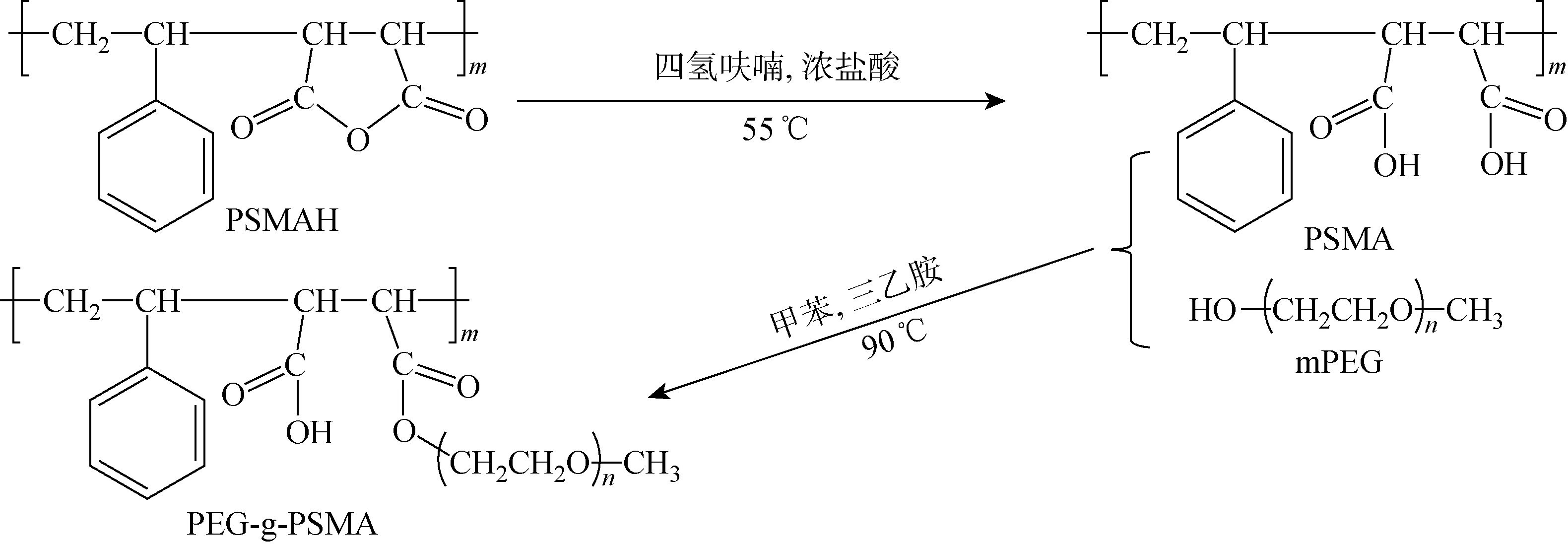
图2 PEG-g-PSMA合成图
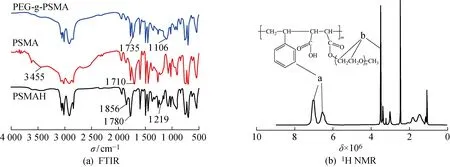
图3 PEG-g-PSMA表征
对1H NMR谱图中的峰面积积分,由下式计算得到每个PSMA分子上接枝的PEG分子数,即PEG接枝率:
其中:na为相对分子质量 224 000、酸酐质量分数7%的PSMAH中苯基质子数,取 10 015;nb为mPEG中亚甲基质子数,与PEG相对分子质量有关;Aa为苯基质子吸收峰面积;Ab为PEG亚甲基质子吸收峰面积.以PSMA与PEG1000投料质量之比,即m(PSMA)/m(PEG1000)=1合成的接枝聚合物PEG1000-g-PSMA为例,1H NMR谱峰面积比Aa/Ab=3.7,当PEG相对分子质量为 1 000 时,nb=88,则PEG1000-g-PSMA的PEG接枝率平均约为31.不同投料比所得PEG1000-g-PSMA的PEG接枝率如图4所示.由图可知,在一定范围内,随着m(mPEG)/m(PSMA)的增大,PEG接枝率呈线性增长趋势,说明通过调节mPEG的投料量可以控制接枝率.
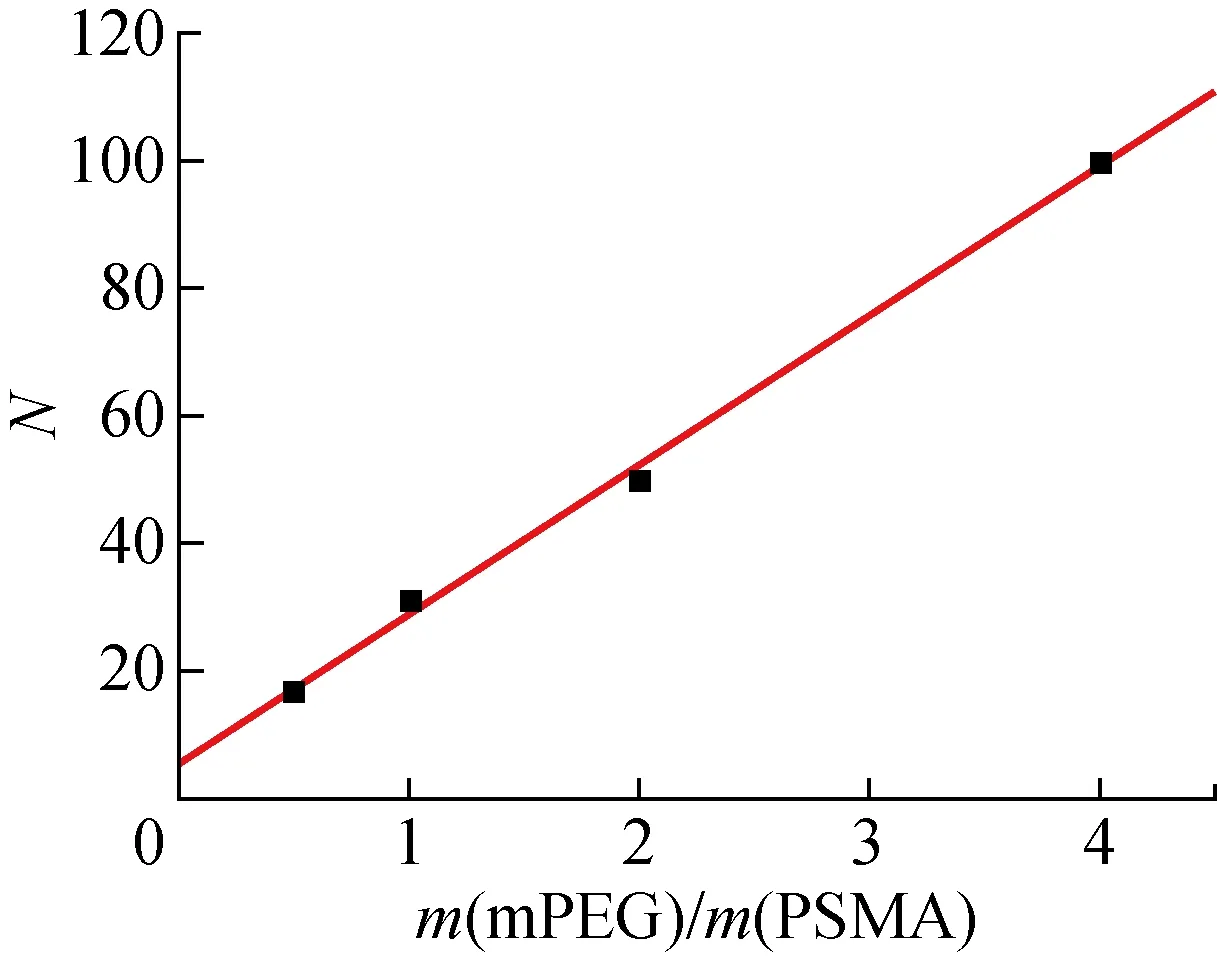
图4 PEG接枝率与投料比关系图
通过调节投料比和PEG相对分子质量制备一系列具有不同PEG接枝率和PEG链长的接枝聚合物,如表2所示.其命名通式为xPEGy-g-PSMA,其中x为PEG接枝率取5的整数倍,y为PEG相对分子质量.
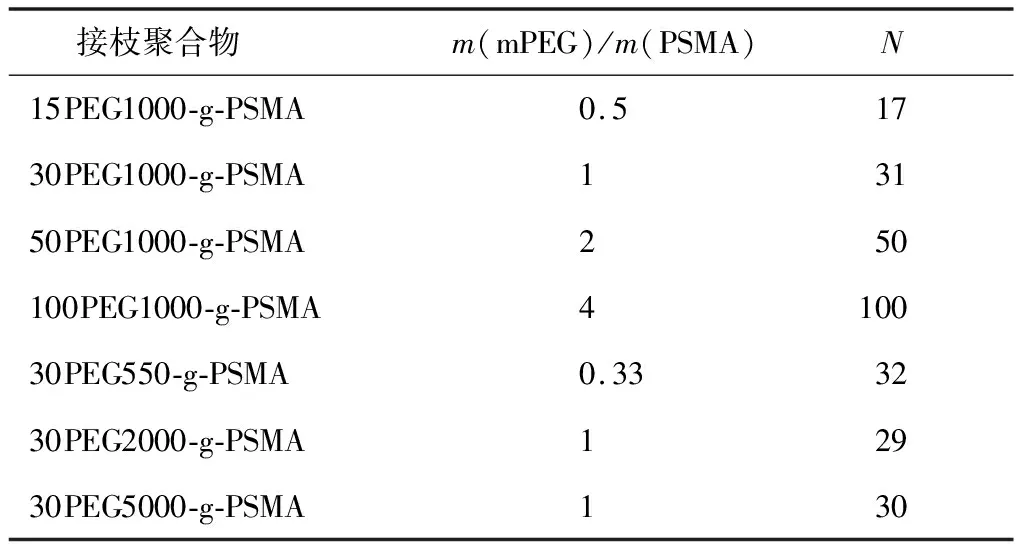
表2 不同PEG接枝率和链长的接枝聚合物
2.2 量子点/PEG-g-PSMA复合微球的形貌与性能
利用表2中的PEG接枝聚合物,以膜乳化-乳液溶剂挥发法制备量子点/PEG-g-PSMA复合微球.λ=695 nm的CuInS2/ZnS量子点复合30PEG1000-g-PSMA荧光微球的扫描电子显微镜(SEM)照片和激光扫描共聚焦(CLSM)层扫照片如图5所示.由图5(a)可知,微球呈规则球形且表面光滑,单分散性和均一性良好.经粒径统计,不同接枝率和相对分子质量聚合物制备的复合微球的平均粒径均在4.9~5.3 μm范围内,粒径变异系数均在8%~10%范围内.在制备过程中,聚合法等制备方法易导致量子点在微球内部形成局部团聚[13],增大不同量子点之间的共振能量转移,从而影响量子点的编码能力[14].由图5(b)可知,由膜乳化-乳液溶剂挥发法制备的微球,其内部不同水平横截面的量子点分布均匀,微球可发射出强烈的红色荧光.结果表明,PEG接枝聚合物具有良好的乳化成球性能.

图5 695 nm荧光30PEG1000-g-PSMA复合微球形貌分析
分别利用λ=695,755,790 nm的CuInS2/ZnS量子点和30PEG1000-g-PSMA聚合物制备出3种荧光编码微球,依次命名为30PEG1000-695、30PEG1000-755和30PEG1000-790.图6为3种微球在流式细胞仪FL4和FL5通道荧光强度散点图上形成的含有3个编码的荧光编码矩阵.其中,I为强度.由图6可知,具有相同荧光编码的微球在散点图中集聚为1个编码团簇,不同位置的团簇代表不同的荧光编码,且编码团簇内各点紧密集聚,表明复合微球可以进一步应用于液相芯片荧光编码多元检测.
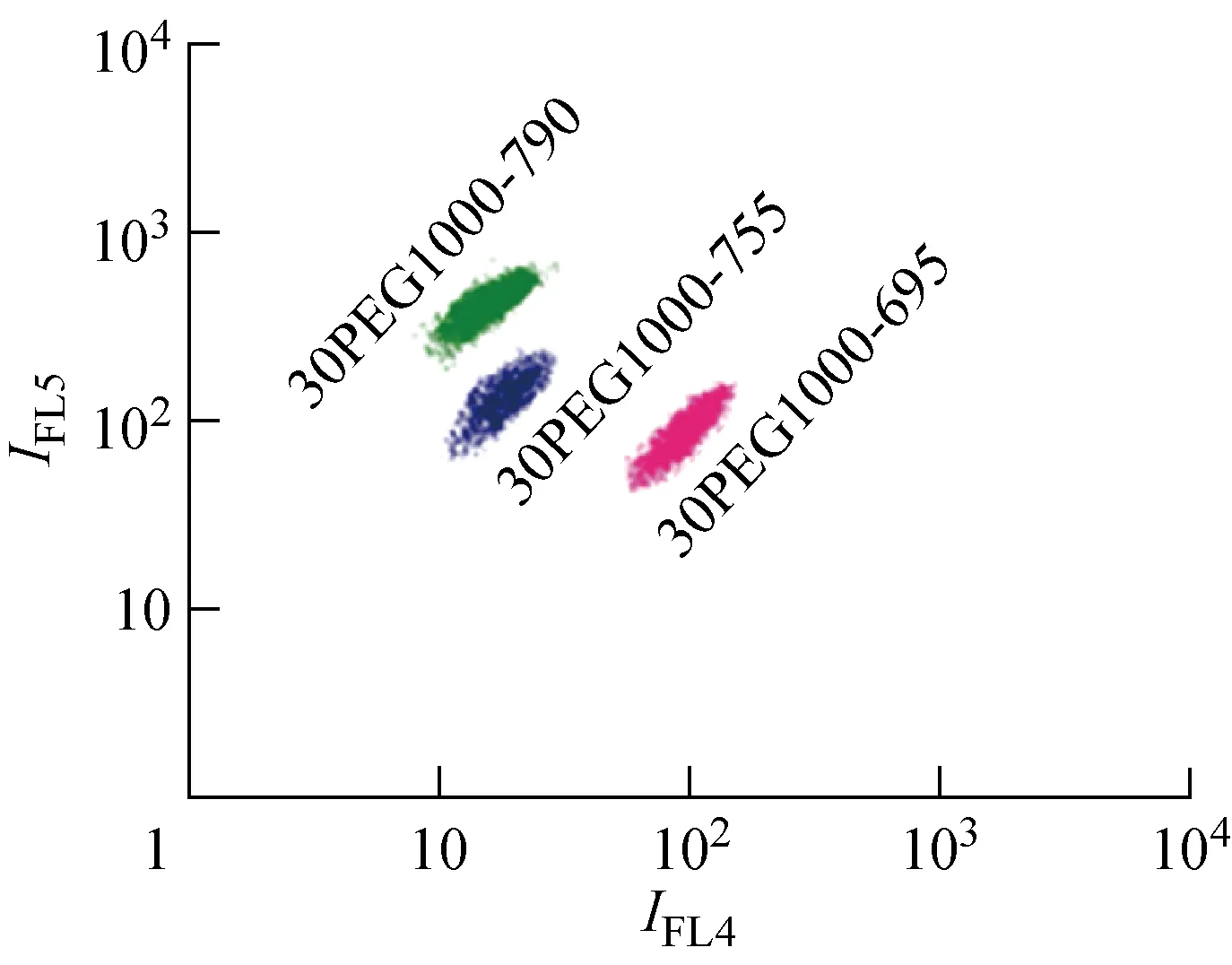
图6 流式细胞仪编码矩阵
2.3 量子点/PEG-g-PSMA复合微球用于CA199检测
血清中糖类抗原CA199的活性浓度检测对胰腺癌、结直肠癌的诊断和治疗至关重要.在液相芯片免疫检测中,为了评估量子点/PEG-g-PSMA复合微球在降低非特异性吸附、提高检测灵敏度方面的可行性和效果,进行含AFP和CEA干扰的CA199单因子检测试验.在有较高质量浓度干扰物APF和CEA存在的条件下,对CA199进行检测,并将量子点/PSMA复合微球的免疫检测结果作为对照.根据缓冲溶液的不同,将每组免疫检测试验分为两种类型:1#试验中微球探针包被封闭液(1#分析液)和微球存储液(1#存储液)均含有BSA,即以BSA为非特异性吸附抑制剂的免疫试验;2#试验均使用不含BSA的缓冲液(2#分析液和2#存储液),即无非特异性吸附抑制剂的免疫试验.根据两组试验的结果,比较PEG接枝和BSA对免疫检测中非特异性反应的抑制效果.
利用不同PEG接枝率及其相对分子质量的复合微球分别进行1#试验和2#试验,检测标准曲线,即平均荧光强度-CA199抗原活性浓度(IMF-c)曲线如图7所示.由图中的抗原低活性浓度区域放大图可知,随PEG接枝率或相对分子质量的增大,由非特异性吸附导致的背景荧光逐渐降低.当N≥30或y≥1 000 时,1#试验和2#试验的免疫检测标准曲线基本重合,说明此时复合微球自身具有较好的抑制非特异性吸附的能力,继续添加BSA则抑制效果不变.但是,随PEG接枝率或相对分子质量的增大,由特异性免疫反应产生的定量检测信号逐渐降低,这是因为PEG接枝和长链PEG的空间位阻效应使得微球表面有效羧基数目减少[15].
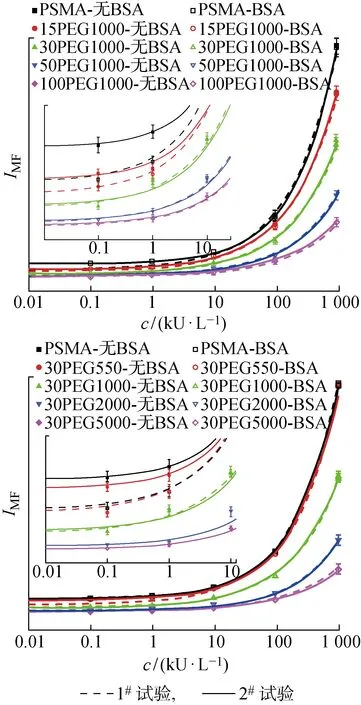
图7 CA199单因子免疫检测标准曲线
由检测标准曲线估算出最低检测限(LOD)值,如表3所示.由表可见,随PEG接枝率和相对分子质量的增大,LOD值均先减小后增大.与PSMA复合微球相比,PEG接枝聚合物复合微球的检测灵敏度明显提升.其中,30PEG1000-g-PSMA微球的检测灵敏度最高,LOD值为0.9 kU/L,优于以BSA为抑制剂的PSMA微球对照组.说明在免疫检测中,量子点/PEG-g-PSMA复合微球自身具有良好的抑制非特异性吸附的能力,不需要再使用BSA等非特异性吸附抑制剂.而当PEG接枝率或相对分子质量增大至一定程度后,LOD值升高,这也是由微球表面羧基不足令检测信号降低导致的.
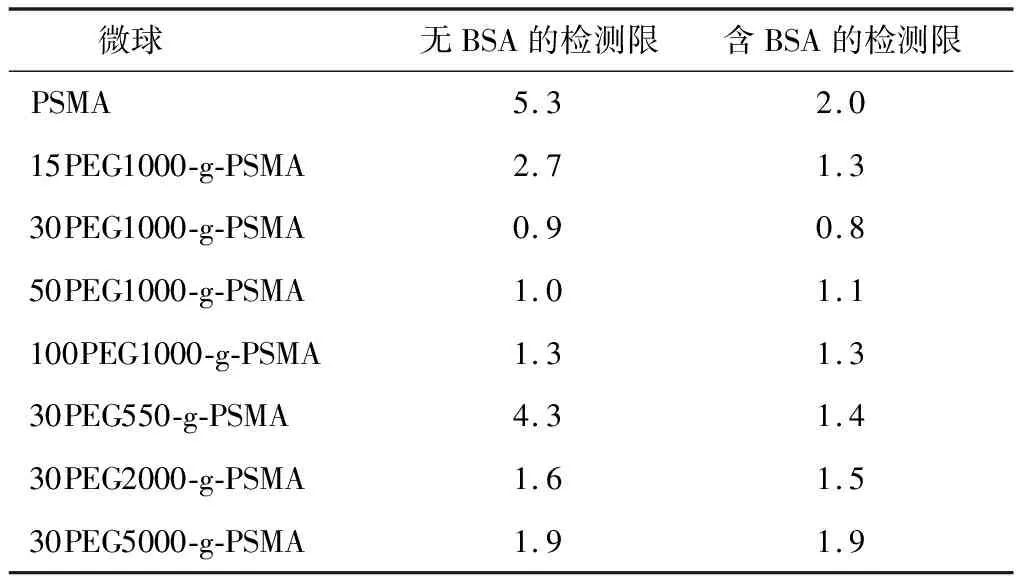
表3 CA199单因子免疫检测最低检测限
3 结语
以PEG-g-PSMA为基体材料,利用膜乳化-乳液溶剂挥发法制备不同PEG接枝率和相对分子质量的CuInS2/ZnS量子点复合PEG-g-PSMA荧光微球.所制备的微球呈规则球形且单分散性良好,平均粒径为4.9~5.3 μm,粒径变异系数为8%~10%,内部量子点及其荧光分布均匀,并且可以通过调节mPEG的投料量和相对分子质量控制PEG-g-PSMA中PEG接枝率及其链长.在干扰分子存在条件下的CA199免疫检测中,复合微球表现出抑制非特异性吸附的特性,且其抑制效果与PEG的接枝率和链长相关.与使用BSA相比,调节PEG的接枝率和链长可以获得更高的检测灵敏度.该基于PEG接枝聚合物微球的液相芯片体系具备抗干扰性、高灵敏度和准确高效等优点,令单个或多种物质的体外分析更加灵敏快捷,作为检测载体的微球适合大量制备且制备工艺简单.进一步完善基体聚合物的接枝率随投料比和PEG相对分子质量的变化规律,有望实现在蛋白、核酸等体外指标检测领域的临床应用.

