氧化钕暴露对小鼠肺组织炎症因子及转化生长因子-β/Smads通路的影响
吕佳玲,王素华,高艳荣,李怡博,宋海燕
内蒙古科技大学包头医学院,内蒙古 包头 014040
稀土钕的用途日益广泛,但是在生产稀土钕的过程中,会产生稀土氧化钕(neodymium oxide,Nd2O3)粉尘,而稀土Nd2O3粉尘会导致一系列的职业病危害[1]。已有研究发现,长期在钕及其化合物浓度较高环境中作业的工人肺部会产生纤维性病变,最终导致尘肺的形成[2]。
二氧化硅(silicon dioxide,SiO2)粉尘粒径<0.5 μm,经呼吸道进入肺组织,黏附在肺泡壁上,巨噬细胞吞噬粉尘激活了核因子-κB(nuclear factor kappa-B,NF-κB),激活的NF-κB 不仅诱导释放白介素6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促进炎症的细胞因子,还与下游转化生长因子-β1(transforming growth factor-β1,TGF-β1)的启动子结合,诱导促纤维化因子TGF-β1 的表达[1],TGF-β1 与特异性受体结合,激活下游细胞信号转导分子Smad2、Smad3,并使其磷酸化(p-Smad2、p-Smad3)后进入细胞核,将组织纤维化信号传导入核,激活经典致纤维化通路TGF-β/Smads通路[3]。
Nd2O3为粒径0.2 μm 的粉尘,同SiO2颗粒均属于细颗粒,通过呼吸道进入肺部后,支气管和肺泡区域纤毛的摆动很难将其清除,沉积在肺部的粉尘颗粒大多被肺泡巨噬细胞吞噬[1],从而激活NF-κB炎性通路,但是否会激活TGF-β/Smads 通路尚不清楚。有学者研究表明巨噬细胞对SiO2的识别是启动矽肺发病的关键点,而肺泡巨噬细胞在吞噬粉尘的过程中被活化,产生固有免疫应答反应,其特征表现为细胞因子及生长因子的合成与释放[4]。有研究发现,Nd2O3灌肺后会引起大鼠肺组织急性损伤,前期以炎性损伤为主,晚期形成纤维细胞性结节[1],胶原表达也同时增多,而羟脯氨酸(hydroxyproline,HYP)可反映胶原的代谢情况,因此测定HYP 的含量可换算成胶原含量。流行病学调查发现,稀土粉尘可以导致尘肺,其影像学具有一般尘肺的特点,却又轻于一般尘肺如矽肺,但其机制不详[5]。
本研究将C57BL/6 雄性小鼠暴露于不同浓度稀土Nd2O3后,观察染尘后第7、14、28 天小鼠肺组织病理学变化,检测小鼠肺组织中HYP、炎症因子IL-6/TNF-α、促纤维化因子TGF-β1、结缔组织生长因子(connective tissue growth factor,CTGF)的含量以及TGF-β/Smads 通路上Smad2、Smad3mRNA 相对表达量、各蛋白表达量,探讨TGF-β/Smads通路在Nd2O3致小鼠肺损伤过程中的作用,初步阐明Nd2O3致小鼠肺损伤过程中的机制。
1 对象与方法
1.1 实验试剂与仪器
Nd2O3购于中国包头市瑞鑫稀土冶炼厂,麻醉剂三溴乙醇购于中国南京爱贝生物科技有限公司,酶联免疫吸附试验试剂盒购于中国武汉伊莱瑞特公司,总RNA 提取、反转录、实时荧光定量PCR 以及蛋白质的检测试剂盒均购买于美国Promega公司。
低温高速离心机(TDZ-WS)产于中国上海安亭科学仪器厂,Cycler®96 instrument PCR仪购于美国Applied Biosystems 公司,BAYGENE 电泳仪(BG-Power600k)购于中国北京百晶生物技术有限公司,多功能微孔板检测系统(Synergy HT)购于美国Bio Tek 公司,SYNGENE凝胶成像及分析系统购于英国SYNGENE公司。
1.2 动物分组与染尘
SPF 级C57BL/6 雄性小鼠144 只,体重20~22 g,购自中国斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010。所有小鼠均饲养在内蒙古科技大学包头医学院实验动物中心,自由摄食及饮水。本研究经包头医学院伦理审查委员会的评估[批准号:包医伦审2018 第(020)号]。饲养条件:室温控制在(24±3)℃,室内湿度(50±10)%,12 h间断照明,昼夜交替,定时排风换气,保持室内无噪声、无强刺激等。
实验动物随机分为1 个对照组和3 个染尘组,每组36 只,将121℃、20 min 高压灭菌后的Nd2O3溶于无菌生理盐水制成62.5、125、250 mg·mL-1Nd2O3悬液,置于磁力搅拌器上备用。使用三溴乙醇麻醉小鼠后,分别取各浓度Nd2O3悬液各0.1 mL 通过非暴露式一次性气管注入法灌肺,对照组灌注0.1 mL生理盐水。染尘后分别于第7、14、28 天三个时间点处死小鼠,每组每个时间点均处死12只,取肺组织进行检测。
1.3 检测指标及方法
1.3.1 肺组织病理学检查称重之后取小鼠左侧肺组织固定于4%多聚甲醛中,进行HE 染色,在200 倍显微镜下观察。
1.3.2 碱水解法测定肺组织中HYP 含量称取小鼠右侧肺组织80 mg 于10 mL 比色管,加水解液,水浴。冷却加指示剂,摇匀加pH 调节剂,液体出现黄绿色停止。加双蒸水至刻度线。取水解液加活性炭,混匀后离心,取上清加底物液,混匀静置加缓冲液,5 min 后加显色剂,再次水浴冷却后离心取上清,双蒸水调零后于550 nm波长下测光密度值。
1.3.3 酶联免疫吸附试验检测肺组织中TNF-α、IL-6、TGF-β1、CTGF 含量取10 mg 小鼠肺组织置于2.0 mL离心管中,与预冷的磷酸盐缓冲液按照质量体积比1 g:9 mL 的比例制成组织匀浆,5 000×g离心10 min,取上清,按试剂盒说明书的操作步骤通过酶联免疫吸附法进行测定。
1.3.4 实时荧光定量PCR 法检测肺组织中Smad2、Smad3 mRNA表达量使用ReliaPrepTMmiRNA Cell and Tissue Miniprep System 试剂盒提取肺组织总RNA,使用北京全式金生物技术有限公司AT351-01 试剂盒进行逆转录,之后进行实时荧光定量PCR 反应。每个样品设置3 个复孔,以β-actin为内参,用2-ΔΔCt计算各样品的mRNA相对表达量。引物由上海生物工程有限公司合成,各基因引物序列见表1。按照95℃,120 s,循环1 次;95℃,15 s 循环50 次;温度降至75℃后mRNA实时荧光定量PCR 反应完成。
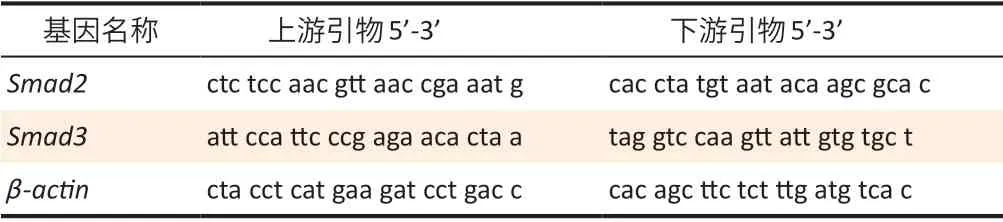
表1 引物序列表Table 1 Gene primer sequence
1.3.5 蛋白质免疫印迹法检测肺组织Smad2、Smad3、p-Smad2、p-Smad3 蛋白表达量通过对各染尘剂量组小鼠肺组织HE 染色、HYP 的检测,发现在250 mg·mL-1Nd2O3剂量下,小鼠肺组织纤维化损伤最为明显,因此每组选取3 只小鼠,检测肺组织中Smad2、Smad3、p-Smad2、p-Smad3 蛋白表达量。取小鼠肺组织称重30 mg,剪碎后加入蛋白裂解液,于冰上破碎组织,静置离心后取上清液蛋白定量、变性,经电泳、转膜、封闭、孵育、洗膜后,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参进行Smad2、Smad3、p-Smad2、p-Smad3 蛋白相对表达量的测定。
1.4 统计学分析
应用SPSS 22.0 软件进行分析,计量资料均以均数±标准差表示,对数据进行正态性检验和方差齐性检验。Smad2、Smad3 蛋白相对表达量符合正态分布且方差齐,采用两独立样本t检验。HYP、IL-6、TNF-α、TGF-β1、CTGF、Smad2/Smad3mRNA 表达量采用方差分析,方差齐的数据采用LSD-t进行两两比较;染尘第7 天HYP、TNF-α、Smad2/Smad3mRNA 表达量、染尘第14 天Smad3mRNA 表达量、染尘第28 天TNF-α含量方差不齐,采用Dunnett’s T3 检验进行两两比较。检验水准α=0.05。
2 结果
2.1 一般情况观察
灌肺时无动物死亡,各组动物体重随实验时间逐渐增加,各组小鼠体重变化如图1。
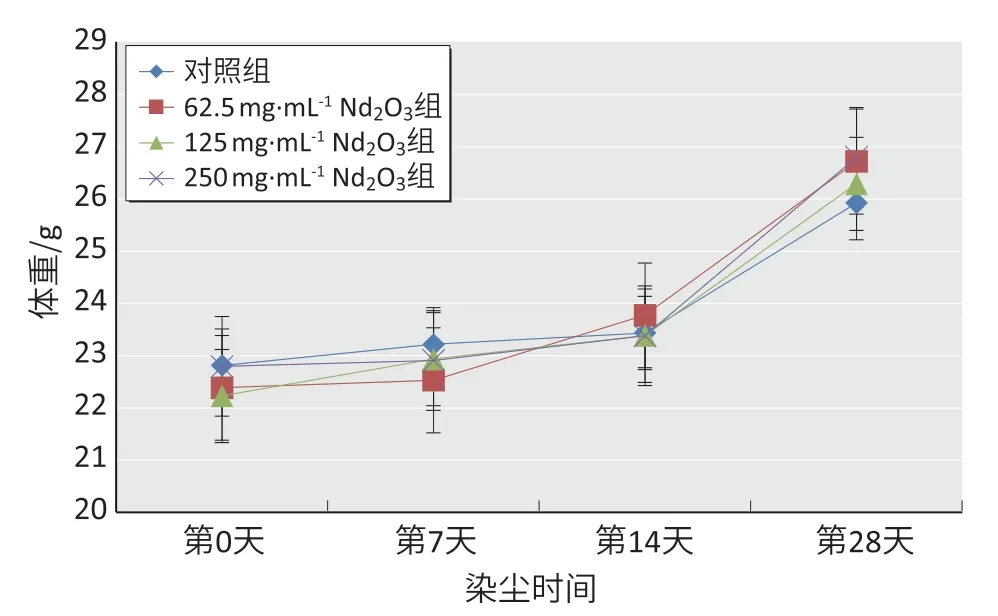
图1 Nd2O3 染尘后小鼠体重变化(n=12)Figure 1 Changes in body weight of mice after Nd2O3 exposure(n=12)
2.2 HE染色病理结果
生理盐水对照组肺泡结构完整;小鼠暴露于Nd2O3后,第7 天肺组织以炎性渗出为主,第14 天有明显的纤维增生,第28 天时高剂量出现细胞纤维结节。见图2。

图2 Nd2O3染尘后小鼠肺组织HE染色结果(×200)Figure 2 HE staining results of the lung tissues in mice after Nd2O3 exposure (×200)
2.3 HYP 含量
染尘后第7、14、28天时,125、250 mg·mL-1Nd2O3染尘组HYP含量均高于对照组(P<0.05),且在染尘后第28 天时,250 mg·mL-1Nd2O3组HYP 含量达到最高,为(1.87±0.19)μg·mg-1。见表2。
表2 Nd2O3染尘后各组小鼠肺组织HYP含量比较(±s,n=12)Table 2 Comparison of HYP levels in the lung tissues of mice after Nd2O3 exposure (±s, n=12)单位(Unit):μg·mg-1

表2 Nd2O3染尘后各组小鼠肺组织HYP含量比较(±s,n=12)Table 2 Comparison of HYP levels in the lung tissues of mice after Nd2O3 exposure (±s, n=12)单位(Unit):μg·mg-1
[注]a:与对照组比较,P<0.05;b:与62.5 mg·mL-1 Nd2O3 组比较,P<0.05;c:与125 mg·mL-1 Nd2O3组比较,P<0.05。
组别 染尘时间第7天 第14天 第28天对照组 0.77±0.01 1.01±0.09 0.94±0.00 62.5 mg·mL-1 Nd2O3组 0.94±0.01a 1.10±0.09 1.24±0.08a 125 mg·mL-1 Nd2O3组 1.49±0.13ab 1.53±0.06ab 1.50±0.02ab 250 mg·mL-1 Nd2O3组 1.54±0.01ab 1.63±0.08ab 1.87±0.19abc F 104.93 43.147 44.36 P<0.05<0.05<0.05
2.4 IL-6、TNF-α、TGF-β1、CTGF含量
除14 天TGF-β1 外,染尘后第7、14、28 天,各Nd2O3染毒组小鼠肺组织中的IL-6、TNF-α、TGF-β1、CTGF 的含量均高于对照组(均P<0.05)。在染尘后第14 天时,小鼠肺组织中IL-6、TNF-α 的含量达到最高;促纤维化因子TGF-β1、CTGF 的含量在第28 天达到最高。见表3。
表3 Nd2O3染尘后各组小鼠肺组织IL-6、TNF-α、TGF-β1、CTGF含量(±s,n=12)Table 3 The levels of IL-6,TNF-α,TGF-β1,and CTGF in the lung tissues of mice after Nd2O3 exposure (±s, n=12)

表3 Nd2O3染尘后各组小鼠肺组织IL-6、TNF-α、TGF-β1、CTGF含量(±s,n=12)Table 3 The levels of IL-6,TNF-α,TGF-β1,and CTGF in the lung tissues of mice after Nd2O3 exposure (±s, n=12)
[注]a:与对照组比较,P<0.05;b:与62.5 mg·mL-1 Nd2O3组比较,P<0.05;c:与125 mg·mL-1 Nd2O3组比较,P<0.05。
?
2.5 Smad2、Smad3 mRNA的表达
除第7 天Smad3外,染尘后第7、14、28 天各Nd2O3染尘组Smad2、Smad3mRNA 的相对表达量均高于对照组(均P<0.05),且随着染尘剂量的升高,染尘后小鼠肺组织中Smad2、Smad3mRNA 的相对表达量呈现增多的趋势,以250 mg·mL-1Nd2O3组相对表达量最多。染尘第28 天时,250 mg·mL-1Nd2O3组小鼠肺组织中Smad2、Smad3mRNA 相对表达量分别达到10.04±0.61、11.87±0.88。见表4。
表4 Nd2O3染尘后各组小鼠肺组织Smad2、Smad3 mRNA 的相对表达量(±s,n=12)Table 4 The relative expression levels of Smad2 and Smad3 mRNA in the lung tissues of mice after Nd2O3 exposure (±s, n=12)
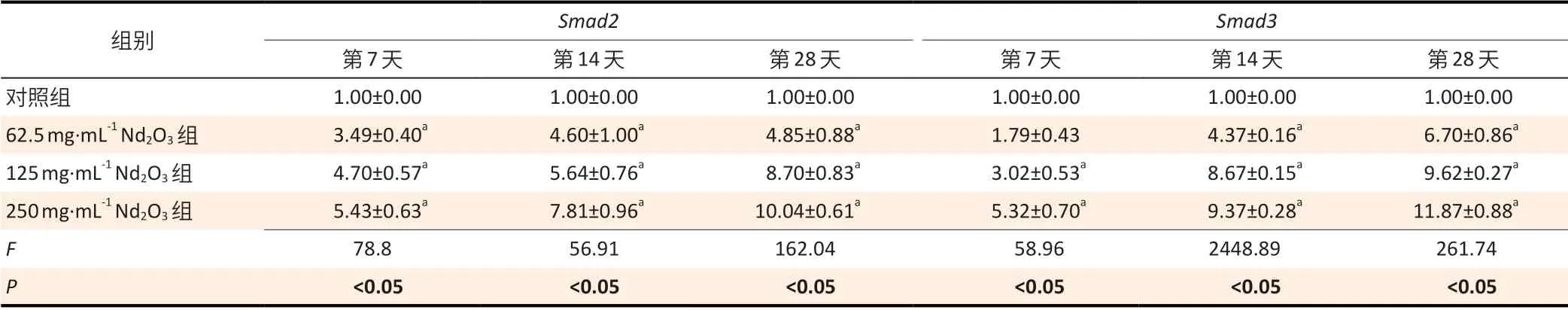
表4 Nd2O3染尘后各组小鼠肺组织Smad2、Smad3 mRNA 的相对表达量(±s,n=12)Table 4 The relative expression levels of Smad2 and Smad3 mRNA in the lung tissues of mice after Nd2O3 exposure (±s, n=12)
[注]a:与对照组比较,P<0.05。
组别 Smad2 Smad3第7天 第14天 第28天 第7天 第14天 第28天对照组 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 62.5 mg·mL-1 Nd2O3组 3.49±0.40a 4.60±1.00a 4.85±0.88a 1.79±0.43 4.37±0.16a 6.70±0.86a 125 mg·mL-1 Nd2O3组 4.70±0.57a 5.64±0.76a 8.70±0.83a 3.02±0.53a 8.67±0.15a 9.62±0.27a 250 mg·mL-1 Nd2O3组 5.43±0.63a 7.81±0.96a 10.04±0.61a 5.32±0.70a 9.37±0.28a 11.87±0.88a F 78.8 56.91 162.04 58.96 2448.89 261.74 P<0.05<0.05<0.05<0.05<0.05<0.05
2.6 Smad2、Smad3、p-Smad2、p-Smad3蛋白的表达
在250 mg·mL-1Nd2O3剂量下,染尘后小鼠肺组织中Smad2、Smad3、p-Smad2、p-Smad3 蛋白相对表达量均高于对照组(P<0.05),Smad2 蛋白相对表达量在染尘后第28天达到最高,与mRNA检测结果一致;而Smad3、p-Smad2、p-Smad3 蛋白相对表达量在第14天达到最高,第28天出现下降。见图3、图4。

图3 250 mg·mL-1 Nd2O3组小鼠肺组织Smad2、Smad3、p-Smad2、p-Smad3 蛋白表达量条带图(n=3)Figure 3 The protein expression bands of Smad2,Smad3,p-Smad2,and p-Smad3 in the lung tissues of mice in the 250 mg·mL-1 Nd2O3 group (n=3)

图4 250 mg·mL-1 Nd2O3组小鼠肺组织Smad2(A)、Smad3(B)、p-Smad2(C)、p-Smad3(D)蛋白相对表达量(n=3)Figure 4 The relative expression levels of Smad2 (A),Smad3 (B),p-Smad2 (C),and p-Smad3 (D) proteins in the lung tissues of mice in the 250 mg·mL-1 Nd2O3 group (n=3)
3 讨论
本研究对雄性健康成年小鼠进行Nd2O3灌肺染尘处理后,小鼠肺组织HE 结果显示,在染尘后第28 天时,250 mg·mL-1Nd2O3组小鼠肺组织有细胞纤维结节形成。HYP 的检测结果表明,染尘组小鼠肺组织HYP含量在各时间点高于对照组,且在染尘第28 天时,250 mg·mL-1Nd2O3组小鼠肺组织中HYP含量达到最高。这一结果说明Nd2O3染尘后可以引起小鼠肺组织中胶原纤维表达量升高,250 mg·mL-1Nd2O3可导致小鼠肺纤维化。
Nd2O3进入人体后,因其粒径小,最终会黏附在肺泡腔的表面。Nd2O3颗粒的入侵,会激活巨噬细胞,在清除Nd2O3粉尘异物的同时释放大量的炎症因子[6]。在粉尘进入肺组织,引起组织炎症时,单核巨噬细胞活化后会产生TNF-α、IL-6、TGF-β1 以及CTGF 等细胞因子。TNF-α 是一种可以诱导白细胞在炎症部位大量聚集的促炎因子,它不仅激活嗜中性粒细胞,还提高其吞噬能力,更与IL-1β 共同放大IL-6 的表达,在免疫调节和炎症调节中发挥重要作用,各种炎症因子共同促进肺纤维化发展[7]。本实验结果发现:在染尘后第7、14、28 天时,各染尘剂量组小鼠肺组织中IL-6、TNF-α 含量均高于对照组,且在第14 天时达到最高。以上结果表明Nd2O3暴露可引起小鼠炎症因子水平升高。粉尘进入肺组织,首先会引起肺组织炎症反应,持续性的炎症反应最终会引起肺组织纤维化,在这一过程中TGF-β1 发挥着关键作用。在肺纤维化发生和形成中产生的TGF-β1,在与细胞膜上的特异性受体结合后,TGF-β1 信号通路中的递质分子Smad2、Smad3活化,磷酸化后的Smad2、Smad3 携带纤维化信号进入细胞核,促进纤维蛋白的合成,致使纤维蛋白在肺间质和肺泡间过度沉积[8]。有研究发现,Smad3是TGF-β1 受体激活后起纤维化作用的主要靶点,以Snad3 磷酸化为TGF-β/Smads 通路激活的关键标志[9]。而且TGF-β1 可以与其下游效应分子CTGF 促成肺组织纤维化的发生[10]。本研究发现在染尘第7、14、28 天时各染尘剂量组TGF-β1、CTGF 均高于对照组,各染尘剂量组小鼠肺组织中TGF-β/Smads 通路相关基因Smad2、Smad3mRNA 及蛋白相对表达量较对照组均升高,且250 mg·mL-1Nd2O3剂量组p-Smad2、p-Smad3蛋白表达量较对照组均升高。染尘第28 天时,Smad3mRNA 相对表达量达到最高,但其蛋白相对表达量却较染尘第14天有所下降。可能是由于从mRNA到蛋白质的翻译过程受多种因素的影响,如mRNA 非翻译区序列的差异变化、mRNA 核糖体结合部位的序列、转运RNA 丰度等,这些因素影响了蛋白质的合成,导致mRNA 与蛋白质表达水平出现差异[11]。以上结果表明小鼠暴露于Nd2O3后,肺组织内TGF-β/Smads 通路启动因子TGF-β1、协同因子CTGF、TGF-β/Smads 通路中的关键基因Smad2、Smad3表达水平升高,p-Smad2、p-Smad3表达水平升高,提示Nd2O3可以激活TGF-β/Smads 通路,最终引起肺组织纤维化。
综上,本研究显示稀土Nd2O3暴露可引起小鼠肺组织发生炎症反应和纤维化,其机制可能与TGF-β/Smads 通路的激活有关。

