妊娠期PM2.5暴露与血清代谢组的关联
赵文轩,朱清扬,张蕴晖
复旦大学公共卫生学院/公共卫生安全教育部重点实验室,上海 200032
怀孕对于母亲及子代都是至关重要的一个过程[1],在这一过程中,母体内的代谢发生巨大的改变[2],如血糖水平升高及游离脂肪酸水平改变等[3]。这些生理性调节不仅为母体分娩和哺乳做好适应性准备,也可以满足胎儿生长发育的需求。不适宜的代谢调节会导致妊娠期糖尿病、妊娠期高血压综合征等妊娠期代谢性疾病[4-5],进而对子代的体格发育、神经发育等造成不良影响[6-7]。既往研究显示,细颗粒物(fine particulate matter,PM2.5)作为一种典型的空气污染物,是一系列妊娠期代谢性疾病(如妊娠期糖尿病、子痫前期、甲状腺功能紊乱等)的危险因素[8-10],但其背后的生物学机制尚不明确。
近年来,代谢组学技术的发展与成熟为揭示PM2.5的代谢效应提供了有力的工具,高通量的代谢组学方法已被应用于大气污染的健康效应研究[11]。如Li等[12]在一项横断面研究中,对180 名研究对象的血清进行高通量代谢组学检测,探究与短期暴露于交通相关空气污染相关的代谢通路,发现NO2、元素碳可干扰氧化应激、营养代谢等通路。现阶段,由于暴露评估手段的限制,只有少数研究对人体PM2.5暴露与代谢组的关联性进行了探讨[13-15]。其中Yan 等[13]对160 名妊娠期妇女开展了代谢组学研究,发现孕前三个月PM2.5高暴露组(PM2.5质量浓度中位数为330 μg·m-3,四分位数间距为230 μg·m-3)氧化应激及炎症相关通路发生改变。虽然该研究关注了PM2.5长期暴露,但测量仅局限于单一时间点。相较于单次测量,重复测量可以校正个体差异对结果的影响,而这一差异在代谢相关研究中尤为重要。
现有研究已部分揭示了PM2.5暴露对机体新陈代谢的影响,提示脂质代谢、氧化应激及炎症反应相关通路可能在PM2.5的健康效应中发挥一定的作用[16-19]。然而各研究结果不尽相同,且妊娠期PM2.5累积暴露对妊娠期代谢的影响及其潜在代谢机制仍不明确。因此,本研究拟通过气相色谱-飞行时间质谱(gas chromatography-time-of-flight-mass spectrometry,GCTOF-MS)和超高效液相色谱-组合型四级杆Orbitrap质谱(ultra-high-performance liquid chromatography-Q exactive orbitrap mass spectrometry,UHPLC-QE-MS)双平台高通量非靶向代谢组学技术获取孕妇在妊娠期的血清代谢物谱数据,探讨妊娠期PM2.5暴露与血清代谢组的关联。
1 对象与方法
1.1 研究对象
基于上海亲子队列(Shanghai Maternal-Child Pair Cohort,Shanghai MCPC),本研究从329 名进行PM2.5个体暴露采样的妊娠期妇女中,随机选取50 名具有完整妊娠期随访数据、单胎活产且无妊娠期并发症(包括但不限于妊娠期高血压、妊娠期糖尿病)的健康孕妇,并从上海亲子队列问卷信息库中获取其基本人口学信息。本研究经复旦大学公共卫生学院医学研究伦理委员会批准(编号:IRB#2016-04-0587-EX)。
1.2 PM2.5暴露评估
研究对象分别在孕早中期、孕晚期经历两次连续72 h PM2.5个体采样,并结合卫星数据和时间-活动模式等变量构建个体PM2.5预测模型,模型R2=0.77,具体采样方案及模型的构建见先前报道[20]。其中时间-活动模式指孕妇在不同活动模式下所花费的时间,第一次采样前的时间-活动模式以同期问卷记录为准,其他时间-活动模式通过线性混合效应模型平滑获得,并采用空气净化器使用时间及停止工作日期校准模型预测值。取两次采样结束日期前三个月的平均PM2.5个体暴露浓度,探讨妊娠期PM2.5累积暴露与血清代谢组的关联。
1.3 代谢组学检测
血清样本来自两次采样同期产检时留存的样本,自采血日起于复旦大学生物样本库-80℃条件下冻存,直至检测。
1.3.1 GC-TOF-MS 法代谢组学检测GC-TOF-MS 法适用于分子量跨度较大的代谢组学研究。质谱数据的峰提取、矫正、解卷积、峰积分及峰对齐等处理均在ChromaTOF(版本4.3x)软件中完成。
1.3.2 UHPLC-QE-MS 法代谢组学检测相较以往的液相色谱-质谱法,UHPLC-QE-MS 法具有更高的速度、灵敏度、分辨率及特异性,是定性、定量筛查的一种理想方法。分别对阴离子、阳离子模式下的数据进行前处理。原始数据的保留时间校正、峰识别、提取、积分及对齐等工作均使用R 语言(版本3.5.2)的XCMS包(版本3.12)完成。
1.4 统计学分析
采用主成分分析法评价血清代谢组学检测结果的稳定性。运用线性混合效应模型探讨妊娠期PM2.5暴露对血清代谢组的影响,模型校正变量包括孕妇的年龄、体重指数(body mass index,BMI)、孕周、产次、孕期增重、职业及家庭年收入等。为避免引入大量的假阳性错误,本部分研究基于Benjamini 等[21]提出的错误发现率(false discovery rate,FDR)估计方法,进一步校正了模型中的P值,记为PFDR。进入通路分析的代谢物需同时满足在混合效应模型中P<0.05 且PFDR<0.05。
1.5 代谢通路分析及代谢物定性
使用Python(版本3.0)语言环境下的mummichog工具为与PM2.5暴露相关的UHPLC-QE-MS 代谢组学信号峰进行通路注释。mummichog 算法的假设是与某一生物学机制真正相关的代谢物必然在人体代谢物网络中呈现一定的空间聚集性,而假阳性结果则应服从随机分布(Gamma 分布),该算法通过Gamma 分布的累积分布函数对通路富集结果进行假设检验。该方法同时考虑了代谢物定性在统计学上的意义及在生物学上的合理性,已被广泛应用于非靶向代谢组学的研究中[17,22]。
选用xMSannotator 工具对UHPLC-QE-MS 法所识别的信号峰进行定性分析,该方法同时考虑了物质在不同离子模式下所有潜在的加和态类型及其在特定代谢通路中与上下游产物的共表达信息,还可根据聚类及质荷比等信息为代谢物定性给出置信度评分[23]。所有相关过程均在R 语言(版本3.5.2)环境下完成。
GC-TOF-MS法测得代谢物通过匹配实验室自有标准品数据库及外部公开数据库中的代谢物特征信息(保留时间、质荷比)完成定性,包括京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)、人类代谢组数据库(Human Metabolome Database,HMDB),相似度阈值为0.7。通过富集分析完成代谢物通路分析。
2 结果
2.1 研究对象基本人口学特征及暴露水平
如表1所示,研究对象平均年龄为(29.31±3.83)岁,孕早中期BMI 为(22.57±2.87)kg·m-2,92%的研究对象文化程度为大专及以上。该部分孕妇与所有参与PM2.5个体暴露采样的孕妇的基本人口学信息的差异均无统计学意义。

表1 研究对象基本人口学信息及PM2.5暴露水平Table 1 Socio-demographic characteristics and PM2.5 exposure levels of participants
研究对象分别在怀孕的第(17.88±0.81)周、第(32.54±1.26)周接受孕早中期、孕晚期血清代谢组学检测,检测前三个月PM2.5平均暴露水平分别为(44.03±8.74)、(40.31±6.33)μg·m-3,且二者的数值差异具有统计学意义(P<0.05)。此外,孕妇的体重随怀孕进程显示出明显增长,相较孕早中期而言,孕晚期平均体重增长了约8 kg,BMI相应增长了约3 kg·m-2。
2.2 代谢组学数据质控
质控样本在UHPLC-QE-MS 阳离子、阴离子模式及GC-TOF-MS 下测得代谢物的主成分分析结果见图1。样本均在由主成分1、主成分2 及主成分3 组成的三维空中间呈紧密团状分布,提示代谢组学测定结果较为稳定。
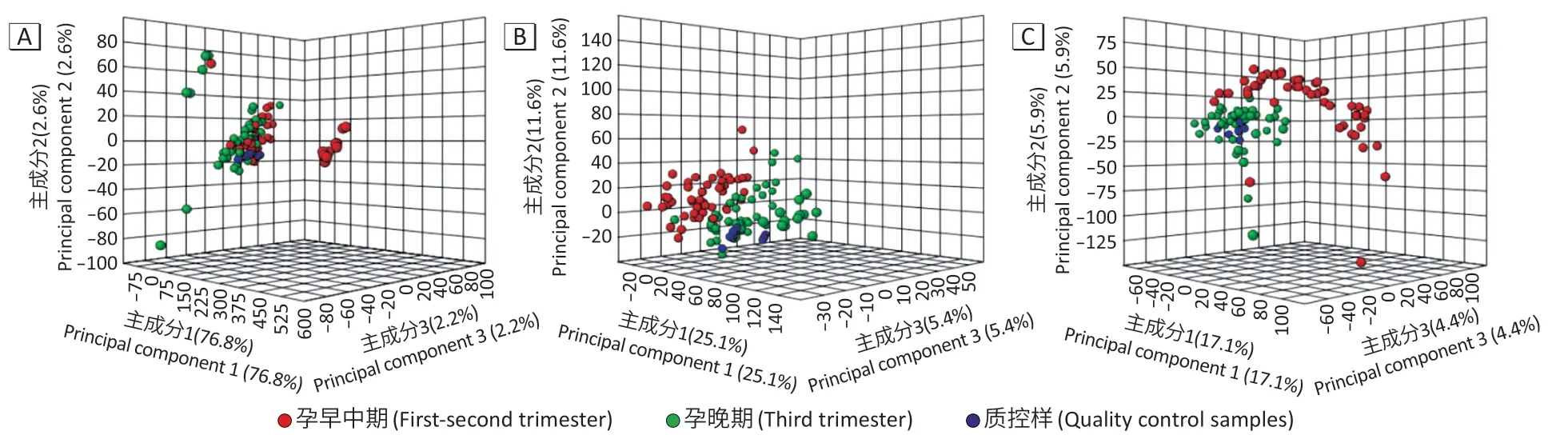
图1 质控样本GC-TOF-MS及UHPLC-QE-MS 主成分分析结果Figure 1 Principal component analysis results of quality control samples by GC-TOF-MS and UHPLC-QE-MS
2.3 妊娠期PM2.5暴露与血清代谢组的关联
如表2所示,血清GC-TOF-MS 代谢组学检测共测得415 个信号峰,其质荷比分布在57~459 之间,其中有301 个信号峰得到了准确定性。UHPLC-QE-MS 阳离子、阴离子模式分别检测到5 436、3 510个信号峰,其质荷比分布在71~983及70~998之间。

表2 各检测方法中与PM2.5相关的代谢物(信号峰)数量Table 2 Number of metabolites (signal peaks) related to PM2.5 by different detection methods
线性混合效应模型初步分析结果显示,GC-TOFMS 法检测的代谢物中有30 个信号峰与妊娠期PM2.5相关,UHPLC-QE-MS 阳离子、阴离子模式结果中分别有2 110、675 个信号峰与PM2.5暴露相关。校正FDR 之后,这一数字分别降低至19、1 903与179。
mummichog 通路分析结果显示,妊娠期PM2.5暴露主要影响了15 条相关代谢通路(表3)。其中,前列腺素的γ 亚麻酸合成、白细胞三烯代谢及维生素E 代谢通路在阳离子、阴离子模式中均被发现与妊娠期PM2.5暴露相关(GammaP<0.05)。此外,在阳离子模式中额外发现了PM2.5暴露可以影响脂肪酸激活、脂肪酸代谢、脂肪酸氧化、Ω-3 脂肪酸代谢等相关通路。在阴离子模式中额外发现了PM2.5暴露可以影响前列腺素的花生四烯酸合成、维生素A 代谢及C21 甾类激素的生物合成及代谢等生物通路。这些通路主要涉及的生物学机制包括外源性化学物介导的氧化应激、炎性反应及脂肪酸代谢等。
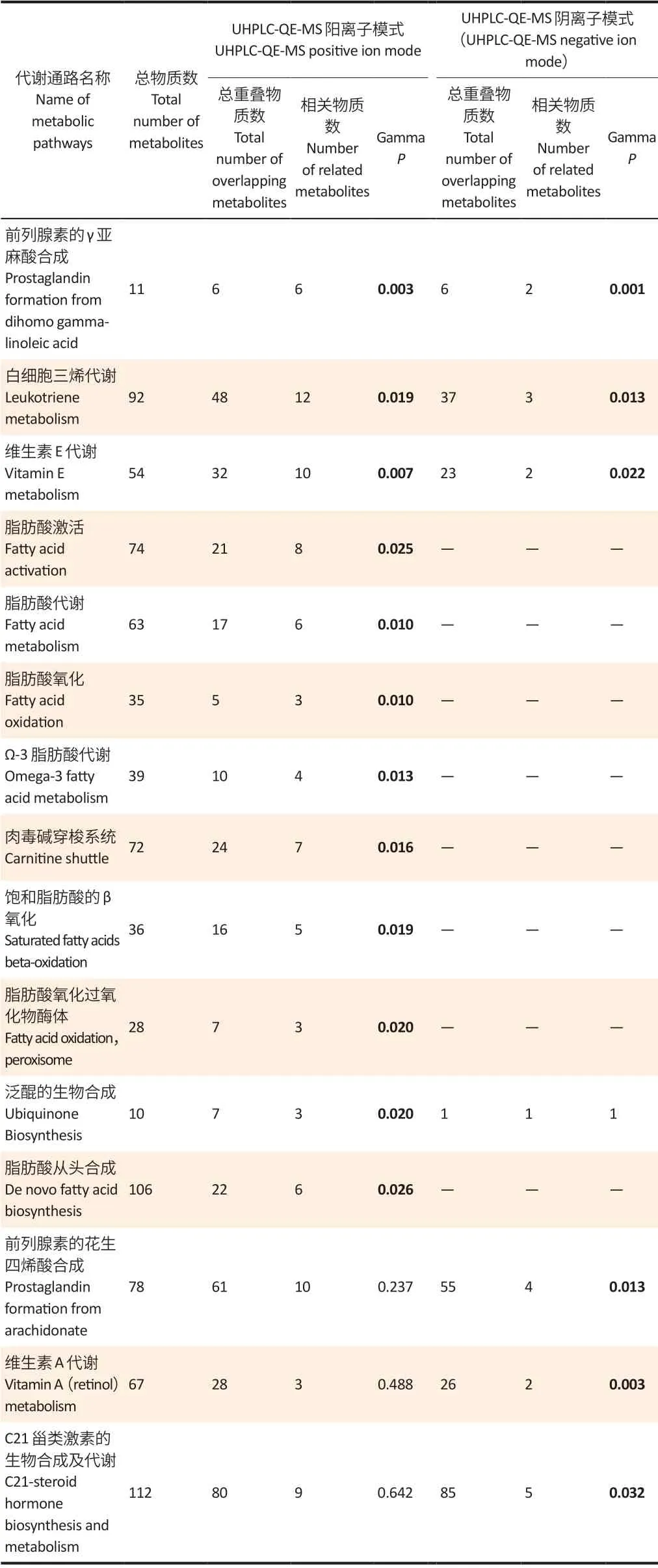
表3 与妊娠期PM2.5暴露相关的代谢通路Table 3 Metabolic pathways related to gestational PM2.5 exposure
进一步运用xMSannotator 工具对代谢物进行UHPLC-QE-MS 代谢产物定性分析,这些代谢产物同时满足在3 条主要通路内(前列腺素的γ 亚麻酸合成、白细胞三稀代谢及维生素E 代谢通路),且与PM2.5暴露相关(PFDR<0.05)。在前列腺素通路中关键代谢分子包括前列腺素E1、前列腺素F2α、前列腺素G1及前列腺素H1等。PM2.5暴露主要与前列腺素通路中的物质呈现正相关关系,仅与前列腺素H1呈现负相关。在白细胞三烯代谢通路中,代谢产物主要为白细胞三烯B4及其相关前体(如20-氧代-白细胞三烯B4 等)。作为机体氧化应激的指标,白细胞三烯及其代谢前体多与妊娠期PM2.5暴露呈现正相关关系。维生素E代谢通路中,与妊娠期PM2.5暴露有关的物质主要包括生育三烯酚与生育酚的代谢前体物质,这些参与机体抗氧化过程的物质主要与妊娠期PM2.5暴露呈现负相关关系。
通过GC-TOF-MS 方法定性的代谢物中,与妊娠期PM2.5暴露呈现负相关的物质包括丙氨酸、L-葡萄糖辛酸、十八碳烯酸、环戊硅氧烷、甲醛、L-谷氨酸等,而与PM2.5暴露呈现正相关的物质则主要包括胆固醇、哌啶酸、异吲哚、油酸、花生四烯酸等。其中,花生四烯酸作为前列腺素及白细胞三烯生物合成的一个重要前体物质,与PM2.5暴露呈现正相关关系(β=0.21,P<0.001 且PFDR=0.018)。
将上述物质进行富集分析,得到如图2所示的4条主要代谢通路,分别为天冬氨酸代谢、葡糖-丙氨酸循环、丙氨酸代谢及谷胱甘肽代谢通路。
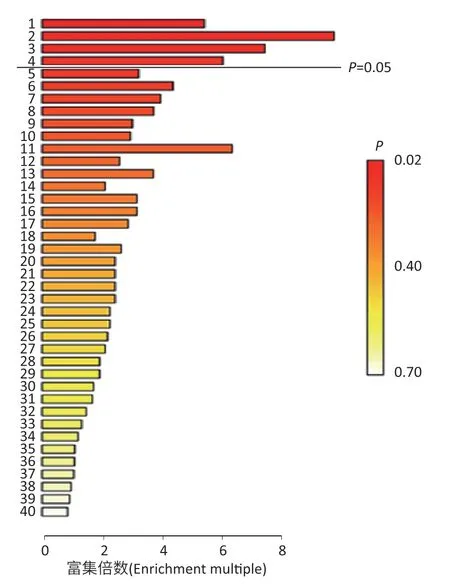
图2 GC-TOF-MS检测中与PM2.5暴露有关的代谢通路富集情况Figure 2 Metabolic pathways related to PM2.5 exposure by GC-TOF-MS
3 讨论
本研究在前期评估妊娠期妇女个体PM2.5暴露水平的工作基础上,结合全代谢组关联研究进一步探讨了妊娠期PM2.5累积暴露与血清代谢组的关联。线性混合效应模型和通路富集分析结果指示,妊娠期PM2.5暴露会干扰孕妇体内一些生物学通路。其中,前列腺素的γ 亚麻酸合成、白细胞三烯代谢及维生素E 代谢通路在不同离子模式的UHPLC-QE-MS 代谢组学研究中均被发现与PM2.5暴露具有关联;这些代谢通路的部分前体物质在GC-TOF-MS 代谢组学研究中则进一步被证明与PM2.5暴露正相关。
前列腺素与白细胞三烯同属于类二十碳烷物质,参与体内多项生物稳态调节及炎症反应[24]。血浆前列腺素F2水平更被认为是在体内实验中反映氧化应激水平的“金标准”[25]。对孕产妇健康而言,前列腺素在子宫肌层活动中具有核心地位[26],而前列腺素F2α及前列腺素E2水平与流产的发生具有正相关关系[27]。白细胞三烯这类物质能促进炎症、变态反应和趋化性。既往流行病学研究指出,PM2.5急、慢性暴露会导致一般人群血浆白细胞三烯B4 水平升高[17,28]。维生素E 在人体中主要以生育酚及生育三乙烯酚的形式存在,作为过氧化自由基清除剂,可拮抗由PM2.5或臭氧所介导的炎性反应及氧化应激[29]。对于孕妇而言,维生素E 水平降低是子痫前期的危险因素之一[30]。其他通过UHPLC-QE-MS 方法定位的与妊娠期PM2.5暴露相关的代谢通路也佐证了PM2.5对脂肪酸代谢的影响,包括脂肪酸的从头合成、激活、代谢及氧化等过程。在既往研究中,PM2.5对脂质代谢的不良影响也已得到广泛报道[31]。
使用GC-TOF-MS 代谢组学研究发现的花生四烯酸是白三烯及前列腺素的主要前体物质,有效印证了PM2.5暴露与上述代谢通路之间的关联,对UHPLC-QEMS 结果形成了良好的补充。此外,本研究发现PM2.5暴露可降低L-谷氨酸及丙氨酸的水平,并进而影响谷胱甘肽代谢。谷胱甘肽是拮抗氧化应激作用的重要物质[32],该代谢通路的紊乱可影响机体抵抗氧化应激作用的能力。在孕产妇人群中,谷胱甘肽代谢失调是子痫前期的一个重要危险因素[33]。
本研究结果显示,妊娠期PM2.5暴露可对孕妇体内部分代谢通路造成干扰,而孕妇代谢紊乱造成的代谢性疾病会进一步对儿童健康造成不良影响。妊娠期糖尿病可以增加死胎、巨大儿、新生儿低血糖等不良妊娠结局的发生风险,且对子代的影响可持续至儿童时期甚至成年后,增加其肥胖发生率[34]。亚临床的妊娠期甲减不仅会增加早产、低出生体重儿等不良结局风险,还会影响子代后续神经发育[35]。
本研究应用高通量的非靶向血清代谢组学方法探讨了妊娠期PM2.5暴露与血清代谢组的关系,同时使用了UHPLC-QE-MS 和GC-TOF-MS 双平台进行检测,两者结果互为补充,一定程度上揭示了妊娠期PM2.5暴露相关的生物学机制,与其他空气污染相关研究的结果相似[11-13]。
本研究仍存在一些局限性。首先,本研究的样本量较少,但研究结论与其他相关文章相似。其次,本研究只进行了两次血清代谢组学检测,虽然弥补了结局时间节点单一的问题,也平衡了个体内不同时间的代谢差异,但不能反映妊娠期血清代谢改变的中间过程。最后,尽管本研究综合专业知识及既往相关研究,主要考虑了与孕妇血清代谢相关且与PM2.5暴露相关的协变量,包括孕妇的年龄、BMI、孕周、产次、孕期增重、职业及家庭年收入等协变量,但依旧可能存在饮食、被动吸烟等混杂因素。
综上,本研究结果发现妊娠期PM2.5暴露会干扰孕妇一些生物学通路的表达,这些通路主要指向氧化应激、炎症反应及脂肪酸代谢。

