指屈肌主动不足条件下屈指运动时神经肌肉的调控
张静,郭峰
1.枣庄学院体育学院,山东枣庄市 277160;2.沈阳体育学院运动人体科学学院,辽宁沈阳市 110102
脑卒中募集运动单位困难,导致主动肌自主收缩障碍,影响肌力,导致主动肌无力和手指运动功能异常[1]。多关节肌主动不足是指多关节肌作为原动肌工作时,当其肌力充分作用于一个关节后,就不能再充分作用于其他关节而表现出力量上的不充分现象[2]。Kamper 等[3]观察11 例脑卒中患者,仅2 例能够在承担负荷的条件下完成手指屈伸运动;指屈肌和伸肌的共同激活异常,指伸肌自发兴奋性降低,可能是导致手指屈伸无力的主要原因。Ingemanson 等[4]探讨脑卒中患者手指本体感觉障碍对手指运动功能的影响。Eschmann 等[1]发现,脑卒中患者由于指伸肌和指屈肌肌无力,手指运动幅度显著低于正常人。脑卒中患者的肌无力和动作异常,可能与神经系统对主动肌和拮抗肌的激活失常有关。朱燕等[5]发现,恢复期脑卒中患者患侧肘关节屈伸运动时,主动肌和拮抗肌协调性存在异常。杨慧馨等[6]以及戈含笑等[7]的研究都发现,脑卒中患者下肢踝关节屈伸运动时,主动肌和拮抗肌间的协同性差是导致动作异常的主要原因。Chalard 等[8]发现,脑卒中患者在肘功能康复过程中,屈伸运动时主动肌和拮抗肌间的协同性增强。
脑卒中后脑神经细胞死亡或发生相应病变,影响下行皮质-脊髓通路对信号的传导,影响主动肌和拮抗肌激活。目前对脑卒中患者神经肌肉控制机制的研究多通过表面肌电图(surface electromyography,sEMG)观察,对大脑和脊髓控制通路的变化少有探究。脑电图的皮质-肌肉相干(corticomuscular coherence,CMC)可以了解大脑运动皮质区对肌肉的控制情况,代表运动皮质与所支配肌肉之间的功能性联系,已经用于正常人和运动控制障碍患者的运动控制评价[9-10],最近也用于脑卒中患者运动功能康复评价中[11],发现急性脑卒中运动功能障碍患者CMC 振幅显著下降,随着运动功能的康复CMC升高。
本研究观察健康人在指屈肌肌力正常(normal flexor digitorum strength,NDS)和指屈肌主动不足(initiative inadequate of flexor digitorum,IDS)两种条件下,手指进行最大随意等长收缩(maximal voluntary isometric contraction,MVC)和50%MVC 动力性收缩任务时,指屈肌和指伸肌的sEMG、脑电图以及肌力,以期待探究人体在IDS 条件下运动时,大脑的神经控制策略,以帮助我们了解脑卒中患者手指肌无力的神经机制,为脑卒中患者康复提供参考。
1 资料与方法
1.1 一般资料
2019年3月,于沈阳体育学院非体育专业(如管理等)招募女大学生志愿者12例。
纳入标准:①无专业体育训练经历;②自愿参与本研究。
12例研究对象中,年龄20~24岁,平均(22.3±1.0)岁;身高159~172 cm,平均(167.8±3.8) cm;体质量48~79 kg,平均(60.8±9.7)kg。所有对象身体健康,试验前避免剧烈身体活动。
试验前告知试验的具体程序,受试者都知情同意参与试验,并签署知情同意书。
本研究经沈阳体育学院伦理委员会审核通过。
1.2 方法
指屈肌跨腕和指,属双关节肌。本研究通过主动屈腕后再做屈指运动的方式诱发IDS。观察受试者在NDS 和IDS 条件下,右侧手指做100%MVC 静力性收缩和50% MVC 动力性收缩,采集指屈肌和指伸肌sEMG、脑电图和握力。
1.2.1握力
受试者坐于有扶手的椅子上,两脚分开与肩同宽,背部靠在椅背上,身体放松,右手握经改造的HP-500 电子握力计(艾德堡有限公司),前臂支撑在扶手上,肘关节呈90°。电子握力计与电脑相连,实时显示握力。电子握力计采样频率50 Hz。试验前,调整握力计力量输出曲线比例尺,使力值输出水平显示适合监测。
NDS:保持前臂和手为一条直线。IDS:前臂保持原姿势,肘不要抬起,腕主动最大屈曲,电子关节角度仪实测实际屈曲角度(85.6±3.5)°。
受试者分别在NDS和IDS条件下尽最大力量握握力器(100% MVC 静力性等长收缩),持续5~6 s,共3次,每次之间休息5 min;测试时,鼓励受试者超过前一次测试值,取最大值作为MVC。两种条件随机进行,两种条件之间休息15 min。
完成静力性等长收缩后,受试者再休息15 min。分别在NDS 和IDS 条件下,以自觉50% MVC 水平抓握握力器(动力性收缩),收缩1~2 s 后,放松2 s,共15 次。两种条件随机进行,两种条件之间休息15 min。
完成动力性收缩后再行100%MVC 静力性等长收缩测试1次。
为降低个体力量差异的影响,将输出力值表示为MVC的百分比(MVC%)。
1.2.2sEMG
采用64 导联NeuroScan 脑电仪(COMPUMEDICS公司)中的sEMG通道采集受试者的右侧前臂指屈肌和指伸肌信号。采用双极差分记录方式,每块肌肉两个记录电极,与肌纤维方向平行,电极间距离约1.5 cm;指屈肌参考电极置于尺骨鹰嘴,指伸肌参考电极置于尺骨茎突。连接线用绷带固定于前臂,避免抖动造成基线干扰。采集前,磨砂膏打磨皮肤表面,酒精去除角质层,以降低电极阻抗。采样频率1000 Hz。
sEMG 振幅进行标准化,将实测的最大sEMG 振幅除以初始MVC 测试时相应肌肉的最大sEMG 振幅(sEMG%),以降低个体差异的影响。最大sEMG 振幅以峰值sEMG 振幅为中心,计算前后共200 ms 内的平均振幅。
采用小波分析法,获取sEMG 的指屈肌平均功率频率(mean power frequency,MPF)。
1.2.3脑电图
采用64 导联NeuroScan 脑电仪(COMPUMEDICS公司)采集脑电信号。采集前,受试者洗头,去除油脂和头皮屑,使用风筒吹干。佩戴脑电帽,Cz点位于两耳连线的中点;每个电极点注入导电膏,使所有电极点的阻抗都<5 kΩ。
动力性收缩过程中,同步采集脑电图和sEMG,采样频率1000 Hz。数据处理采用基于Matlab 的EEGlab 14.1b 软件完成。脑电图和sEMG 数据滤波,滤波范围5~100 Hz;再行50 Hz 陷波;然后降采样处理,重新采样频率250 Hz。以sEMG 触发为事件点,取其后1 s 脑电图,将15 次运动的脑电图数据分为15段。手动去除较大伪迹干扰段,然后对分段数据进行独立成分分析(independent component analysis,ICA)。去除眼电成分。将没有干扰的脑电图和sEMG 计算脑肌电相干性(cortico-muscular coherence,CMC)。
CMC 为两个信号间的相关性。本研究关注脑电波γ 波段(31~50 Hz)与指屈肌sEMG 之间的联系,按Chen 等[12]的方法计算CMC。先计算各导联脑电图与指屈肌sEMG之间的CMC,然后观察哪些脑区对指屈肌产生支配。根据屈指运动时CMC 在脑区的投射特点,本研究选取头皮电极Cz、C1、C3的CMC进行统计学分析。
1.4 统计学分析
采用SPSS 19.0 统计软件进行数据分析。数据服从正态分布,以()表示。两种条件下肌力和sEMG 振幅行配对样本t检验。对15 次动力性收缩的数据采用重复测量方差分析。两种条件下不同电极的CMC比较使用配对样本t检验。显著性水平α=0.05。
2 结果
2.1 静力性最大等长收缩
受试者NDS 条件下MVC 为(191.4±36.3)N,显著高于IDS 条件下(125.6±33.6) N (t=5.757,P<0.001)。提示模型成功。NDS 条件下与IDS 条件下,指屈肌和指伸肌sEMG振幅均无显著性差异(P>0.05)。见表1。
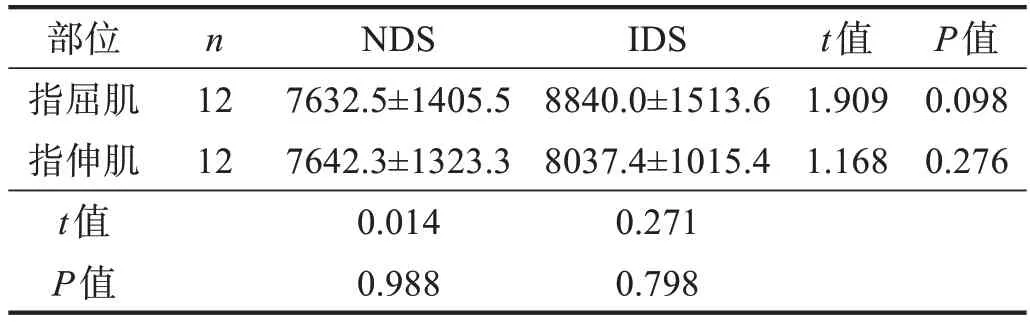
表1 两种条件下静力性最大等长收缩指屈肌和指伸肌sEMG振幅比较(μV)
指屈肌与指伸肌sEMG 振幅的差值,IDS 条件下为(801.7±207.1) μV,显著高于NDS 条件下(-10.5±3.6)μV(t=13.232,P<0.001)。
NDS 条件下,指屈肌MPF 为(87.6±27.8) Hz,高于IDS条件下(73.1±20.1)Hz(t=2.152,P=0.043)。
2.2 动力性收缩
受试者在NDS 条件下,每次收缩都能保持在50% MVC 左右;IDS 条件下,受试者很难维持50%MVC 水平,且标准差较大;但在两种条件下,15 次动力性收缩肌力无显著性差异(P>0.05)。见表2。
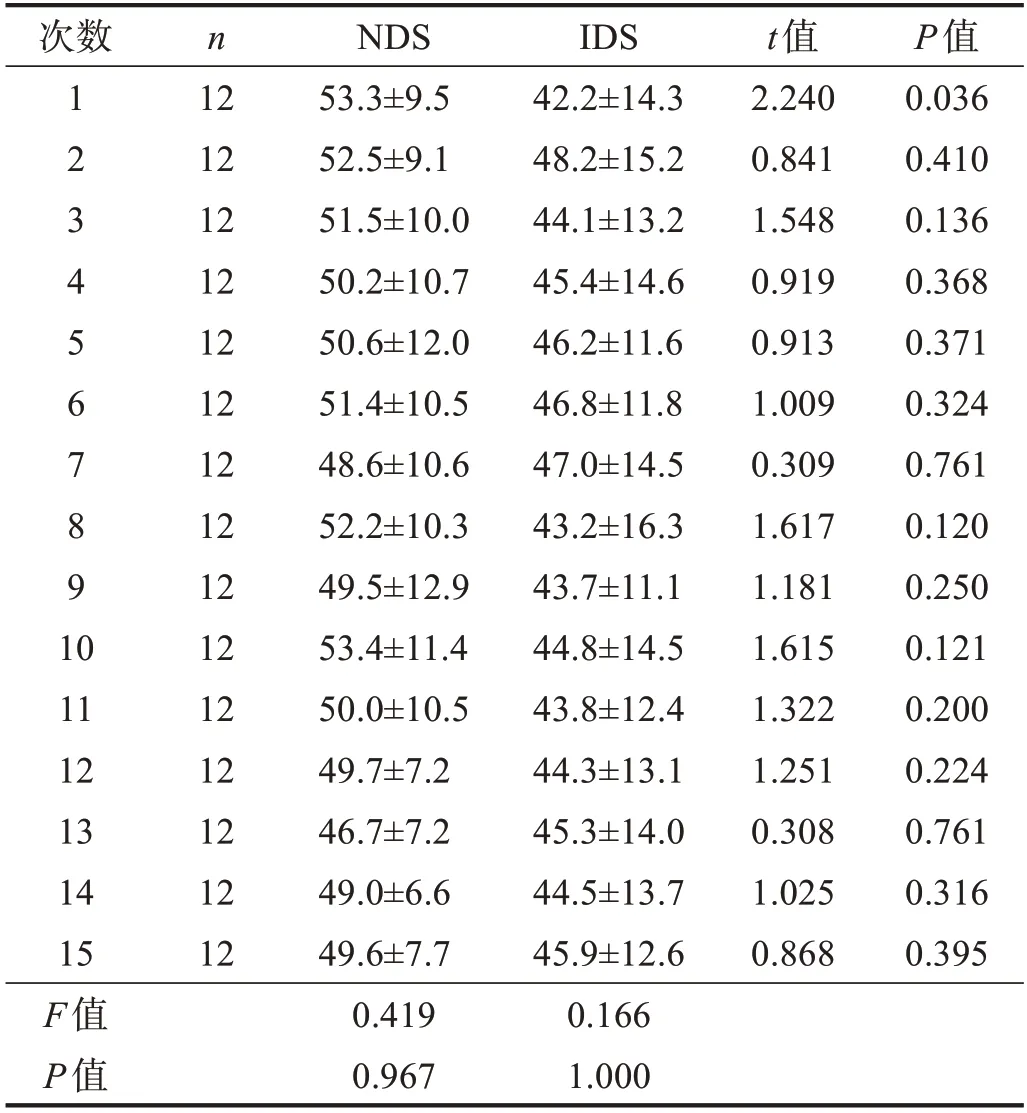
表2 两种条件下15次动力性收缩肌力比较(MVC%)
动力性收缩后,再次测量受试者的最大肌力,NDS 条件和IDS 条件下分别为(201.4±46.3) N、(189.8±43.2) N,试验前为(191.4±36.3) N,三者间无显著性差异(F=0.267,P=0.767)。
两种条件下,指屈肌sEMG 振幅都明显高于指伸肌(P<0.01);IDS 条件下指屈肌sEMG 振幅显著高于NDS条件下(P<0.001)。见表3。
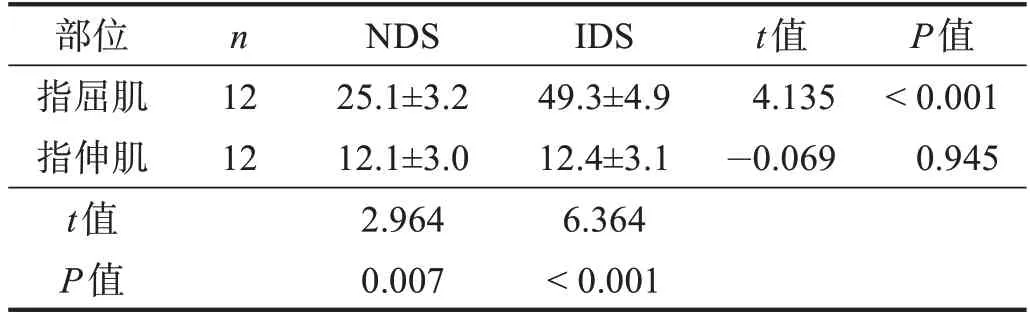
表3 两种条件下动力性收缩指屈肌和指伸肌sEMG振幅比较(%)
2.3 CMC
右手屈指运动主要激活左运动皮质区,在IDS 条件下CMC 高于NDS 条件下,且激活面积也更大。见图1。
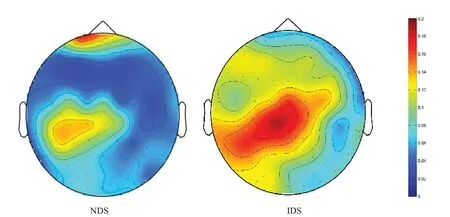
图1 两种条件下动力性收缩CMC的脑地形图
IDS 条件下三个典型电极CMC 均高于DDS 条件下(P<0.05)。见表4。
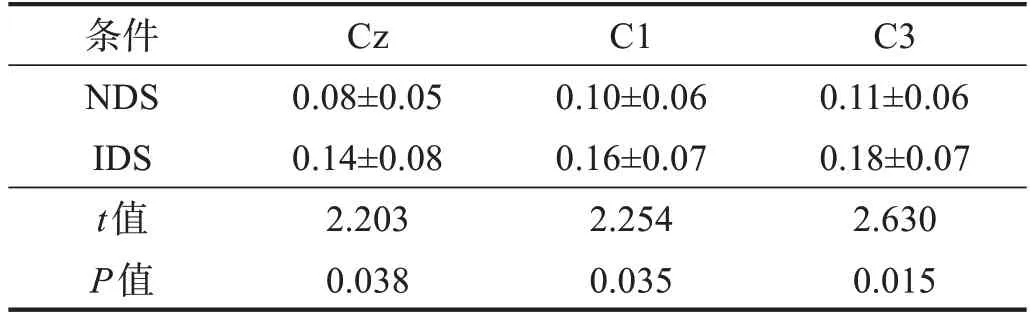
表4 两种条件下运动皮质区相关电极CMC比较
3 讨论
本研究显示,健康人在IDS 条件下行屈指运动时,在静力性和动力性任务中,大脑对前臂肌群采用不同的神经支配策略;当指屈肌肌力不足以完成运动任务时,大脑运动皮质区通过代偿性激活更多皮质参与活动,且大脑与所控制肌肉间的功能性联系增强。
与NDS 条件相比,IDS 条件下行最大静力性屈指运动时,指屈肌sEMG 振幅有增加的趋势,但无显著性差异,可能与肌电振幅受个体差异影响有关。但在IDS 条件下,指屈肌与指伸肌差值更大,提示指屈肌sEMG 振幅增加,同时作为拮抗肌的指伸肌sEMG 振幅下降。Carr等[13]和Hinks 等[14]认为,这可能表示IDS条件下大脑运动中枢发出更多冲动,进而激活更多主动肌运动单位,同时抑制拮抗肌的激活水平。我们前期研究表明[15-16],在IDS 条件下,大脑提高神经元的兴奋性,同时动员更多运动皮质区神经元参与活动。
除sEMG 振幅外,IDS 时,sEMG 频率成分下降,可能与运动单位放电频率降低有关。廖志平等[17]发现,桥式运动时,脑卒中患者患侧竖脊肌和多裂肌sEMG 中位频率低于健侧,与本研究IDS 时sEMG 频域特征表现一致。
在动力性收缩过程中,两种条件下,指屈肌sEMG 振幅都高于指伸肌,与静力性收缩过程的激活特征不同。在动力性运动中,为产生环节运动,主动肌募集的运动单位比拮抗肌多。脑卒中患者因上运动神经元损伤,对下运动神经元的支配异常,表现为主动肌和拮抗肌协调性失调,不能准确和稳定地完成动作[1]。Kamper 等[3]发现,慢性偏瘫患者动力性伸指运动中,伸指肌力降低;指屈肌和指伸肌共同激活以及指伸肌自发兴奋性降低可能是导致肌力下降的原因。Chuang等[18]也发现,脑卒中患者肘关节进行动力性屈曲运动时,运动异常是由于拮抗肌(肱三头肌)活动水平过高所致。
本研究使用CMC 评价大脑运动中枢对相关肌肉的控制。CMC 能揭示运动过程中皮质-肌肉的耦联关系[10]。本研究显示,动力性收缩时,高CMC γ 波主要分布在对侧半球感觉运动皮质区。von Tscharner 等[19]发现,在动力性收缩且需要高度注意力的运动中,大脑呈现显著的γ 波段CMC。而在IDS 条件下执行运动任务时,CMC 增高,激活区面积增大,这可能是由于任务难度增加,需要额外皮质代偿。Guo等[20]发现,慢性脑卒中患者在执行伸指运动时,感觉运动皮质区与指伸肌和指屈肌的CMC 显著低于正常人,提示皮质损伤后对肢体运动的控制能力减弱。Larsen 等[21]发现,脑卒中患者皮质与手运动肌之间的CMC 下降,在康复后期CMC 上升,提示随着脑功能恢复,皮质对肌肉的控制能力增强。Ruiz-Gonzalez 等[22]认为,CMC 能评价小脑共济失调患者指和腕屈曲动作的功能异常。本研究发现,在IDS 条件下,激活的脑区在原有基础上,有向顶、额及同侧运动皮质区扩散的趋势,提示大脑启用邻近皮质区进行补偿。
综上所述,本研究发现,人体在IDS 条件下完成屈指运动时,大脑会采用一些特殊的神经控制策略。本研究中的技术方法可为运动功能障碍患者的临床康复评价提供一些参考。但本研究以健康人为研究对象,结论是否适用于不同疾病患者还有待进一步研究。
利益冲突声明:所有作者声明不存在利益冲突。

