白及化学成分、药理作用和白及多糖提取工艺的研究进展
孔伟华,徐建波,崔琦,盛振华,袁强,张春椿,李石清*
(1.浙江中医药大学药学院,浙江 杭州 310053;2.浙江中医药大学中医药科学院,浙江 杭州 310053)
白及,别名白及子、白及粉等,属多年生陆地兰科草本植物,多分布于我国西南三省地区山野、山谷等比较潮湿的地方,另外在东南沿海的安徽、浙江、江苏等地也有少量分布。野生白及在全球分布较少,除我国外,仅见于日本、朝鲜半岛及缅甸等。白及性微寒,味苦、甘、涩,归肺、肝、胃经,收敛止血,消肿生肌,多用于外伤出血、吐血、咯血、疮疡肿毒、皮肤皲裂等,应用前景良好。为进一步研究白及,开发新药,为临床应用创新等方面提供科学依据,本文从化学成分、药理作用和其主要活性成分白及多糖(Bletilla striata polysaccharide,BSP)的提取工艺三个方面对白及的研究进展进行了综述。发现,白及的主要化学成分有氨基酸、螺环烷甾类皂苷、联苄衍生物、联苄类、类胡萝卜素、二氢菲呋喃类、糖苷、菲类、蒽醌类等;主要发挥了止血、免疫调节、促进伤口愈合、抗菌、抗炎、抗肿瘤、抗氧化、抗溃疡、促进造血、抗病毒等药理活性;以传统回流提取法为主的溶剂提取法在BSP提取纯化中应用最广,超声法、微波法、酶法等也有一定的应用。
1 化学成分
1.1 氨基酸
吴德喜等[1]通过氨基酸自动分析仪,按照GB/T5009.124—2003 的方法检测云南昆明不同药店的野生白及A、B和样品白及假鳞茎中的氨基酸含量,结果如表1所示。根据测定结果来看,白及中含有18种总氨基酸,17种游离氨基酸,但是并没有胱氨酸、蛋氨酸和脯氨酸存在的迹象。研究推定,人工种植的白及由于追求最大化的产量,导致使其生长过快,而自然状态下生长缓慢,其氨基酸含量明显较人工种植的白及高。
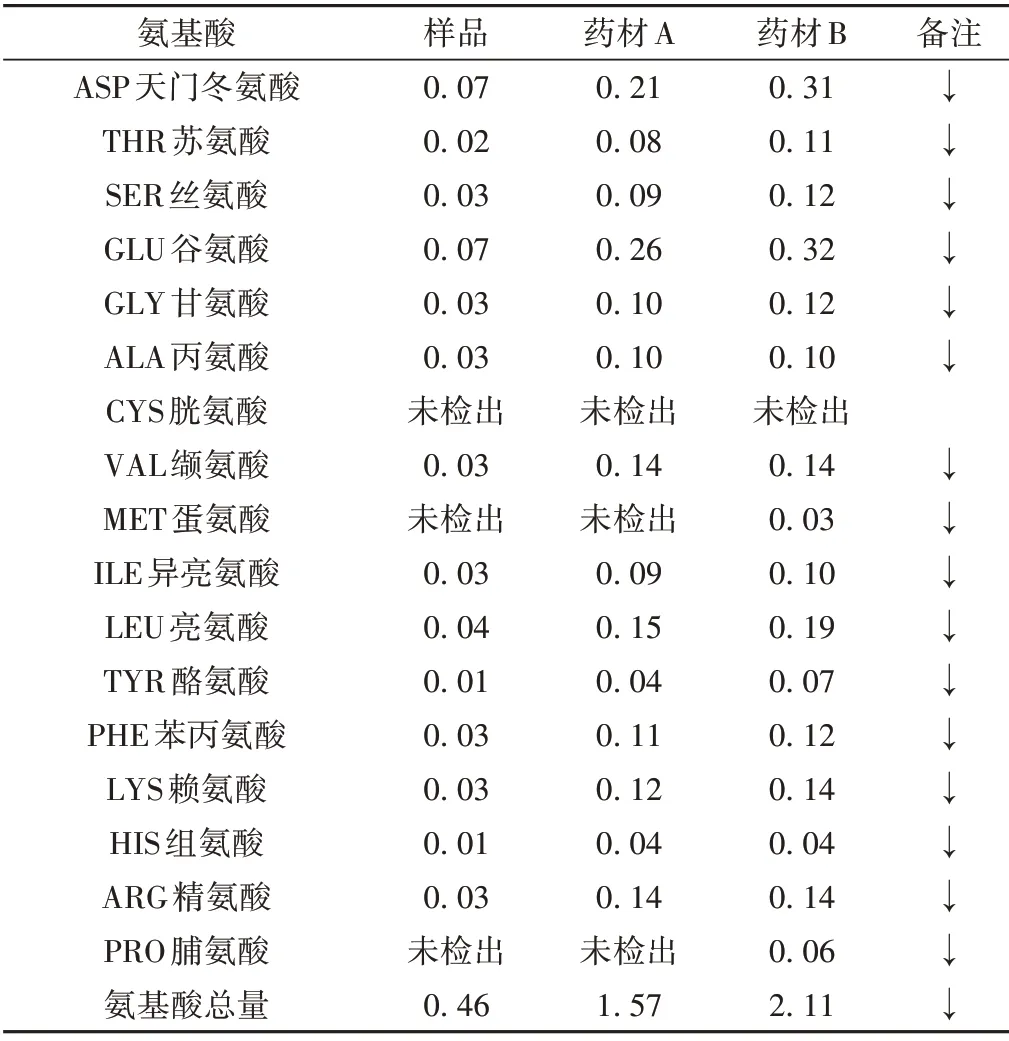
表1 氨基酸测定结果比较
1.2 螺环烷甾类皂苷
WANG 等[2]在白及中发现了4 个新的螺环烷甾类皂苷:(1α,3α)-1-O-[(β-D 吡喃并吡喃糖基-(1→2)-α-L鼠李糖吡喃糖基)]-3-OD-吡喃葡糖基-5α 螺旋体(1),(1α,3α)-1-O-[(β-D-吡喃并吡喃糖基-(1→2)-α-L-鼠李糖吡喃糖基)氧基]-3-OD-吡喃吡喃糖基-25(27)-烯-5α-螺旋素(2),(1α,3α)-1-O-[(β-D-吡喃吡喃糖基-(1→2)-α-L-鼠李糖基吡喃糖基)氧基]-表皮生成素(3)和(1α,3α)-1-O-[(β-D-吡喃糖基-(1→2)-α-L-鼠李糖基吡喃糖基)氧基]-肾上腺皮质激素(4)。在后续的工作中,从白及乙醇提取物中分离出了两种已知的化合物:bletilnoside A(5)和3-O-β-D-吡喃葡萄糖基-3-epi-neususcogenin(6),结构图见图1。同时在体外测试了分离的化合物对7 种肿瘤细胞系的细胞毒性、对环氧化酶1、2(Cox-1、Cox-2)的抗炎活性以及止血活性。实验结果显示化合物1~4和6 对所有测试的肿瘤细胞系均表现出显著的细胞毒性,同时化合物1~6均显示出止血活性。
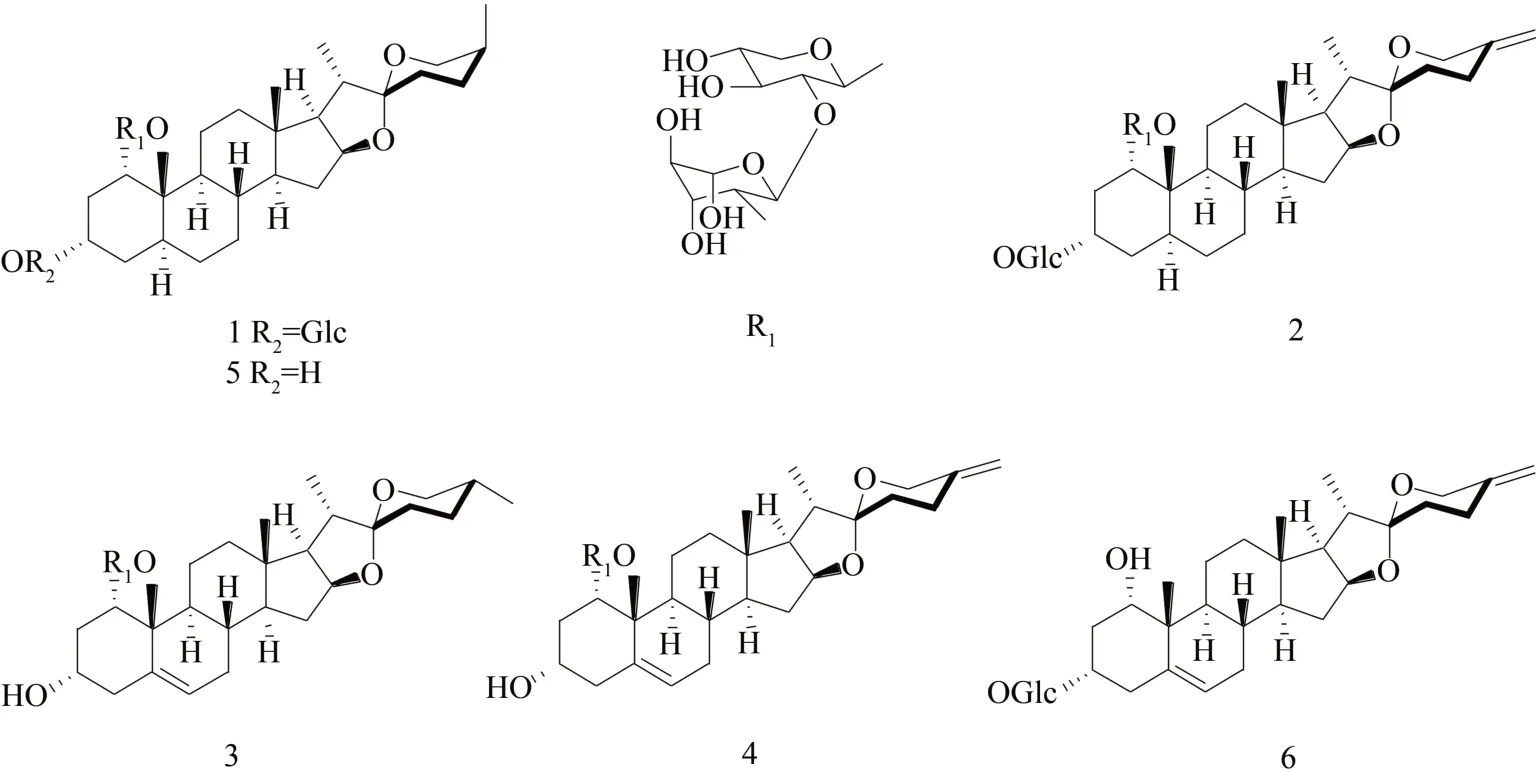
图1 螺环烷甾类皂苷结构式
1.3 联苄衍生物
JIANG 等[3]从白及的根茎中分离出10种先前未描述的联苄衍生物Bletistrins A~J,其中有5 个手性化合物在脂肪族联苄桥上有-OH 取代,另外还有12 种已知的联苄衍生物。他们应用NMR 得到了1D 与2D NMR 数据,经过分析后阐明了Bletistrins A~J的结构,并且通过电子圆二色性(electrostatic circular dichroism,ECD)光谱分析和旋光度值确定了Bletistrins A、D、F、H 和I 的绝对构型。分离出来的联苄衍生物的结构见图2。
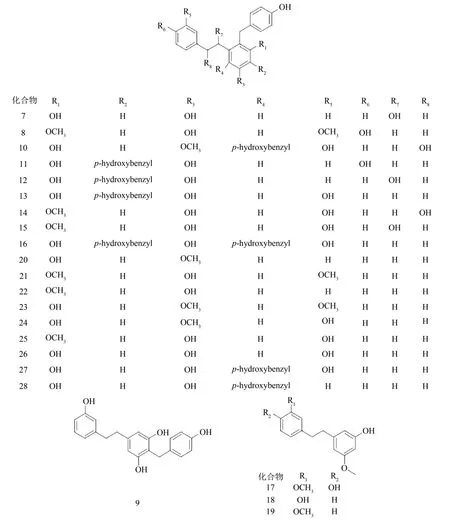
图2 联苄衍生物Bletistrins结构式
JIANG 等[4]从白及块根中发现3 种新的联苄衍生物,应用了NMR 光谱,新化合物的结构经由1D 与2D NMR数据的分析得到阐明。除此之外在白及块根中还发现了18种已知的化合物,所有化合物的结构见图3。
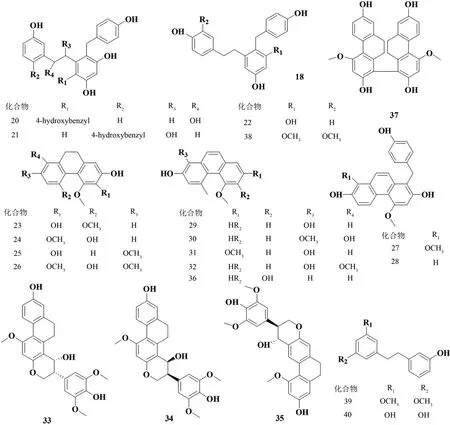
图3 联苄衍生物结构式
1.4 联苄类
LI 等[5]通过各种色谱技术分离乙酸乙酯(EtOAc)萃取液,从黄花白及根茎中发现了10 种新发现的等聚联苄基(41~46)和菲(47~50)以及11 种已知的天然产物,新发现的化合物中包括了6 种联苄类化合物和4 种菲衍生物。分离出的化合物的结构表征通过光谱分析得到了阐明。见图4。
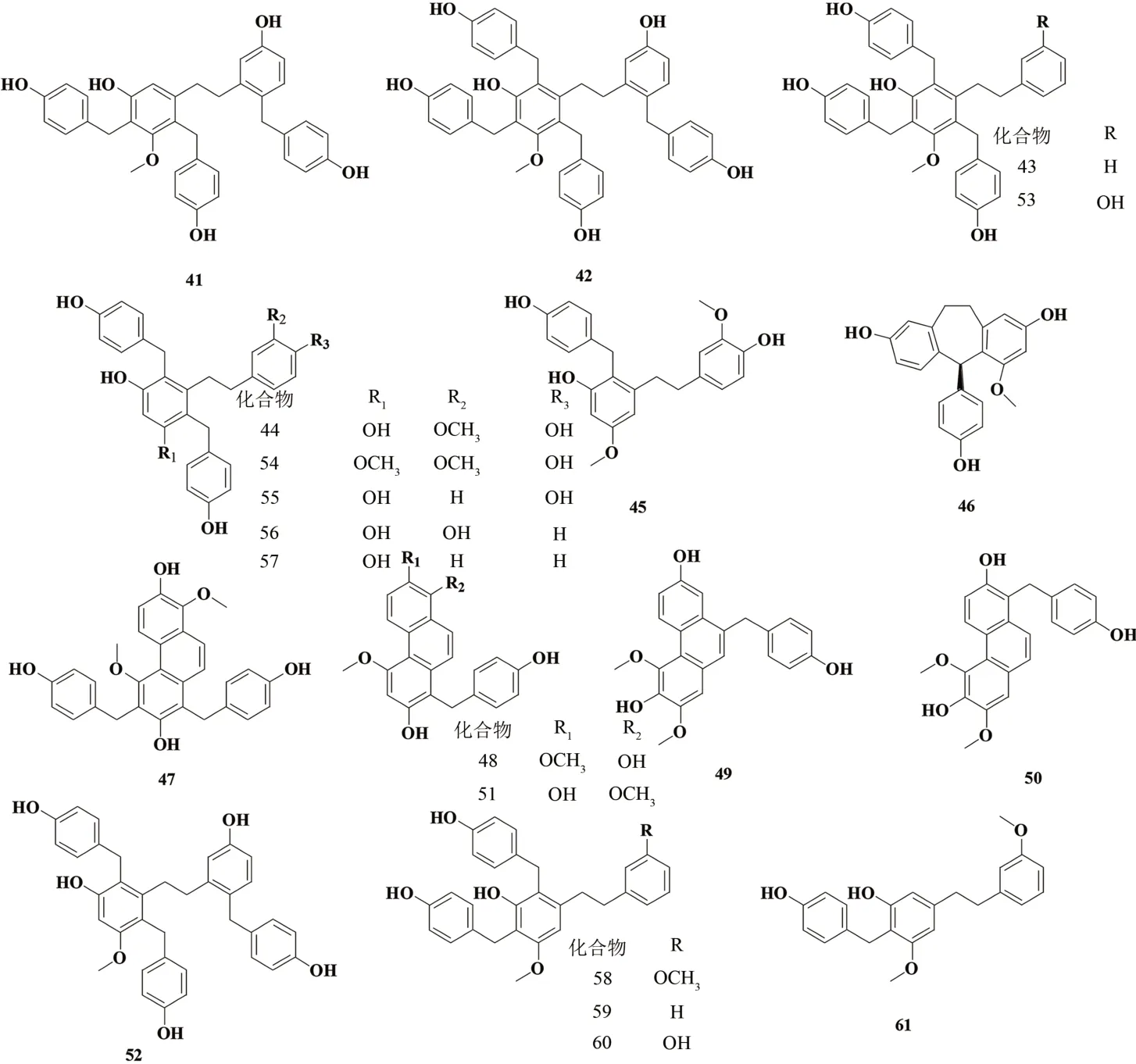
图4 6种联苄类化合物和4种菲类衍生物结构式
1.5 类胡萝卜素
KANG 等[6]在白及中分离出来了两种新的类胡萝卜素(62,63),这两种类胡萝卜素的结构经由分析光谱数据得到了阐明,见图5。
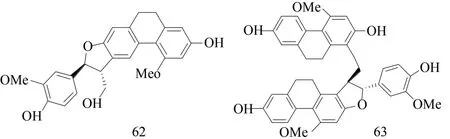
图5 两种新的类胡萝卜素结构式
1.6 糖苷
ZHAO 等[7]从白及块根中分离出了1 种新的糖苷Bletilloside A(64),此糖苷的结构通过广泛的光谱分析得到了确定。见图6。
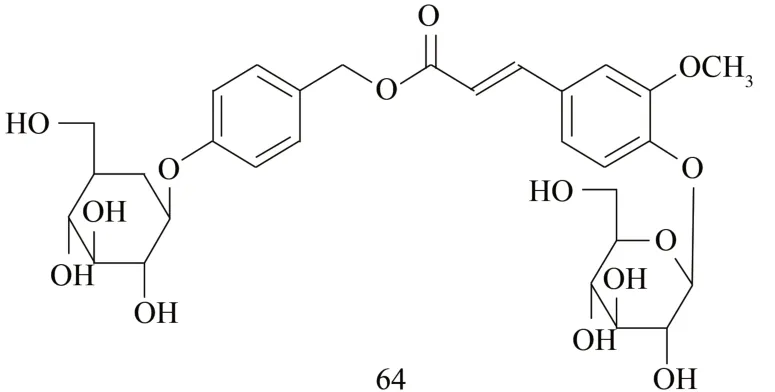
图6 新的糖苷Bletilloside A 结构式
1.7 蒽醌类
SUN 等[8]从白及中分离出了两种具有抗癌活性的新蒽醌,分别是7-羟基-2-甲氧基菲-3,4-二酮(65)和3′,7′,7-三羟基-2,2′,4′-三甲氧基-[1,8′-联菲]-3,4-二酮(66),结构见图7。这些化合物对人类癌细胞系具有很强的抗增殖作用,并会在作用于A549细胞24 h后,诱导产生活性氧(ROS)。对A549细胞系进行细胞周期分析,结果表明化合物65和66能诱导G0/G1 期停滞,并伴有S 期减少。这些结果证明了ROS的产生可导致癌细胞凋亡,表明了化合物65和66是体外和体内治疗癌症的良好候选者,未来的研究应基于这两种化合物的精确分子作用机制进行研究。
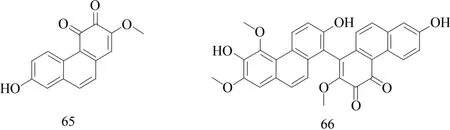
图7 两个新蒽醌结构式
1.8 二氢菲呋喃类
LI 等[9]从黄花白及的根茎中分离得到了4 种新的二氢菲呋喃类化合物(67~70),以及21 种已知化合物,包括了菲类衍生物(71~80)和联苄类化合物(81~91)。他们结合了1D/2D NMR 技术和基于经验螺旋度规则的ECD 光谱,确定了这些分离物的化学结构见图8。他们还通过MTS 分析评估了所有化合物对HL-60、SMMC-7721、A-549、MCF-7 和SW480 人癌细胞系的细胞毒性和在脂多糖(LPS)刺激的RAW 264.7巨噬细胞中产生一氧化氮(NO)的抗炎活性。根据细胞毒性测定结果表明,大多数化合物对5 种肿瘤细胞系均具有细胞毒活性。其中,化合物67 对HL-60、A-549 和MCF-7 表现出最强的活性,IC50值为(0.24±0.03)~(3.51±0.09)μmol/L。抗炎试验表明,化合物76 的IC50为(2.86 ± 0.17)μmol/L,在RAW 264.7巨噬细胞中表现出最大的抗NO活性。
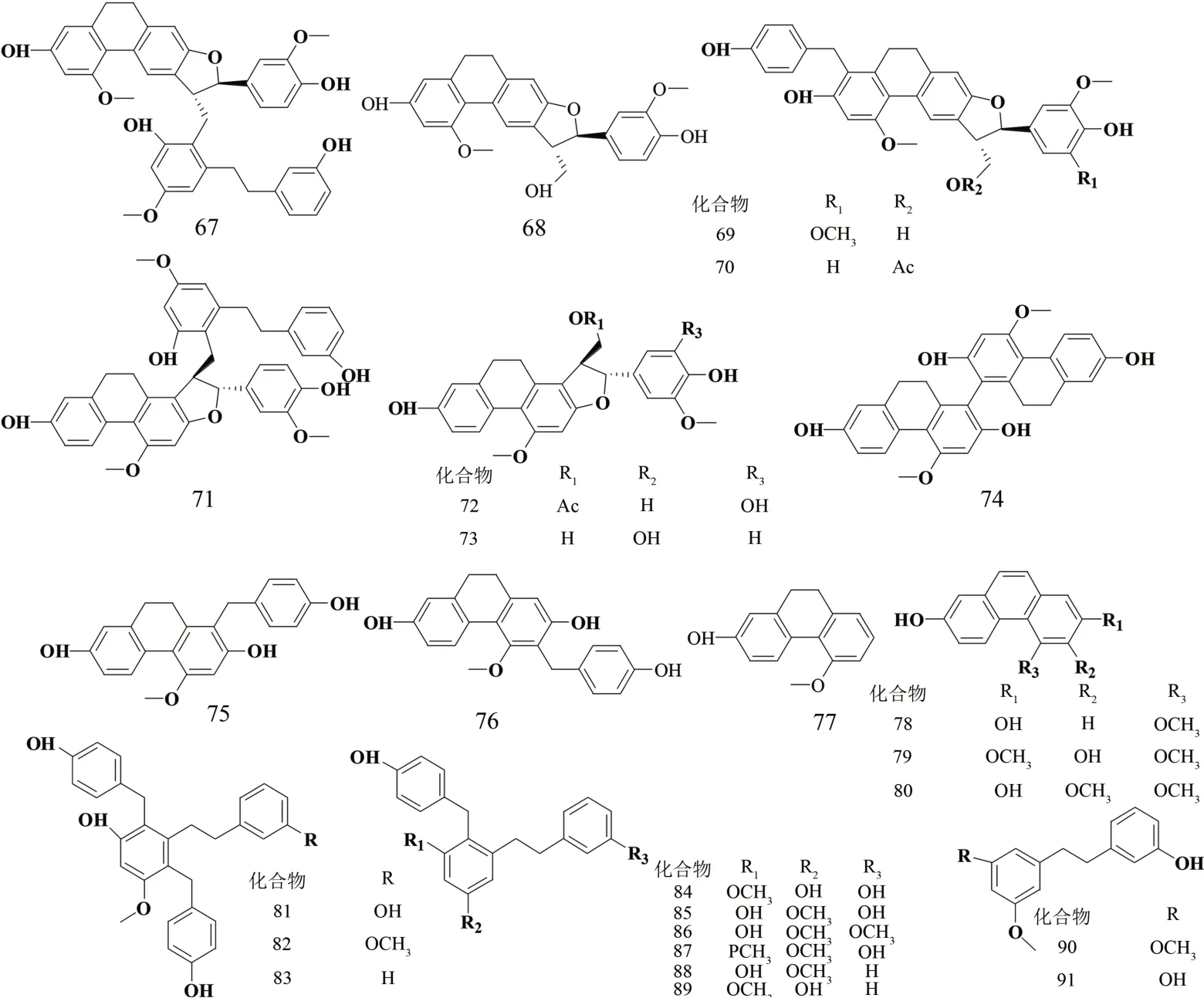
图8 氢菲呋喃类化合物结构式
1.9 菲类
SHI等[10]从药用植物白及中分离并鉴定了12种菲类化合物。他们将与病毒混合的菲类化合物通过尿囊途径接种到鸡蛋中,以观察在其体内的抗病毒活性,并且通过血凝抑制试验研究菲类化合物对病毒受体的阻断作用,病毒释放的作用通过神经氨酸酶(NA)抑制试验进行评估。实验结果表明与菲类化合物92、100、101和103相比,菲类化合物93~99和102具有更强的抑制活性,结构见图9。
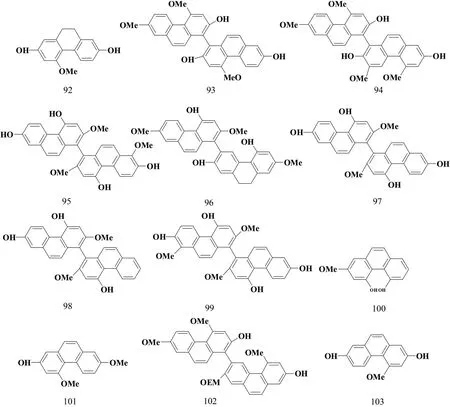
图9 菲类化合物结构式(1)
QIAN 等[11]从白及须根中分离出4 种新的9′,10′-二氢联菲,包括新发现的1,2′-联联菲,4,7,3′,5′-四甲氧基-9′,10′-二氢1,2′-联菲-2,7′-二醇(104),一种新的1,3′-连接的联菲:4,7,7′-三甲氧基-9′,10′-二氢1,3′-联菲-2,2′,5′-三醇(105)和两个新的1,1′-联苯菲:4,7,4′-三甲氧基-9′,10′-二氢1,1′-联菲-2,2′,7′-三醇(106)和4,7,3′,5′-四甲氧基-9′,10′-二氢1,1′-联菲-2,2′,7′-三醇(107)。他们通过这些化合物的手性光学性质和HF/3-21G 水平的势能表面扫描,同时考虑了这些化合物的对映异构性,从而揭示了它们的外消旋混合物形式。XIAO等[12]在白及块茎中新发现了1-对羟基苄基-4,7-二甲氧基菲-2-醇(108),1-对羟基苄基-4,7-二甲氧基菲-2,8-二醇(109)和1-对羟基苄基-4,7-二甲氧基菲-2,6-二醇(110)。结构见图10。
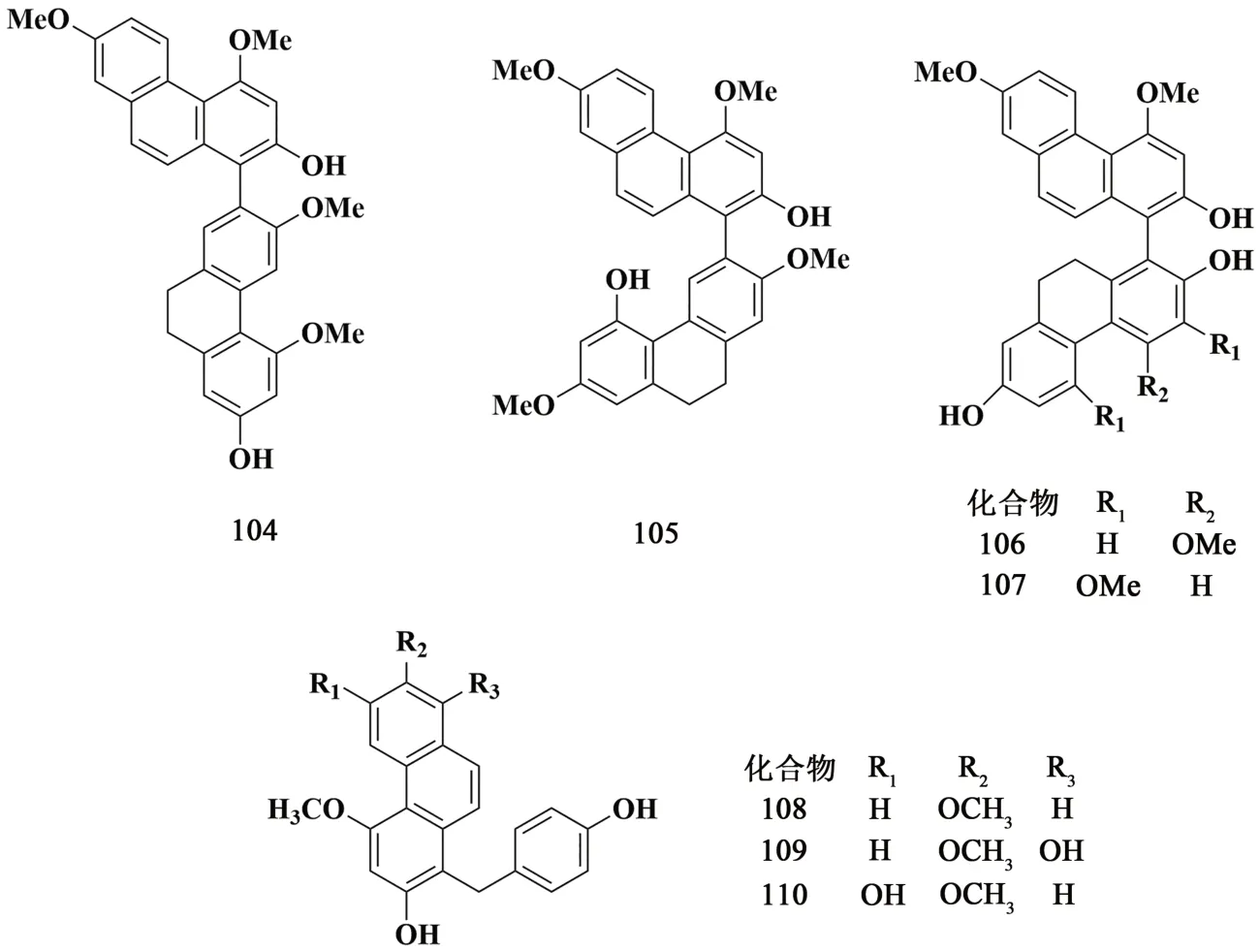
图10 菲类化合物结构式(2)
2 药理作用
2.1 止血作用
白及中以BSP 为主的活性成分具有止血作用,其机制可能是通过激活P2Y1 和PKC 受体来激活ADP 受体信号通路,导致血小板的变形、聚集和分泌,从而发挥其止血作用[13]。此外,白及多糖/氧化石墨烯复合海绵具有高孔隙率海绵结构,吸收血液速度快,因其带有高表面电荷,可以激活血小板,促进纤维蛋白形成,故可作为一种安全、有效、低成本的止血剂[14]。
2.2 免疫调节作用
WANG 等[15]从白及块茎中分离纯化出了BSP-1 和BSP-2两种水溶性多糖,其中BSP-1以摩尔比4∶1的甘露糖和葡萄糖组成。根据体内实验结果得出,BSP-1可以抑制免疫调节活性,表现为胸腺和脾脏相关指数的增加。
研究发现,BSP能通过影响LPS促进B淋巴细胞的增殖,同时促进刀豆蛋白(Con A)诱导T 淋巴细胞的增殖,对小鼠的特异性免疫和非特异性免疫都有显著的增强效果[16];还可使小鼠体内天冬氨酸氨基转移酶(AST)和血清丙氨酸氨基转移酶(ALT)的活性降低;同时通过影响Con A,抑制肝脏酶活性的升高,保护肝脏,缓解Con A导致的免疫性肝损伤[17];对于环磷酰胺造成的小鼠免疫功能低下、吞噬指数降低的情况有显著的抑制效果,并且因其对LPS 和Con A 的作用,可提升二者的促脾细胞增殖能力[18]。白及水提物还能提高虹鳟外周血白细胞的氧呼吸爆发活性和吞噬活性[19]。
2.3 促进伤口愈合作用
BSP能诱导肌腱细胞的增殖,同时诱导羟色胺迁移,增加细胞外基质胶原蛋白Ⅰ和Ⅲ的分泌,促进肌腱愈合,该功能通过激活PI3K/Akt和MEK/ERK1/2信号通路实现[20]。另外,BSP提取后的残液可以促进烧伤后皮肤的再生,这可能是通过抗氧化、抗感染和减少伤口面积实现的。其中酚类成分能减少瘢痕形成和增强血管生成[21]。白及多糖精片可以加速乙酸诱导的兔口腔溃疡的伤口愈合[22]。
白及多糖水凝胶也可以作为一种敷料,促进伤口愈合,如Bsp/CMC/CBM 940多糖水凝胶,结合了BSP和羧甲基纤维素,对羟自由基具有显著的清除效果,从而促进伤口愈合[23]。由壳聚糖-氧化BSP和壳聚糖-银组成的双层敷料分别与京尼平交联作为下层和上层的双层海绵也可以作为伤口修复的理想敷料[24]。
2.4 抗菌作用
白及中的联苄衍生物有显著的抗菌作用。研究表明,从白及中分离出的联苄衍生物能明显抑制金黄色葡萄球菌ATCC 6538、枯草芽孢杆菌ATCC 6051 和耐甲氧西林金黄色葡萄球菌ATCC 43300的活性,其可抑制的菌群包括了革兰氏阳性菌和革兰氏阴性菌[3-4]。
2.5 抗炎作用
提取分离自黄花白及块茎中的菲类化合物可以抑制LPS刺激下的巨噬细胞中NO的产生[7]。BSP能通过TLR2途径抑制血管紧张素诱导的ROS的产生,同时抑制肿瘤坏死因子和促炎细胞因子白细胞介素6 的活化,降低血管紧张素诱导的Toll 样受体2(TLR2)的表达,这一作用通过TLR2/MyD88 途径,在血管紧张素诱导的高迁移率族蛋白细胞中表现出显著的抗炎活性[25]。此外,BSP对COX-2也有选择性抑制作用[2]。
2.6 抗肿瘤作用
BSP能刺激荷瘤小鼠脾脏中CD4+T细胞的扩增,从而起到显著的肿瘤异种移植物的生长抑制作用[26]。BSP 也有一定的抑制人肝肿瘤细胞HepG2 增殖的作用,可以显著抑制荷瘤小鼠的瘤质量,同时可能刺激胸腺和脾脏产生免疫细胞,提高小鼠免疫功能[27]。阿仑膦酸盐(ALN)与BSP 共同形成ALN-BSP 偶联物,对巨噬细胞起到凋亡诱导作用。ALN-BSP 偶联物具有显著的对肿瘤相关巨噬细胞的消除作用,且具有特异性,同时可抑制血管的形成、恢复机体内局部的免疫监视机制,能够安全有效地抑制肿瘤[28]。白及中的二氢菲呋喃和芪类化合物对多种人癌细胞系具有细胞毒活性[5,7]。
同时,BSP 能靶向地向肿瘤部位递送药物,且具有选择性[29]。如叶酸介导的硬脂酸修饰白及多糖(FABSP-SA)共聚物能借助叶酸受体介导的内吞作用和网格蛋白机制,作为载体向肿瘤部位递送药物,增强抗肿瘤效果[30]。在FA-BSP-SA 胶束中添加d-α 琥珀酸生育酚聚乙二醇酯(TPGS)可促进阿霉素对4T1 细胞的协同抗肿瘤作用,该混合胶束是一种潜在载体[31]。
2.7 抗氧化作用
体外抗氧化活性也是BSP 具有的显著的作用之一[32]。白及多糖b 是一种新的从白及中分离得到的水溶性多糖,能剂量依赖性地抑制血管紧张素诱导的ROS的产生,有效阻断还原型辅酶Ⅱ氧化酶的上调[25]。
CHEN 等[33]从白及根中分离出一种新的多糖成分(pFSP),组成单元为D-甘露糖、D-半乳糖和D-葡萄糖,pFSP 对超氧自由基以及DPPH 都表现出显著的清除作用,且强于BSP,具有作为抗氧化剂的潜力。
2.8 抗溃疡作用
BSP能抑制MAPK/NF-κB信号通路的活性,通过减轻氧化应激、中性粒细胞浸润和炎症细胞因子的积累来保护乙醇诱导的大鼠急性胃黏膜损伤;此外,BSP可以促进酸性黏液的产生,促进内源性前列腺素E2的产生,保护胃黏膜免受乙醇损伤[34]。
体外实验证明,BSP 具有保护经乙醇诱导损伤的人胃黏膜细胞GES-1 的作用,且效果显著,其机制可能是提高了谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶等抗氧化酶的活性,从而减少氧化产物(过氧化脂质、丙二醛),调节基因转录(血红素氧合酶-1、PGC-1α、Bcl-2、Bax、NF-κB)[35]。
BSP 还可以作为一种良好的生物粘附材料。添加BSP 增加了可溶性淀粉微球的流动性,降低了其刚性。与BSP混合后,水杨酸基质的溶胀性、黏蛋白吸附能力和在胃黏膜上的滞留率均有所提高,在微球系统中混合的水杨酸-白及多糖具有较强的黏膜粘附性,在胃中的停留时间比水杨酸微球长得多,是开发胃滞留给药系统的潜在药物载体[36]。
2.9 促进造血作用
BSP 能促进小鼠脾集落形成细胞,恢复骨髓有核细胞,从而改善骨髓造血功能,使外周血白细胞有所增加,抵抗环磷酰胺对脾细胞造血功能的损伤,促进造血[18]。
2.10 抗病毒作用
从白及中分离出的菲类化合物在体内有明显的病毒抑制作用,能减少病毒基质蛋白基因转录,具有较强的抗流感病毒活性。其中联菲比单菲化合物具有更强的抑制活性,可能是因为羟基影响了化合物的亲水性/疏水性,其机制还需进一步深入研究[9]。
3 白及多糖的提取工艺
BSP 有较显著的生物活性。随着提取技术的发展,不断有新的BSP提取工艺出现,除了传统回流法及其优化工艺,现代提取技术如超声、微波等也应用较广。
3.1 传统提取方法
现有研究中,最常采用回流提取等溶剂法提取BSP,其他传统方式还包括浸提法、煎煮法等。此种方法常使用热水提取、水提醇沉以达到较好的提取效果,但溶剂用量较大,且高温可能使BSP 有一定的损失。程安媛等[37]提取BSP 使用的是浸渍法,提取前先进行预处理,用10 倍蒸馏水浸渍提取白及颗粒,使水温保持在70 ℃,浸渍30 min,重复3次后用有机溶剂精制处理提取液,获得BSP 含量63.7%,收率13.8%。刘光斌等[38]提取BSP采用的是煎煮法,煎煮之前进行预处理,浸泡药材24 h。为了进行吸附澄清精制,加入了一定量的天然澄清剂(Ⅱ型ZTC1+1)。提取得到BSP 的含量为44.4%,乙醇用量比常规煎煮法更少,且澄清剂无残留。董建新等[39]采取在100 ℃下回流提取3 h 的方法,采用1∶34(g∶mL)的料液比,85%的乙醇浓度,醇胶采取8∶1(g∶g)的比例,醇沉6 h 的情况下,BSP 提取率为26.44%。陈美君[40]取白及粉末回流提取2 h,醇沉,得到的BSP 平均含量为63.832%。同时考察了醇提水提法,与水提醇沉法相比较,所得多糖含量相近,但此法重复性较差。孙达峰等[41]采用连续逆流提取法提取BSP,以1∶14 的料液比在60 ℃下提取3 h,BSP 得率为90.5%。
3.2 超声提取法
通过空化效应来达到提取效果的超声提取法,一般无需采用高温,降低了对所需成分的损耗,起到快速而高效的提取作用。吴梦晴[42]取用干燥的白及块茎为材料,应用了超声波提取法,提取其中的BSP,控制料液比为1∶35(g∶mL),在400 W 的超声功率下提取50 min,得到BSP 的提取率为(8.18 ± 0.04)%。刘煜等[43]取用白及粉末为原材料,采用表面活性剂辅助超声法提取BSP,表面活性剂优选结果为聚乙二醇(PEG)系列的PEG-400,其用量为0.1 g,料液比采用1∶30(g∶mL),超声功率为126 W 的提取工艺下,提取80 min,获得BSP的最大得率为21.81%。
3.3 微波提取法
微波提取法利用了微波穿透和加热的特点,其优点有操作简便、能耗低、提取成分纯度高、快速而高效等。韩伟等[44]利用表面活性剂辅助微波提取白及根茎中的BSP,以BSP 得率为指标优化工艺,最佳提取工艺为使用浓度为5 g/L 的PEG-400,液料比为63 mL/g,并调节溶液pH 值为7,在504 W 的功率下提取5 min。通过此工艺,白及总多糖的得率为(32.48 ± 0.18)%。宋志姣等[45]以粗BSP 提取率为指标,采用小白及假鳞茎为材料提取BSP,优化工艺条件,在40%额定微波功率下微波50 s,在60 ℃下浸提90 min,最终BSP 的得率为38.33%。
3.4 酶辅助提取法
酶法提取适用于植物中成分的提取,采用此法BSP 的得率较高,纯度较好。孔俊豪等[46]利用木瓜蛋白酶提取纯化了BSP,最佳工艺为调pH 值到7.0~7.5,每克底物加入8~10 mg 的木瓜蛋白酶,在45~50 ℃下作用120~150 min,BSP 得率可以达到92%。与常规水提相比纯度更高。雷燕妮等[47]采用植物蛋白酶解法获得BSP,并筛选了最优的提取条件,即加10倍量的水,设置55 ℃超声提取2次,每次时间为1 h,植物蛋白酶添加量3‰(W/V),将温度保持为45 ℃,搅拌3 h 进行酶解。朱富成等[48]采用果胶酶辅助法提取BSP,经过优化,得出最佳的果胶酶添加量为12%,在52 ℃下酶解82 min,此法获得BSP的提取率为64.8%。
3.5 其他
QU 等[32]通过红外辅助水提白及得到BSP,液料比采用53 mL/g,在75 ℃下提取2.5 h,BSP 得率为(43.95±0.26)%,该方法不需要复杂的操作,成本低。蔡锦源等[49]采用超声波与微波相协提取的方法,以BSP得率为指标,采用1∶20(g∶mL)的料液比,浸泡360 s,设定微波功率为200 W,进行30 s 的提取,最终得到的BSP 得率为(6.98±0.19)%。此后蔡锦源等[50]又研究先以微波预处理白及,再进行超声提取的工艺,同样以BSP 得率为指标,具体的优化条件为按4∶1(mL∶g)的解析剂比加蒸馏水,微波预处理90 s,按1∶25(g∶mL)的料液比,100 W 超声提取20 min,得率达到7.081%。经过对比研究,结果证明进行了微波预处理的提取效果比单纯的超声波提取更好。
4 总结和展望
白及是我国重要的中药资源,其化学成分已被证实有糖、联苄类、联苄衍生物、菲类、二氧菲类、二氢菲呋喃类、联菲类、双菲醚类、甾体、三萜等;主要有止血、免疫调节、促进伤口愈合、抗菌、抗炎、抗肿瘤、抗氧化、抗溃疡、促进造血、抗病毒等药理作用。白及各类成分是其丰富的药理作用的主要物质基础,尤其是BSP,具有愈伤、增强免疫、抗炎、抗氧化、抗溃疡等多种药理活性;其提取工艺以水提醇沉的回流提取法为主,超声、微波、酶辅助等提取方法也随着研究的不断深入得到应用与优化。现有的资料为白及进一步的开发利用提供了理论基础。随着现代研究技术的发展,白及的成分、作用机制也将得到更全面和深入的研究与应用。

