辣椒素对氧葡萄糖剥夺/再灌注所致SH-SY5Y细胞损伤的保护作用及机制研究
马世江,沈长波,刘杰,谭军
(新乡医学院第三附属医院,河南 新乡 453003)
世界卫生组织2014年发布的《世界卫生统计报告》显示,全球每年约有670万人死于卒中,卒中是世界第二大致死原因,也是永久性致残的主要原因之一。其中,缺血性卒中占全部卒中事件中的80%~85%[1]。持续的缺血会导致脑组织损伤和坏死,恢复血液供应虽然可以挽救缺血引起的可逆性损伤,但缺血/再灌注的过程同时也会引起脑组织和细胞的额外损伤,这种损伤是由一系列复杂的病理、生理因素导致的[1-2]。目前,能有效治疗卒中的药物很少,寻找新的治疗方法势在必行[3],开发新的神经保护药物对于有效治疗缺血性损伤具有重要意义。
辣椒素(Capsaicin,CAP)是一种酚类化合物(8-methyl-N-vanillyl-6-nonenamide),能选择性地激活无髓鞘C 纤维,已广泛应用于疼痛的研究和治疗中[4]。CAP 可以限制能量摄入,增加能量消耗,诱导胰岛素分泌,降低血压,减少脂质储存和预防动脉粥样硬化病变。此外,CAP还有抗肿瘤活性,能减少过敏性气道炎症和缓解神经源性膀胱症状等作用[5]。
近年来,越来越多的研究表明,CAP对心肌的缺血再灌注(I/R)损伤具有保护作用。在大鼠心脏I/R 模型中,CAP 预处理可显著降低心肌损伤[6-8]。另外,又有积累的证据表明CAP 具有神经保护作用,CAP 可预防哇巴因诱导的大脑兴奋性毒性、蒙古沙鼠全脑缺血、N-甲基-D-天冬氨酸(NMDA)诱导的视网膜神经节细胞丢失以及谷氨酸诱导的皮质神经元损伤等[9-12]。这些研究进一步扩展了CAP 的潜在临床应用。然而,目前对于CAP 神经保护作用的潜在机制研究却很少。在本实验中,笔者通过使用体外神经元培养,检测CAP 对神经元I/R 损伤的直接作用,并对其潜在的分子机制进行研究。
1 材料与方法
1.1 仪器与试剂
辣椒素(Sigma 公司);尼莫地平注射液(青岛金峰制药有限公司);L-NAME,LY294002(Sigma 公司);MTT(北京索莱宝科技有限公司);Hoechst 33342(碧云天生物技术有限公司);LDH检测试剂盒、Caspase-3和Caspase-9活性检测试剂盒(碧云天生物技术研究所);PrimeScript™RT reagent Kitwith gDNA Eraser 反转录试剂盒,TB Green™Premix Ex Taq™Ⅱ实时荧光定量试剂盒(大连宝生物工程有限公司);SpectraMax M3 多功能酶标仪(美国Molecular Devices 公司);LighCAPycler®96实时荧光定量PCR仪(瑞典罗氏公司)。
1.2 细胞培养、细胞分组及氧葡萄糖剥夺/再灌注(OGD/R)损伤实验
SH-SY5Y细胞常规培养于含有10%FBS、100 U/mL青霉素和100 mg/mL 链霉素的DMEM/F12 培养基中,在37 ℃、5% CO2的培养箱中培养,细胞每2~3 d 换液1 次。在后续的实验中,细胞以适当的密度接种在96孔板或6孔板上。
将细胞随机分为6 组:正常组,模型组,尼莫地平组和CAP 低、中、高剂量组。为了模拟体外I/R 条件,除正常组仍常规培养外,对其余5 组SH-SY5Y细胞进行OGD/R 处理。细胞用无葡萄糖Earle 的平衡盐溶液洗涤2 次,将培养基替换为EBSS,然后,将细胞移入含有5% CO2和95% N2的混合气体的培养箱中,37 ℃培养4 h。经过OGD 处理后,换成正常培养基,放入含5% CO2的正常培养箱中再培养24 h。在整个OGD/R 过程中,给予尼莫地平组5 μg/mL 的尼莫地平,分别给予CAP 低、中、高剂量组1、5、25 μmol/L 的CAP。
1.3 细胞活力评估及Hoechst 33342 染色观察凋亡细胞核的形态学变化
将MTT(5 mg/mL,20 μL/孔)添加到96 孔板(约6×103/孔)中作用4 h。然后,将生成的蓝色甲酰胺还原产物(活细胞中的琥珀酸脱氢酶对染料的作用)溶解在150 μL二甲基亚砜中,使用酶标仪在490 nm处读取其吸光度。
细胞接种于6 孔板,分组处理后,吸去培养液,每孔加入4%多聚甲醛0.5 mL,4 ℃固定30 min。吸去固定液,加入PBS 洗涤2 遍,每次3 min,然后把液体吸净。每孔加入Hoechst 33342染色液0.5 mL,避光染色10 min,中间手动晃动数次。之后再用PBS 洗涤2 遍,每次3 min。荧光显微镜下拍照观察。
1.4 LDH漏出检测
当细胞受到OGD/R 损伤时,细胞内的LDH 会迅速释放到培养上清液中。细胞损伤情况用LDH检测试剂盒测定。采集培养的SH-SY5Y 细胞的上清液,3 000 ×g离心10 min,按说明书要求进行处理。在450 nm处检测吸光度。
1.5 Caspase-3、Caspase-9活性检测
使用Caspase-3、Caspase-9 活性检测试剂盒进行检测,严格按说明书要求操作。胰酶消化贴壁细胞,并收集至备用的细胞培养液中。4 ℃,600 ×g离心5 min,收集细胞,小心吸除上清液,PBS 洗涤1 次。每200 万细胞加入100 μL 裂解液,重悬沉淀,冰浴裂解15 min。4 ℃,16 000 ×g离心10 min。把上清转移到冰浴预冷的离心管中。立即测定Caspase-3、Caspase-9的酶活性或-70 ℃保存样品待测。
1.6 实时荧光定量检测Bcl-2、Bax mRNA的表达
使用Trizol 法提取细胞总RNA,紫外分光光度计测定A260 和A280,计算RNA 浓度。逆转录试剂盒将RNA 逆转录成cDNA。使用荧光定量TB Green™Premix Ex Taq ™Ⅱ试剂盒进行实时荧光定量PCR 反应。 引物序列为:Bax 上游为5′ -AGCGACTGATGCAGCCTGCAGT-3′,下游为5′ -CCAGAGCCCACAGTCAGTTCCAG-3′;Bcl-2 上游为5′-ATGTGTGTGGAGAGCGCAGAA -3′,下游为5′-ACAGTCAPCACAAAGGCACAPC-3′;β-actin 上游为5′-AGCGAGCACAGCCCCAAAGTT-3′,下游为5′-GGGCACGAAGGCCAGACAGATT-3′。反应条件如下:先95 ℃30 s预变性,随后95 ℃5 s,60 ℃20 s,共循环40次。按照2-△△Ct法计算各基因的相对表达量。
1.7 基于网络药理学探讨CAP 治疗缺血性卒中的潜在分子作用机制
1.7.1 CAP 潜在作用靶点及缺血性卒中相关靶点的筛选
分别采用TCMSP、drug bank、DGldb、CTD 和Swiss target prediction 数据库检索及预测CAP 的靶点。将靶点合并,用Uniprot 数据库将蛋白质名称转变为基因名称,去除重复的靶点。
以cerebral ischemic stroke 和cerebral infarction 作为关键词搜索drug bank、OMIM、GENE CARD、Disgenet和TTD 数据库获得缺血性卒中相关靶点,选择人源靶点,将所有靶点合并,去除重复靶点。
1.7.2 CAP 抗缺血性卒中作用靶点的获得及功能富集分析
将缺血性卒中疾病相关靶点和CAP 潜在靶点取交集,得出药物和疾病间的共同靶点,即CAP 抗缺血性卒中作用靶点。
功能富集分析包括基因本位(GO)生物过程富集分析和KEGG 通路的富集分析。GO[包括生物过程(BP)、细胞成分(CC)和分子功能(MF)]和KEGG 途径富集分析是描述候选靶点特征的常用方法。在本研究中,采用DAVID(https://david.nicifcrf.gov/)数据库(高通量功能注释生物信息学的在线平台)对CAP 抗缺血性卒中作用靶点进行GO和KEGG通路分析。
1.7.3 实验验证
1.7.3 .1 CAP介导的神经保护机制
为了确定PI3K是否参与了CAP的神经保护作用,在96 孔板(每孔6 × 103个细胞)中加入CAP 前1 h,向细胞中添加抑制剂(LY294002,10 μmol/L)。然后用MTT法测定其存活率。
1.7.3 .2 实时荧光定量检测PI3K、AKT mRNA的表达
使用Trizol 法提取细胞总RNA,使用逆转录试剂盒将RNA 逆转录成cDNA。使用荧光定量TB Green™Premix Ex Taq™Ⅱ试剂盒进行实时荧光定量PCR 反应。 引物序列为:PI3K 上游为5′ -CGAGGTTTTGCTGTTCGGTG-3′,下游为5′ -CAGGCCAAACCTCTGGCTAA-3′;Akt 上游为5′-CAGGATGTGGACCAACGTGA -3′,下游为 5′ -AAGGTGCGTTCGATGACAGT-3′;β-actin 上游为5′-AGCGAGCACAGCCCCAAAGTT-3′,下游为5′-GGGCACGAAGGCCAGACAGATT-3′。按照2-△△Ct法计算各基因的相对表达量。
1.8 统计学分析
采用SPSS 19.0 软件对所得数据进行单因素方差分析(ANOVA),计量资料采用均数±标准差(±s)表示,P<0.05代表差异具有统计学意义。
2 结果
2.1 CAP对细胞活力的影响
与正常组相比,模型组细胞活力明显下降(P<0.01)。而与模型组相比,CAP 中、高剂量组能显著升高OGD/R 细胞的活力(P<0.05,P<0.01),而CAP 低剂量组的作用则不明显。见图1。
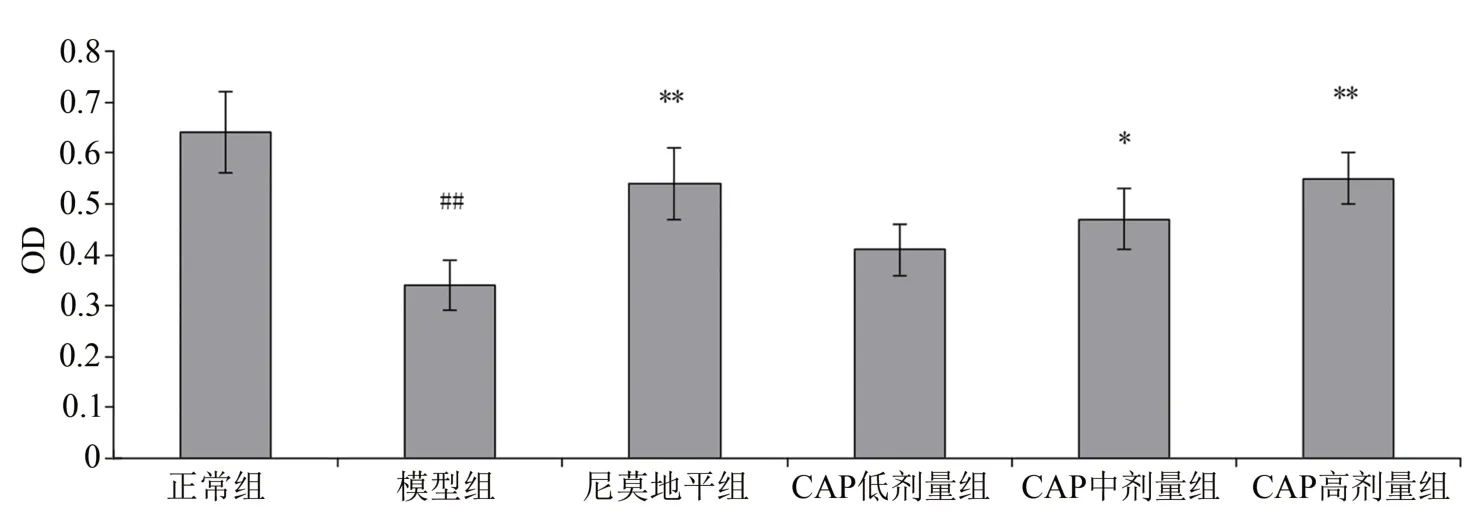
图1 OGD/R干预下CAP对细胞活力的影响
2.2 CAP对SH-SY5Y细胞核形态的影响
Hoechst 33342 染色后,正常组细胞的细胞核染色较均匀,形态接近,荧光弥散。模型组出现较多凋亡细胞,凋亡细胞的细胞核由于核浓集、固缩,呈团块状结构,荧光染色不均匀,另有些核呈分叶、碎片状。而与模型组相比,尼莫地平组和CAP 高剂量组凋亡细胞明显减少,细胞形态接近正常。见图2。
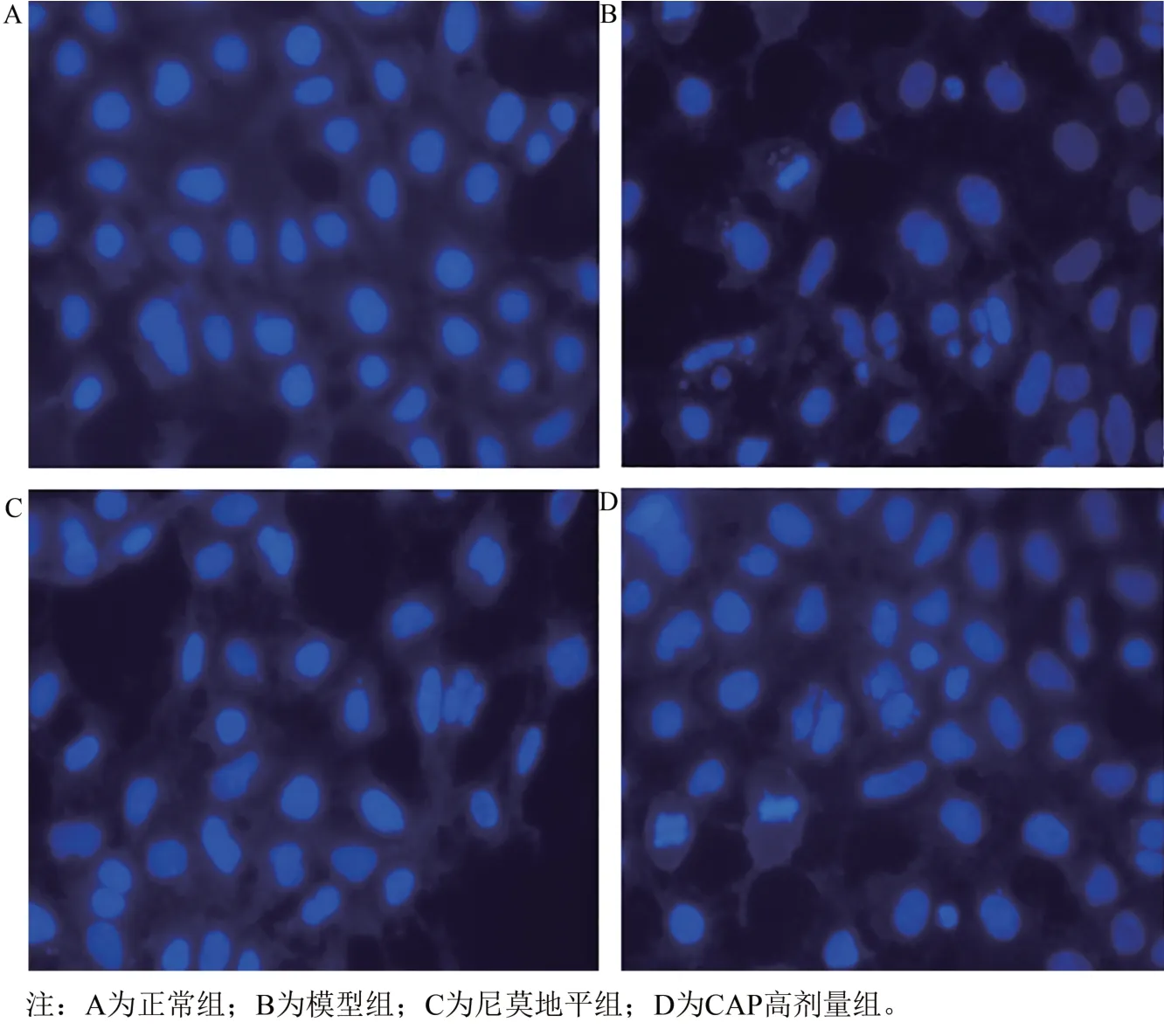
图2 CAP对SH-SY5Y细胞核形态的影响(Hoechst 33342染色,×400)
2.3 CAP对LDH水平、Caspase-3和Caspase-9活性的影响
与正常组相比,模型组LDH 水平和Caspase-3、Caspase-9 活性均显著升高(P <0.01);与模型组比较,CAP 中、高剂量组LDH 水平明显降低(P <0.05,P <0.01),Caspase-3、Caspase-9 活性也明显降低(P<0.05,P<0.01)。见表1。
表1 CAP对LDH 水平、Caspase-3、Caspase-9活性的影响(±s)
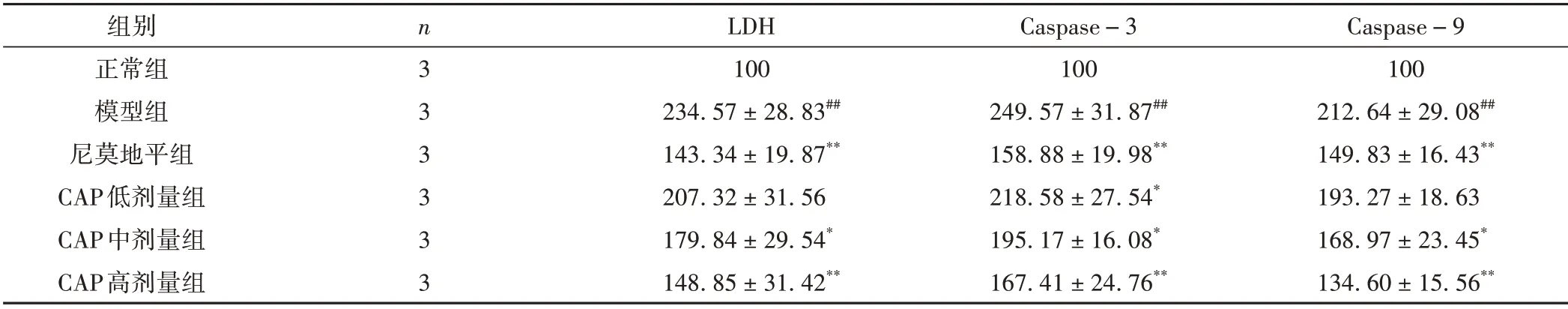
表1 CAP对LDH 水平、Caspase-3、Caspase-9活性的影响(±s)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
Caspase-9 100 212.64±29.08##149.83±16.43**193.27±18.63 168.97±23.45*134.60±15.56**组别正常组模型组尼莫地平组CAP低剂量组CAP中剂量组CAP高剂量组n3 3 3 3 3 3 LDH 100 234.57±28.83##143.34±19.87**207.32±31.56 179.84±29.54*148.85±31.42**Caspase-3 100 249.57±31.87##158.88±19.98**218.58±27.54*195.17±16.08*167.41±24.76**
2.4 CAP对Bcl-2、Bax mRNA表达的影响
与正常组相比,模型组Bax mRNA 表达显著升高(P <0.01),Bcl-2 mRNA 表达显著下降(P <0.01)。与模型组比较,CAP 中、高剂量组能明显增加Bcl-2 mRNA 表达,降低Bax mRNA 表达(P <0.05,P <0.01),而CAP 低剂量组的作用则不明显。见表2。
表2 CAP对Bcl-2、Bax mRNA表达的影响(±s)
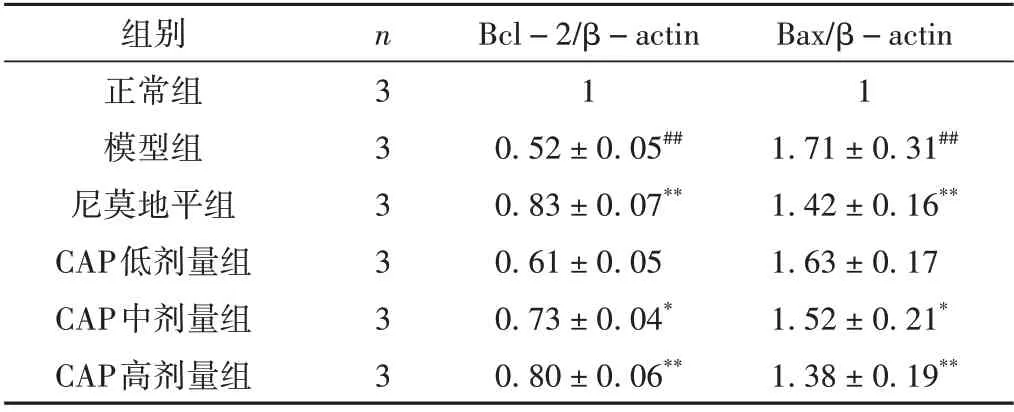
表2 CAP对Bcl-2、Bax mRNA表达的影响(±s)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
Bax/β-actin 1 1.71±0.31##1.42±0.16**1.63±0.17 1.52±0.21*1.38±0.19**组别正常组模型组尼莫地平组CAP低剂量组CAP中剂量组CAP高剂量组n3 3 3 3 3 3 Bcl-2/β-actin 1 0.52±0.05##0.83±0.07**0.61±0.05 0.73±0.04*0.80±0.06**
2.5 基于网络药理学探讨CAP 治疗缺血性卒中的潜在作用机制
2.5.1 CAP 的潜在靶点预测及缺血性卒中疾病相关靶点筛选结果
分别采用TCMSP、drug bank、DGldb、CTD 和Swiss target prediction 数据库检索及预测CAP 的靶点。剔除非人源靶点,去除重复的靶点,共获得了90 个CAP 活性成分的靶点,包括AKT1、VEGFA、BCL2、CASP3、MAPK1、FOS、PTGS2等。
通过drug bank、GENE CARD、OMIM、TTD、Disgenet数据库检索缺血性卒中疾病相关靶点,靶点合并,去除重复靶点,建立疾病靶点数据库。共获得1 552个缺血性卒中的疾病相关靶点,包括ALDH2、ABO、ZFHX3、ACTA2、PROCR、PDE3A、LOX、COL4A1等。
2.5.2 药物疾病共同靶点及共同靶点的功能富集分析
将预测的90个CAP 活性成分的靶点和1 552个缺血性卒中的疾病相关靶点取交集,得出药物疾病共同靶点59 个,即为CAP 抗缺血性卒中作用靶点。见图3、图4。
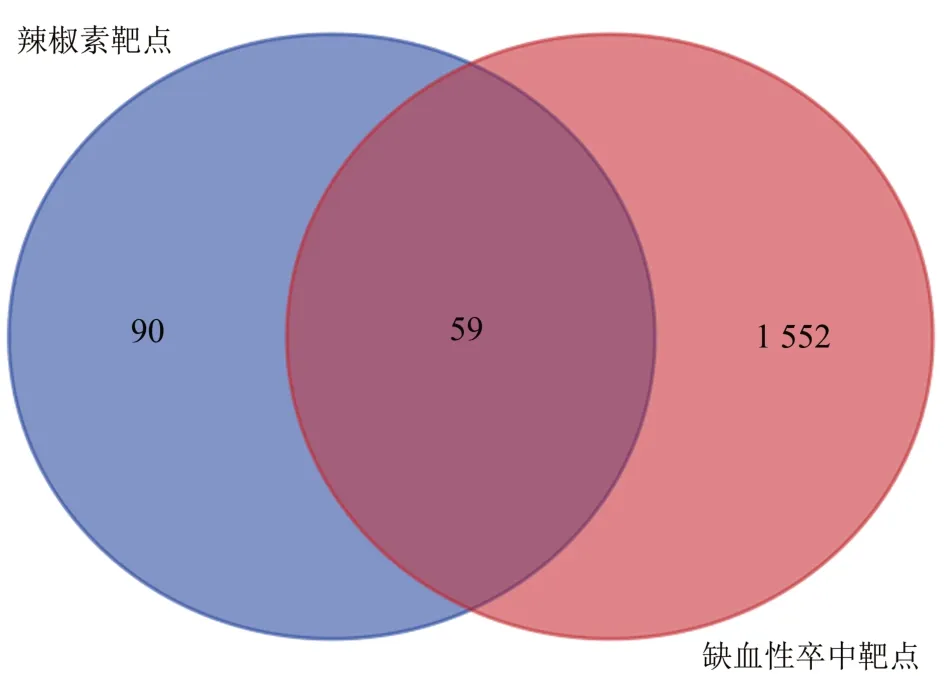
图3 CAP预测靶点和缺血性卒中靶点交集的韦恩图
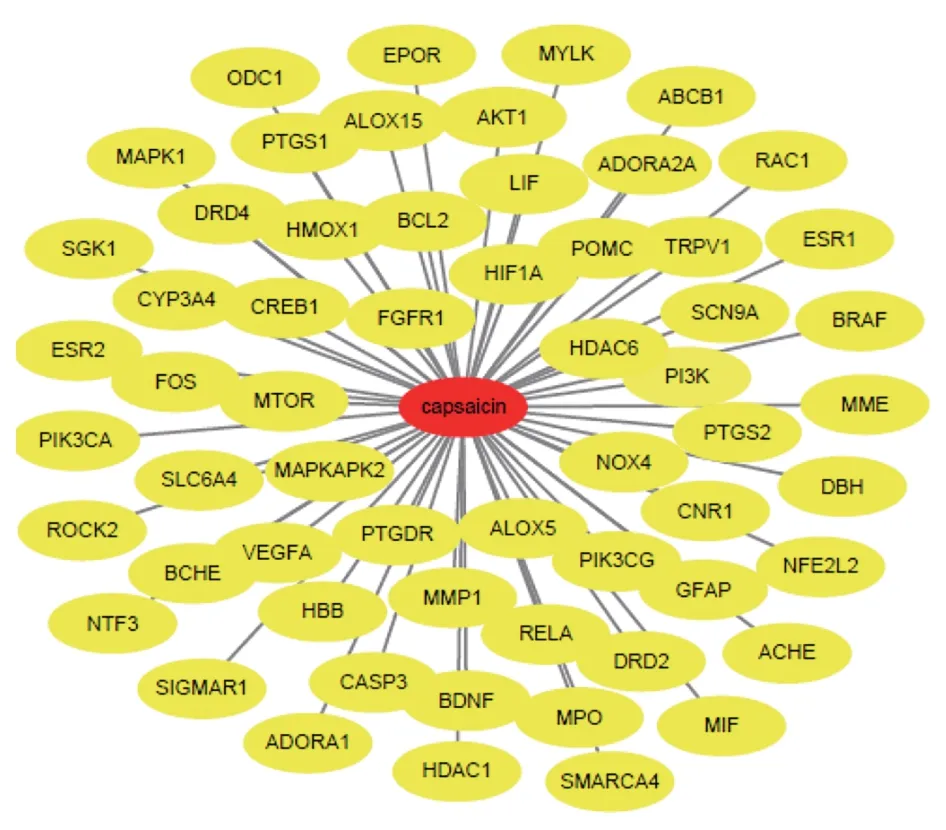
图4 CAP治疗缺血性卒中的潜在靶点
GO 通路分析结果表明,其生物学过程(BP)主要富集于认知、学习和记忆、肽基丝氨酸磷酸化等。细胞成分(CC)主要富集于神经元细胞体、突触前膜的组成成分、膜筏等。分子功能(MF)主要富集于血红素结合、蛋白丝氨酸/苏氨酸激酶活性、激活转录因子结合等。见图5。
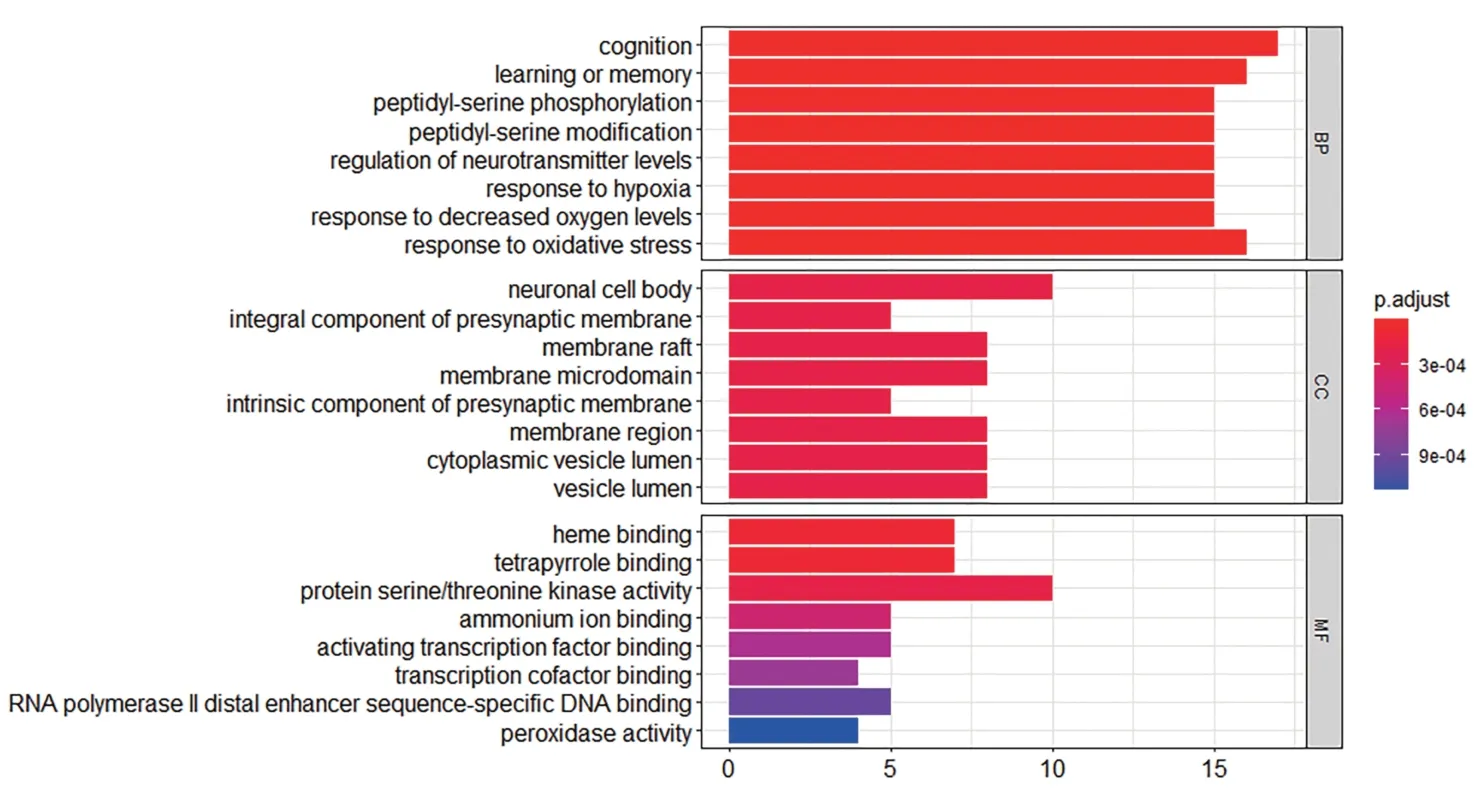
图5 CAP抗缺血性卒中主要有效成分靶点GO通路富集
此外,笔者还进行了KEGG 途径分析,用以探讨CAP 抗缺血性卒中的生物学途径。富集显著的前5 个信号通路依次为PI3K/Akt 信号通路、cAMP 信号通路、神经营养素信号通路、HIF-α 信号通路和TNF-α 信号通路。其中PI3K/Akt 信号通路富集最显著。见图6。
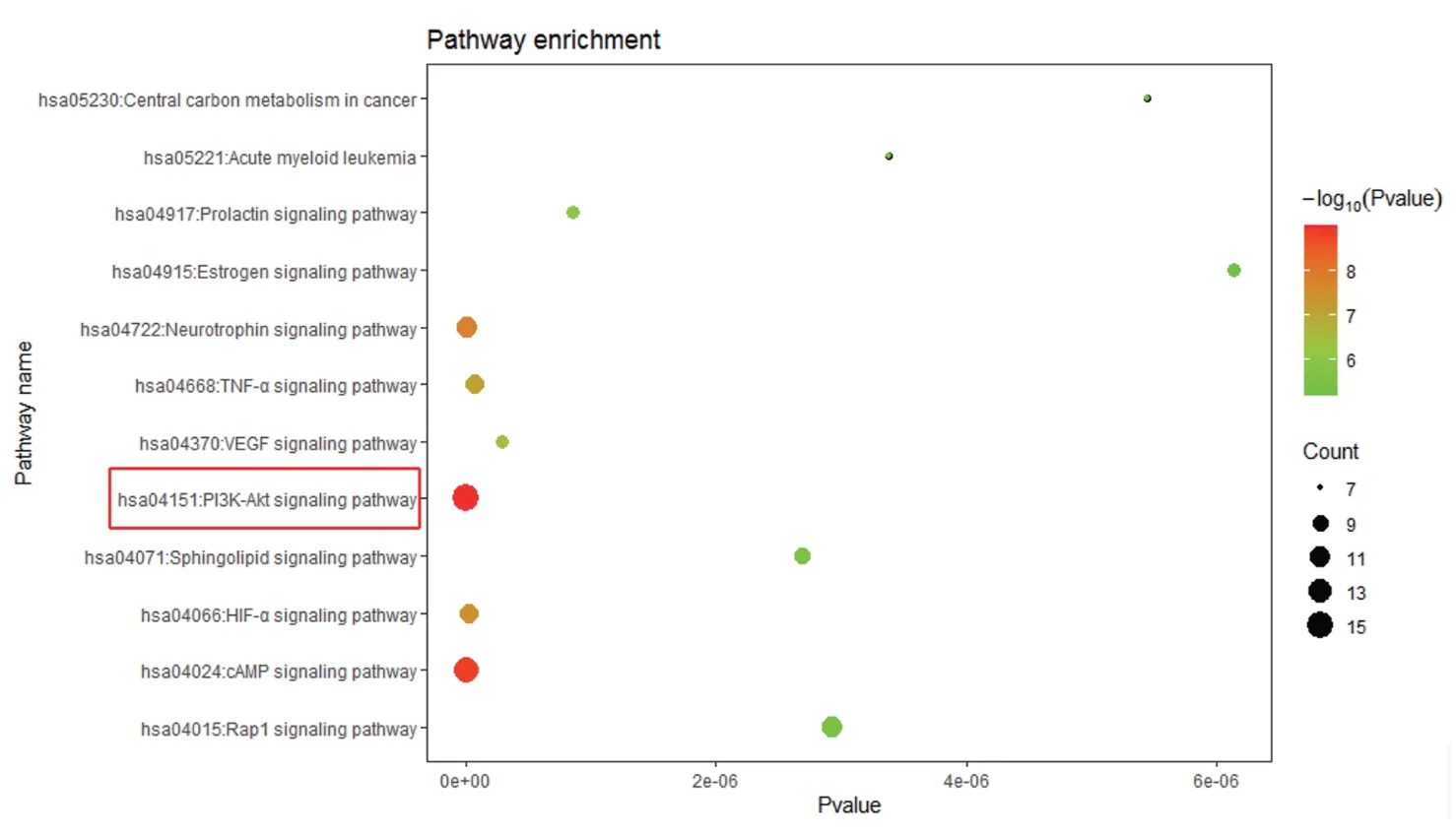
图6 CAP抗缺血性卒中主要有效成分靶点KEGG通路富集
2.5.3 PI3K介导的CAP神经保护机制
为了确定PI3K 是否参与保护SH-SY5Y 细胞在OGD/R 作用下的生存能力,在OGD/R 过程中用CAP 和LY294002(阻断PI3K)处理细胞,结果表明在OGD/R期间抑制PI3K 显著降低了CAP 的保护作用。此外,LY294002对细胞无影响。见图7。
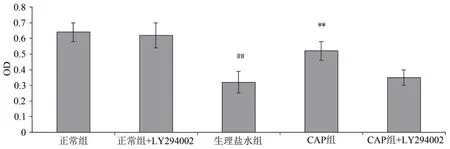
图7 OGD/R干预下PI3K(B)抑制剂对CAP的细胞活性保护作用的影响
2.5.4 CAP对PI3K、Akt mRNA的表达的影响
与正常组相比,CAP 中、高剂量组可显著增加PI3K、Akt mRNA 表达水平(P< 0.05,P< 0.01),而GAP低剂量组的作用则不明显(P>0.05)。见图8。
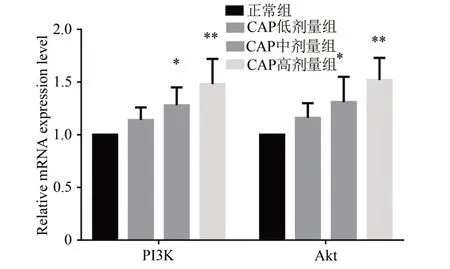
图8 CAP对PI3K,Akt mRNA表达的影响
3 讨论
作为缺血的体外模型,OGD/R 模型广泛应用于神经生化变化以及脑缺血损伤机制的体外研究中[13]。细胞活性在评价神经保护药物治疗缺血性脑疾病的有效性中起着重要作用。本研究发现,在缺血损伤的SHSY5Y 细胞模型中,用CAP 治疗可显著增加细胞的MTT 检测的OD 值,这一研究结果表明,CAP 对OGD/R诱导的损伤具有保护作用。LDH 是一种参与乳酸产生的糖酵解酶,存在于各种组织的细胞浆中。LDH 的释放与细胞膜完整性的破坏有关,通常被看作细胞毒性的指标[14]。LDH 水平的升高表明细胞膜完整性降低。在本研究中,CAP 预处理可显著降低OGD/R 损伤后的LDH 释放率。因此,CAP 可以保护细胞膜完整性免受OGD/R诱导的损伤。
脑缺血可诱导凋亡调节基因的表达,如Bax 和Bcl-2。脑缺血损伤相关的细胞凋亡是导致脑I/R 后细胞死亡的主要机制之一[15]。Bax 是一种凋亡前蛋白,与Bcl-2具有显著的序列同源性,激活Bax可加速细胞程序性死亡[16]。Bcl-2 是一种抗凋亡蛋白,能阻止细胞色素C 释放到细胞质中,这是细胞凋亡过程中的重要步骤[17]。Bcl-2 和Bax 通过形成同二聚体和异二聚体来调节细胞的凋亡。Bax 的过度表达可导致同二聚体的形成,诱导凋亡。相反,过度表达Bcl-2 可导致异二聚体的形成,从而抑制Bax 异二聚体诱导的细胞凋亡[18]。因此,Bcl-2/Bax 的比值能够调节脑缺血损伤引起的细胞凋亡。已知在Caspase家族中,特别是Caspase-3 和Caspase-9 活性,在细胞凋亡的执行中起着中心作用[19]。在本研究中,OGD/R 模型组Caspase-3 和Caspase-9 活性增高以及Bax mRNA 的上调、Bcl-2 mRNA 的下调共同导致了凋亡事件,而CAP 治疗可抑制缺血损伤后Caspase-3 和Caspase-9活性升高及Bax mRNA 的上调,Bcl-2 mRNA 表达增强。这些结果表明,CAP 对OGD/R 所诱导细胞凋亡导致的神经损伤具有保护作用。
为了进一步阐明CAP 的药理机制,笔者采用网络药理学的方法,对CAP 治疗缺血性脑卒中的作用机制进行研究。网络药理学作为一门新兴学科,建立在系统生物学的一般概念之上[20],常用于系统评价多成分药物的药理作用[21]。此外,最近也有研究提供了类似的方法来揭示各种复杂慢性疾病的分子机制,如神经病变和心脑血管疾病[22]。因此,基于大量现有数据库的网络分析可以初步了解多靶点药物治疗复杂疾病的机制。本文先使用TCMSP、drug bank、DGldb 和CTD 数据库检索并使用Swiss target prediction 预测了CAP 的靶点,并使用drug bank、OMIM、GENE CARD、Disgenet 和TTD 数据库获得缺血性卒中相关靶点,二者取交集,即CAP 抗缺血性卒中作用靶点。笔者对59 个CAP 治疗缺血性卒中的靶点进行了KEGG 途径分析,以此探讨CAP 抗缺血性卒中的生物学途径。富集显著的前5 个信号通路依次为PI3K/Akt 信号通路、cAMP 信号通路、神经营养素信号通路、HIF-α 信号通路、TNF-α 信号通路。其中PI3K/Akt 信号通路富集最显著。
研究表明,在生理和病理生理条件下,磷酸肌醇-3-激酶/Akt(PI3K/Akt)途径在调节细胞生长、增殖和存活中起着核心作用[23],并且PI3K/Akt 途径在缺血诱导的凋亡中起着重要作用[24]。已有研究证实,PI3K/Akt 途径能够上调抗凋亡蛋白并下调凋亡前蛋白[25]。在本研究中,笔者使用PI3K 抑制剂LY294002 来确定PI3K 激活是否参与了SH-SY5Y 细胞中OGD/R 损伤下的CAP的神经保护作用。结果显示,LY294002可以消除由CAP 诱导的神经保护作用,同时与正常组相比,CAP 中、高剂量组可显著增加PI3K、Akt mRNA 的表达水平(P<0.05,P<0.01),这些均提示CAP 的神经保护作用是通过激活PI3K/AKT通路来实现的。
综上,本研究证实了CAP 对OGD/R 诱导的神经元损伤的神经保护作用。CAP 能减轻OGD/R 诱导的SH-SY5Y 细胞损伤,减少细胞凋亡,这可能与激活PI3K/AKT 信号通路有关。由于脑I/R 损伤涉及多种信号通路的激活,其发生机制极其复杂,CAP是否还对别的通路如cAMP 信号通路等存在影响,仍有待进一步的研究。

